金属晶体空间利用率计算
- 格式:ppt
- 大小:585.50 KB
- 文档页数:8


六方最密堆积空间利用率和密度的计算,需要弄清堆积方式、晶胞切割方法、晶胞体积、晶胞中的原子数、原子的体积。
堆积方式为ABAB——(六方最密堆积)一定要区别于ABCABC---(面心最密堆积)*A面心立方密堆积密置层按三层一组相互错开.第四层正对着第一层的方式堆积而成。
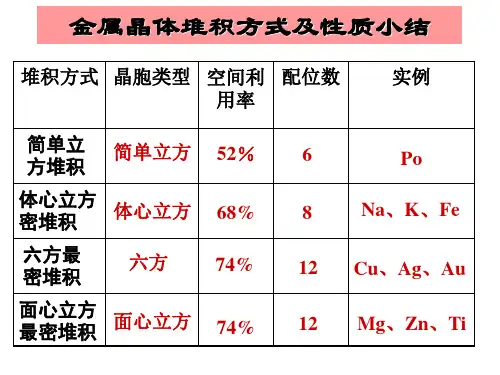
配位数为12,晶胞所含原子数为4金属原子空间利用率为74%。
*5 M代Pd. Cu? Ag等约50多种金属为面心立方密堆积。
而学生感到困难的是六方最密堆积的晶胞体积,因为它的晶胞是平行六面体,其余的金属晶体晶胞是正六面体!六方最密堆积计算的关键------晶胞体积六右最密堆积a o荃木找位为蓝色楙子六方密堆积晶跑四点间的夹角均为60° sin 60° =六方晶胞中.D4B0为正四曲体,正四曲体的高为c/2.a =b = 1RAE = a sin 6()(,= —a 一祎田刑舗 2AG = ~~d£ = -如晞赫 _ 3 3 DG 2 +JG 2 = =a) 即 DG = —ac A /6 —=■^―a 2 3c = —y[ba = — R 7 社鋼 3 3翕砲的高U = Nh3沧胞=S x h 先求s卸三高”一-即底而平石四边JF 劎高、J E 四面体的高、iftlS 的番在镁型堆积中取出六方晶胞,平行六面体的底是 平行四边形,各边长2=2“则平行四边形的面积’平行六面体的高=2个四面体的高:力=2 x 边长为a 的四面体高.V6 2V6=2 x ------- a — -------- a 3 3 【晶跑休积分解计算步聲归纳】 > “面、休、胸.求二盈•底承鼠 得晶8ft” *S = a ・ <7sin 60° = 再求H边形的面积,“体” 一四曲休. ft“甩” 一平行六囱体晶胞至此,你再求晶体空间利用率和晶体密度,障碍是不是消失了?。

晶胞的计算一、晶胞在高考中的地位分析:2008、2009年新课标,未对晶胞的计算进行考查;2010年新课标:37(4),一空,化学式的计算;2011年新课标:37(5),三空,晶胞中原子个数及密度的计算;2012年新课标:37(6),两空,晶胞密度、离子距离的计算。
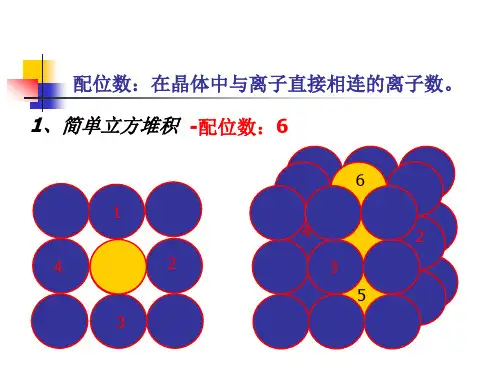
二、常见的晶胞计算题:第一类:金属堆积方式的简单计算(空间利用率和密度)[选三P76] 晶胞密度 =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100%【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm①简单立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:②体心立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:③面心立方最密堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:再假设该金属的摩尔质量为Mg/mol,N A为阿伏伽德罗常数的数值,试计算该晶胞的密度:【总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl、CsCl、CaF2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为 a cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O的比值却发生了变化。






课时65 晶体结构的分析与计算题型一 晶体结构的分析与方法【考必备·清单】 1.晶胞结构的分析(1)判断某种微粒周围等距且紧邻的微粒数目时,要注意运用三维想象法。
如NaCl 晶体中,Na +周围的Na +数目(Na +用“○”表示):每个面上有4个,共计12个。
(2)记住常见晶体如干冰、冰、金刚石、SiO 2、石墨、CsCl 、NaCl 、K 、Cu 等的空间结构及结构特点。
当题中信息给出的某种晶胞空间结构与常见晶胞的空间结构相同时,可以直接套用该种结构。
2.晶胞中微粒数目的计算方法——均摊法(1)原则:晶胞中任意位置上的一个原子如果是被n 个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是1n。
(2)方法长方体(包括立方体)晶胞中不同位置的粒子数的计算方法如图所示:3.“均摊法”在晶胞组成计算中的应用 (1)计算一个晶胞中粒子的数目非平行六面体形晶胞中粒子数目的计算同样可用“均摊法”,其关键仍是确定一个粒子为几个晶胞所共有。
例如,石墨晶胞:每一层内碳原子排成六边形,其顶点(1个碳原子)对六边形的贡献为13,那么一个六边形实际有6×13=2个碳原子。
又如,六棱柱晶胞(MgB 2晶胞)中,顶点上的原子为6个晶胞(同层3个,上层或下层3个)共有,面上的原子为2个晶胞共有,因此镁原子个数为12×16+2×12=3个,硼原子个数为6。
(2)计算原子晶体中共价键的数目在金刚石晶体(如图所示)中,每个C 参与了4个C—C 键的形成,而在每条键中的贡献只有一半,因此,平均每一个碳原子形成共价键的数目为4×12=2个,则1 mol 金刚石中碳碳键的数目为2N A 。
(3)计算化学式【探题源·规律】角度一:晶胞中微粒数目及晶体化学式的计算[例1] (1)(2019·全国卷Ⅱ)一种四方结构的超导化合物的晶胞如图1所示。
晶胞中Sm 和As 原子的投影位置如图2所示。