(完整版)晶体的配位数,密度,距离空间利用率计算
- 格式:doc
- 大小:446.51 KB
- 文档页数:3






晶体密度、空间利⽤率的通⽤计算⽅法晶体密度、空间利⽤率的通⽤计算⽅法以⾦属晶体为例进⾏分析,计算⽅法如下:第⼀步,确定晶胞含有的微粒数。
若1个晶胞中含有x 个微粒,则: (1)1个晶胞中原⼦利⽤的体积 = x ·4 π r 3 / 3 ,其中r 表⽰⾦属原⼦半径。
(2)1个晶胞质量 = x ·M / N A ,其中M 表⽰⾦属的摩尔质量,N A 表⽰阿伏加德罗常数。
若计算对象是离⼦晶体,该式亦然成⽴,M 则表⽰离⼦化合物的摩尔质量。
第⼆步,计算晶胞体积。
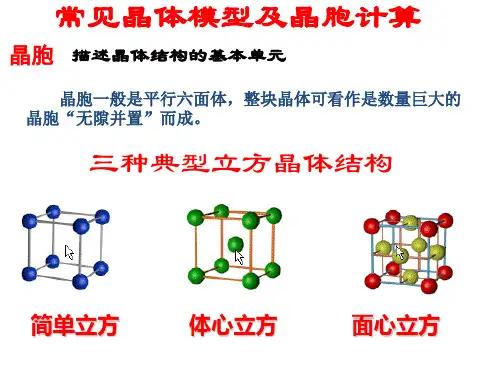
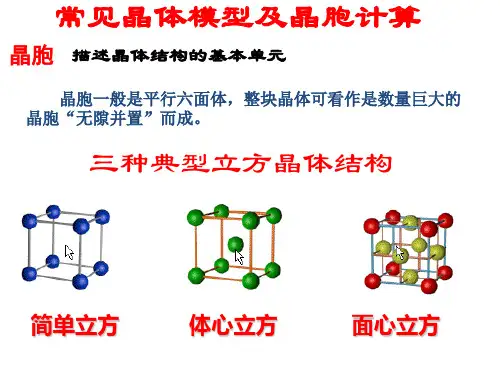
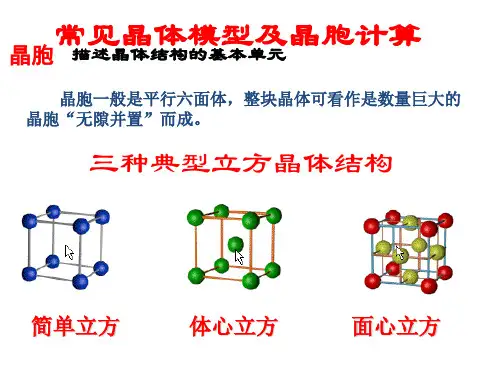
不同类型晶胞的体积有不同计算⽅法,⽤a 表⽰晶胞棱长,a 3表⽰晶胞的体积,r 表⽰⾦属原⼦半径,归纳总结如下:(1)简单⽴⽅结构,晶胞体积a 3 =(2r ) 3 =8r 3 ;侧⾯形状及数据为:,(2)体⼼⽴⽅结构,晶胞体积a 3 =64√3r 3 / 9 ;(3)六⽅堆积结构,晶胞体积a 3 = 8√2 r 3 ;晶胞相关数据为为:(4)⾯⼼⽴⽅结构,晶胞体积a 3 =16√2 r 3 ;a√2a√3a4r= 2r(1)有关晶体密度的计算通⽤关系式:x·M /N A=ρ·a3,依据是晶体密度等于晶胞密度,具体计算时把各类型晶胞的体积,代⼊关系式即可,下式亦同。
(2)有关空间利⽤率的计算通⽤关系式:x·4 πr3 / 3=w%·a3,其中w% 表⽰晶胞空间利⽤率。
注意事项:(1)在实际计算时要注意长度单位换算,晶胞棱长及原⼦半径单位常⽤pm,⽽密度中的体体积单位常⽤(cm)3,存在换算关系1pm=10-10cm。
(2)若计算离⼦晶体密度,⽅法⼤同⼩异,需要综合考虑阴、阳离⼦半径来求晶胞体积。
常见⾦属晶胞结构与性质归纳⼀览表:。
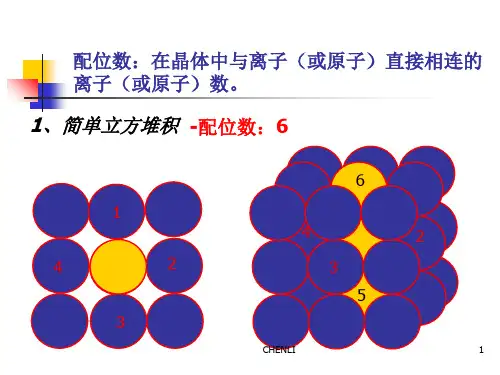
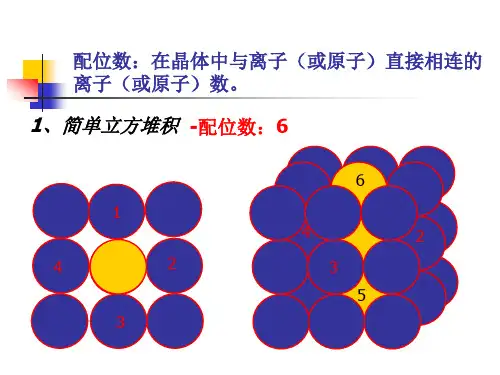
二. 晶体的配位数,密度,距离,空间利用率计算
1.课本模型图
一个CO2分子周围阳离子的配位数是阳离子的配位数是
有个分子紧邻阴离子的配位数是阴离子的配位数是
阳离子周围的阳离子阳离子周围最近的阳离子数
阴离子周围的阴离子阴离子周围最近的阴离子数CaF2
CaF2
F-的配位数是简单立方堆积体心立方堆积
Ca2+的配位数是配位数是配位数是
Ca2+周围的最近Ca2+数是
F-周围最近的F-数是
面心立方最密堆积六方最密堆积金刚石
配位数是配位数是配位数是
标出A,B,C各层的原子
2、在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石
的晶胞如右图所示,则其中Ti4+的配位数为化学式为
3.晶体中距每个X原子周围距离最近的Q原子有个.
每个Q原子周围距离最近的X原子有个,
Z原子周围距离最近的X有个,
每个X原子周围距离最近的Z原子有个,
每个Z原子周围距离最近的Q原子有个
4.若en若若若若若若 若
若若若若[Pt(en)2]Cl4若若若若若若若若若 若σ若若若若 若
配离子[PtEn)2]4+的配位数为,该配离子含有的微粒间的作用力类型有
5.立方氮化硼,其结构和硬度都与金刚石相似。
(1)晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3.(只要求列算式).(2)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标
明B与N的相对位置.
6.列式表示(NA表示阿伏伽德罗常数的值)
(1)钋原子半径为 r pm,相对原子质量为M,晶体钋的密度空间利用率(2)钠原子半径为 a pm,晶体钠的密度空间利用率
(3)银原子半径为 d cm,银晶体的密度空间利用率
(4)锌原子半径为 b nm 锌晶体的密度空间利用率
7.列式并计算
(1)铁原子半径为 r pm铁晶体有2种分别是钾型铜型,铁晶体的钾型铜型密度之比为(2)金刚石原子半径为 r pm列式并计算表示空间利用率
8.(1)已知CaF2晶体密度为dg/cm3则F﹣与F﹣的最短距离为nm,F﹣与Ca2+最短距离
为pm. (2)CaF2的Ca2+,F-半径分别为 r1,r2pm,把晶胞看成阳离子刚性球堆积,阴离子填充其中列式表示CaF2晶胞空间利用率 Ca2+间最近距离,F-间最近距离
9.已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm,列式表示其比表面积
m2/g。
答案
12, 6,6,12,12,8,8,6,6 8,4,12,6 6 8 12, 12, 4(1);
(2).
6000
D。