第13章 不饱和醛酮和取代醛酮
- 格式:ppt
- 大小:3.94 MB
- 文档页数:48
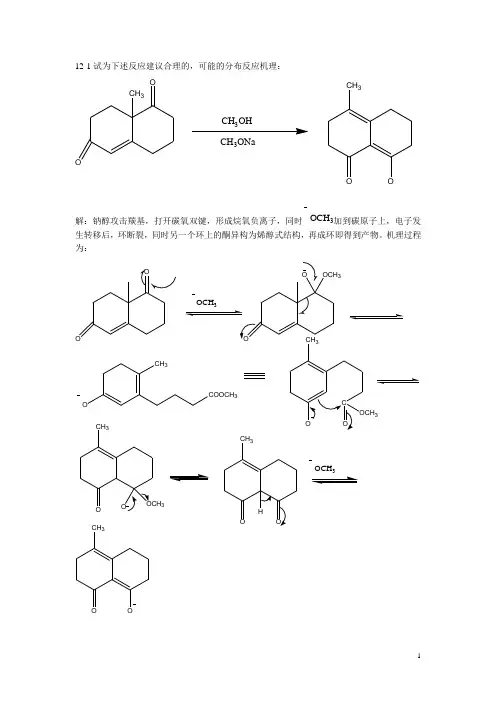
12-1试为下述反应建议合理的,可能的分布反应机理:O CH 3OCH3OHCH3ONaCH3OO解:钠醇攻击羰基,打开碳氧双键,形成烷氧负离子,同时OCH3加到碳原子上,电子发生转移后,环断裂,同时另一个环上的酮异构为烯醇式结构,再成环即得到产物。
机理过程为:OOOCH3OO OCH3CH3COOCH3O CCH3O OOCH3 CH3O OCH3OCH3HO OOCH3OCH3O12-2反应机理推断 1)CHO+CH 3NO 2NaOHC HCHNO 2(2)C OR 'CH 2R+HCHO +HN(CH 3)2HCOR 'H C RCH 2N(CH 3)2解(1)硝基甲烷在碱性条件下失去一个质子形成碳负离子,碳负离子为亲核试剂,攻击羰基使电子转移形成氧负离子,得到一个质子后氧负离子变为羟基,脱去一分子水形成双键,得到所求产物,反应机理如下:OHCH 3NO 2OHCH 2NO 2+CH 2NO2C OHCH 2NO2C OH HCH 2NO 2H 2OCH CHNO 2(2)甲醛与仲胺发生加成反应,羟基在酸性条件下脱去形成双键和氮原子,酮异构为烯醇结构,电子转移后发生亲核加成得到产物,过程为:H 2CO+HN(CH 3)2H 2COHN(CH 3)2HH 2CN +(CH 3)2COR 'CH 2RHCCHROHR'H 2CN(CH 3)2COHR 'H C CH 2N(CH 3)2RCR 'H C OHRCH 2N(CH 3)2-H +12-3对下列反应提出合理解释。
OO+OEtONaOO解; 该题涉及两个反应,分别为碳负离子与羰基加成以及碳负离子与αβ不饱和烯烃的迈克尔加成反应,均为碳负离子机理。
机理为:OOEtO -OOOOOEtO -OOO OHO O-H 2OOOO12-4用合理分步的反应机理解释下列反应事实:OOOHOHHOO解:环状缩酮中的一个O 结合H 开环生成羟基,另一个收H 2O 攻击,碳氧双键断裂。



Xiezx -Lzu2一、α,β-不饱和醛酮二、醌三、羟基醛酮四、不饱和酸及其衍生物内容Xiezx -Lzu3C=C C=OC C C=O C C C=O C C=C O+_Br BrBr C=C C O +_+_C=C C OLi R C=C C OHRC C=C OH NuRLiH O1.Nu (1)(2)(3)(1)(2)(3)2.H C C C=O NuC=C 亲电加成C=O 亲核加成1,4-共轭加成α,β-不饱和醛酮的加成反应1、分类一、α,β-不饱和醛酮Xiezx-Lzu4C C=C OHNu H +互变异构C=C C=O+Nu -C C=C O -Nu C C C=O _Nu C C C=ONu H在碱性条件下1,4-加成反应的机理Xiezx-Lzu5C C=C OHC=C C OH++C=C C=O + H+Z -互变异构C C=C OH C C C=O ZZH在酸性条件下1,4-加成反应的机理Xiezx -Lzu61.卤素、HOX 不发生共轭加成,只在C=C 双键上发生亲电加成。
2.HX 、HCN 、NH 3及NH 3的衍生物等与α,β-不饱和醛酮的加成以发生1,4-共轭加成为主。
3.不饱和醛与RLi, RMgX 反应时以C=O 双键的1,2-亲核加成为主。
与R 2CuLi 反应,以1,4加成为主。
4.不饱和酮与金属有机物加成时,使用RLi,主要得C=O 的1,2-加成产物,使用R 2CuLi,主要得1,4-加成产物,使用RMgX,如有亚铜盐如CuX 做催化剂,主要得1,4-加成产物,如无亚铜盐做催化剂,发生1,2加成还是1,4-加成,与反应物的空间结构有关,空阻小的地方易发生反应。
α,β-不饱和醛酮加成反应的规律Xiezx -Lzu7C 6H 5CH=CHCOC 6H 5KCN,HOAc EtOH C 6H 5CHCH 2COC 6H 5CNRCH=CHR'KCN, HOAc EtOHN. R.(1)93-96%C 6H 5CH=CHCOCH 3C 6H 5CHCH 2COCH 3NHN+(2)(3)1,4-产物85%HX 、HCN 、NH 3及NH 3的衍生物与α,β-不饱和醛酮的加成以发生1,4-共轭加成为主.CH 2=CH-CH=O+ HCl-15o CClCH 2CH 2CH=O例子Xiezx -Lzu8(CH 3)2C=CHCOCH 3CH 2=CH-CCH 2COCH 3+(CH 2=CH -)2CuLi1. Et 2O2. H 2OCH 3CH 3(4)72%1. Et 2O2. H 2OOCH 3+(CH 3)2CuLi OCH 3CH 3(5)98%R 2CuLi 与α,β-不饱和醛酮的加成反应,以1,4-加成为主。

第十三章不饱和醛酮及取代醛酮(Unsaturated Aldehydes and Ketones)(Substituted Aldehydes and Ketones)一α, β–不饱和醛酮 (α,β- Unsaturated Aldehydes、Ketones)制备:反应:1 加HCNα,β-不饱和酮主要发生1 , 4-加成α,β-不饱和醛发生1 , 2 -加成例:例:例:2 加RMgX格氏试剂与α, β–不饱和醛、酮发生反应,1 , 2 -加成,1 , 4-加成产物均有,哪种产物为主,取决于α, β–不饱和醛、酮的结构。
体系中微量Cu+的存在,1,4-加成产物比例增加:例:例:3 加R2CuLiR2CuLi 与α,β-不饱和醛酮主要发生1 , 4-加成4 插烯作用5 迈克尔(Michael)反应定义:烯醇负离子与α,β-不饱和羰基化合物的1,4-加成反应。
能提供烯醇负离子的化合物:共轭体系:例:结论:利用迈克尔反应可以合成1,5-二羰基化合物。
用途:通常用迈克尔反应和羟醛缩合一起合成环状化合物。
例:例:例:练习:合成:分析:例:合成:分析:例:合成:分析:6 还原反应例:7 D–A反应二醌定义:含有共轭环己二烯二酮结构的一类化合物。
醌是一类特殊的环酮,可由芳香族化合物制备,但醌环没有芳香族化合物的特性。
11. 命名2 反应X-射线测出对苯醌的碳碳键长是不均等的,实测数据表明对苯醌是一个环烯酮,相当于α,β-不饱和酮。
1). 还原反应2). 羰基的亲核加成3). 共轭加成4). D-A反应4 制备三羟基醛酮 (Hydroxy Aldehydes、Ketones)α-羟基醛酮的制备:1 安息香缩合反应在氰离子的催化作用下,两分子苯甲醛缩合生成二苯羟乙酮(安息香)的反应。
注意:安息香缩合反应的原子利用率高达100%,但其使用的催化剂KCN有剧毒,催化剂改成维生素B1后,这个反应更符合绿色化学的要求。



13--不饱和醛酮及取代醛酮§1.α,β-不饱和醛酮不饱和醛酮分子中,C=C 位于α-和β-碳原子间的称谓α,β-不饱和醛酮;位于β-和γ-碳原子间的,则称为β,γ-不饱和醛酮,由于前者和羰基组成共轭体系,所以比后者更稳定。
例如:H 2C CHCH 2CH OH 3CHC CHCH O△H =-25kJ/mol 放热 反 应在酸或碱催化下,3-丁烯醛容易转变成2-丁烯醛: ①在碱催化下:H 2C CHCH 2CH O H 3CHC CHCH O+OH H 2O +CH 2=CHCHCH=OCH 2=CHCH=CH OCH 2CH=CHCH=O②在酸催化下:H 2C CHCH 2CH O2C CH CH 2CH OHH 2C C HCH 2HC OHH +H 2C C H C H C H OH3CH C H CHOHCH 3CH=CHCH OHH 3CHC CH CH=OH- H +CH 3CH=CHCH=O1.α,β-不饱和醛酮 的反应 (1) 亲核加成:①与HCN 加成α,β不饱和酮与HCN 反应,主要生成1,4加成产物:α,β不饱和醛与HCN反应,主要生成1,2加成产物。
②与格氏试剂加成羰基上的取代基大小对1,2 和 1,4 加成有一定影响。
下列反应中的数据也说明了羰基上取代基大小对1,2和1,4 加成的影响:C6H5HC CHCOR(1)C H MgBr3C6H5HC CH COHRC2H5+C6H5CHCH2COR2H5 1,2-加成产物1,4-加成产物R=H CH3 C2H5 CH(CH3)2 C(CH3)3 C6H5 1,4-加成产物% 0 60 71 100 100 99③与烃基锂加成主要发生在1,2加成:④与二烃基酮锂加成以1,4 加成为主H OO(2)、亲电加成αβ不饱和醛酮与亲电试剂,一般都发生1,4加成OHBr(g)OBr (3)还原①使羰基还原②使双键还原③使羰基,双键同时被还原(催化加氢)H 3CH 2CH 2CHC CCHOCH 2CH 3H 2CH 3CH 2CH 2CH 2CHCH 2OH2CH 3(4)氧化αβ不饱和醛在温和条件下,可氧化为αβ不饱和羧酸(5)狄尔斯-阿尔德反应(Diels-Alder )反应2. α,β-不饱和醛酮的制备 有醛酮的缩合反应制备。