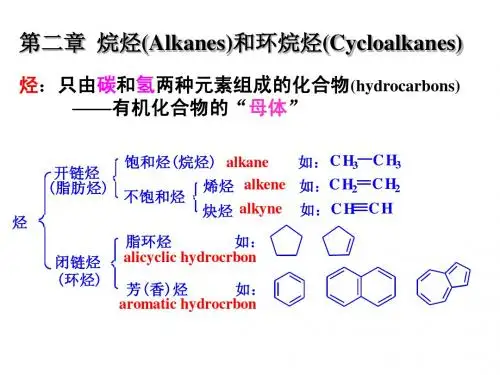
烷烃和环烷烃讲解
- 格式:ppt
- 大小:762.50 KB
- 文档页数:32

烷烃与环烷烃区别
一、结构不同
1、烷烃:是开链的饱和链烃(saturated group),分子中的碳原子都以单键相连,其余的价键都与氢结合而成的化合物。
2、环烷烃:含有脂环结构的饱和烃。
有单环脂环和稠环脂环。
含有1个脂环且环上无取代烷基的环烷烃,分子通式为CnH₂n。
二、范围不同
烷烃包括环烷烃,环烷烃是烷烃的一种。
三、性质不同
1、烷烃:低沸点(boiling point)的烷烃为无色液体,有特殊气味;高沸点烷烃为黏稠油状液体,无味;烷烃的物理性质随分子中碳原子数的增加,呈现规律性的变化;烷烃中的氢原子被卤原子(即第七主族元素)取代的反应称为卤化反应(halogenation)。
2、环烷烃:环烷烃有很高的发热量,凝固点低,抗爆性介于正构烃和异构烃之间。
化学性质和烷烃相似。
其中以五碳脂环和六碳脂环的性质较稳定。


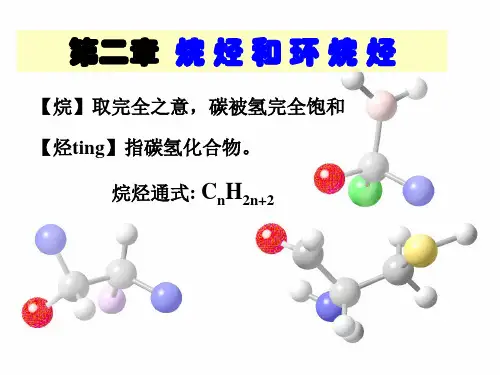
烷烃烷烃即饱和烃(saturated group),是只有碳碳单键的链烃,是最简单的一类有机化合物。
烷烃分子里的碳原子之间以单键结合成链状(直链或含支链)外,其余化合价全部为氢原子所饱和。
烷烃分子中,氢原子的数目达到最大值,它的通式为CnH2 n+2。
分子中每个碳原子都是sp3杂化。
最简单的烷烃是甲烷。
烷烃中,每个碳原子都是四价的,采用sp3杂化轨道,与周围的4个碳或氢原子形成牢固的σ键。
连接了1、2、3、4个碳的碳原子分别叫做伯、仲、叔、季碳;伯、仲、叔碳上的氢原子分别叫做伯、仲、叔氢。
为了使键的排斥力最小,连接在同一个碳上的四个原子形成四面体(tetrahedro n)。
甲烷是标准的正四面体形态,其键角为109°28′(准确值:arccos(-1/3))。
理论上说,由于烷烃的稳定结构,所有的烷烃都能稳定存在。
但自然界中存在的烷烃最多不超过50个碳,最丰富的烷烃还是甲烷。
由于烷烃中的碳原子可以按规律随意排列,所以烷烃的结构可以写出无数种。
直链烷烃是最基本的结构,理论上这个链可以无限延长。
在直链上有可能生出支链,这无疑增加了烷烃的种类。
所以,从4个碳的烷烃开始,同一种烷烃的分子式能代表多种结构,这种现象叫同分异构现象。
随着碳数的增多,异构体的数目会迅速增长烷烃还可能发生光学异构现象。
当一个碳原子连接的四个原子团各不相同时,这个碳就叫做手性碳,这种物质就具有光学活性。
烷烃失去一个氢原子剩下的部分叫烷基[1],一般用R-表示。
因此烷烃也可以用通式RH来表示。
烷烃最早是使用习惯命名法来命名的。
但是这种命名法对于碳数多,异构体多的烷烃很难使用。
于是有人提出衍生命名法,将所有的烷烃看作是甲烷的衍生物,例如异丁烷叫做2-一甲基丙烷。
现在的命名法使用IUPAC命名法,烷烃的系统命名规则如下:找出最长的碳链当主链,依碳数命名主链,前十个以天干(甲、乙、丙、丁、戊、己、庚、辛、壬、癸)代表碳数,碳数多于十个时,以中文数字命名,如:十一烷。





烷烃与环烷烃的结构与性质烷烃与环烷烃是有机化合物中的两类基本结构类型,它们在碳原子间的连接方式以及分子结构上存在着明显的差异,这也导致了它们在性质上的显著区别。
下面将就烷烃和环烷烃的结构与性质进行详细讨论。
1. 烷烃的结构与性质烷烃是一类碳氢化合物,其分子中只包含碳碳键和碳氢键,没有其他官能团。
烷烃根据碳原子之间的连接方式可以分为直链烷烃和支链烷烃两种。
直链烷烃的一般分子式为CnH2n+2,其中n为大于等于1的整数。
直链烷烃的碳原子按照链状排列,最简单的直链烷烃为甲烷,其分子式为CH4。
直链烷烃的性质主要取决于其分子量和分子结构,通常是无色、无味、无毒的气体或液体,具有较好的燃烧性能。
支链烷烃是指在碳原子链上存在支链或分支结构的烷烃,例如异构的正丁烷和2-甲基丁烷。
支链烷烃的性质通常比直链烷烃具有较强的空间立体结构,因此支链烷烃的沸点、密度、熔点等性质会与直链烷烃有所不同。
2. 环烷烃的结构与性质环烷烃是一类碳氢化合物,其分子结构中存在一个或多个碳原子环。
根据不同的碳环数目,环烷烃可以分为环丙烷、环戊烷等不同类型。
环烷烃的分子式通常为CnH2n,其中n为大于等于3的整数。
环烷烃由于分子结构上存在环状碳骨架,因此其性质与烷烃有较大差异。
环烷烃通常具有较高的沸点和熔点,且不易溶于一般有机溶剂。
环烷烃中的环状结构会影响其立体构型和空间结构,因此环烷烃也具有较强的立体异构性。
环烷烃的立体异构性在有机合成反应中具有重要的意义,常被用于合成一些特定结构的有机物。
综上所述,烷烃与环烷烃在结构与性质上存在着明显的差异,了解烷烃与环烷烃的结构与性质不仅有助于理解有机化合物的基本特征,还能为有机合成反应的设计与调控提供重要参考。