影响银镜反应的实验因素探讨
- 格式:doc
- 大小:86.00 KB
- 文档页数:3


第1篇实验背景银镜反应是化学实验中常见的鉴别醛类化合物的重要反应,它基于醛类化合物具有还原性,可以将银氨溶液中的银离子还原为银单质,从而在试管壁上形成光亮的银镜。
本实验旨在探究不同条件下银镜反应的效率,并分析影响银镜形成的关键因素。
实验目的1. 探究不同浓度硝酸银溶液对银镜反应效果的影响。
2. 分析不同温度对银镜反应速率和效果的影响。
3. 研究乙醛浓度对银镜反应的影响。
4. 总结银镜反应的最佳条件。
实验方法1. 实验材料:硝酸银溶液、氨水、乙醛、试管、试管夹、酒精灯、水浴锅等。
2. 实验步骤:- 配制不同浓度的硝酸银溶液。
- 设置不同的水浴温度。
- 配制不同浓度的乙醛溶液。
- 将配制好的溶液按照一定的比例混合,置于试管中。
- 将试管放入水浴锅中加热,观察银镜的形成情况。
- 记录实验现象,分析实验结果。
实验结果1. 硝酸银浓度的影响:随着硝酸银浓度的增加,银镜的形成速度加快,但银镜的亮度并没有显著提高。
当硝酸银浓度超过一定值后,银镜的亮度反而有所下降。
2. 温度的影响:温度对银镜反应的影响较为显著。
在较低温度下,银镜的形成速度较慢;随着温度的升高,银镜的形成速度加快。
但温度过高时,银镜的亮度会下降,甚至无法形成银镜。
3. 乙醛浓度的影响:乙醛浓度对银镜反应的影响与硝酸银浓度的影响类似。
在一定范围内,乙醛浓度的增加可以加快银镜的形成速度,但过高的乙醛浓度会导致银镜的亮度下降。
结论1. 硝酸银浓度:银镜反应的最佳硝酸银浓度为5%左右。
过高或过低的浓度都会影响银镜的形成效果。
2. 温度:银镜反应的最佳温度为50-60℃。
过高或过低的温度都会影响银镜的形成速度和亮度。
3. 乙醛浓度:乙醛反应的最佳浓度为5%左右。
过高的乙醛浓度会导致银镜的亮度下降。
4. 实验最佳条件:综合考虑以上因素,银镜反应的最佳条件为:5%的硝酸银溶液、50-60℃的水浴温度、5%的乙醛浓度。
实验讨论1. 实验误差:实验过程中可能存在一定的误差,如操作误差、测量误差等。


银镜反应最佳条件的探究银镜反应最佳条件的研究学生姓名:学习人数:课程名称:中学化学实验教学小组成员:教师:实验时间:七个银镜反应最佳条件的研究1。
银镜反应作为有机化学中的一个重要反应,在高中化学教学中起着非常重要的作用高中化学必修2和选修5用银镜反应演示醛基的性质,测试醛基的反应。
然而,通过文献检索,许多教师发现实验的成功率不高。
教材中的乙醛银镜反应课堂演示实验是按其方法进行的,成功率低,现象少,效果差。
许多学生发现在实验中很难制作出漂亮的银镜。
本文总结了学生实验失败的原因如下:1)试管的洁净度为。
如果试管内壁附着一层银,试管必须相对干净。
然而,尽管教科书要求学生在干净的试管中进行实验,它只使用了一个简短的句子来解释:在干净的试管中结果,许多学生没有连续清洗试管,导致试管不像想象的那样“干净”。
这是许多学生失败的原因之一。
2)银铵溶液的制备银铵溶液的制备是实验成功的另一个关键。
将稀氨水逐滴加入硝酸银溶液中,直到最初的沉淀物溶解。
如果过量加入氨水,溶液中的银离子浓度会根据银(NO3)2-的稳定常数而降低,不利于银镜的形成。
学生在配制银铵溶液时,很容易不小心加入过多的氨水,导致所得银铵溶液中氨过多,导致实验失败。
3)水浴期间试管晃动由于银镜形成过程相对较长,学生在等待过程中很容易不耐烦,在水浴加热时拿起试管观看,导致试管晃动,导致银镜的形成不如预期的美丽。
2。
问题解决假设(想法)鉴于上述问题,我们的实验小组设计了以下解决方案:提供试管预处理实验步骤?通过改变氨水的浓度,学生在滴过多氨的情况下配制的银铵溶液中氨的浓度不会太高。
?通过改变葡萄糖溶液的温度和浓度来提高反应速率,从而缩短银镜反应时间这将使学生在短时间内观察到明显的现象,从而消除学生的不耐烦。
因此,鉴于以上解决方案,为了探索本实验成功率高的最佳实验条件,我们实验组采用正交法进行实验探索和研究。
银镜反应易受多种条件影响,其中反应温度、硝酸银溶液和氨水的浓度、醛的浓度、溶液的酸碱度、试管壁的亮度等因素都会影响实验。

影响乙醛银镜反应的实验因素的探究作者:邓英环来源:《读与写·下旬刊》2014年第09期摘要:从试管的洁净度、氨水浓度、硝酸浓度、乙醛品质、水浴温度等方面进行深入探究,找出影响乙醛银镜反应实验成败的关键因素,得出使乙醛银镜反应实验成功的最佳条件。
关键词:乙醛;银镜反应;实验探讨;最佳条件中图分类号:G633.8文献标识码:B文章编号:1672-1578(2014)18-0212-02银镜反应是中学有机化学的一个重要反应。
按照中学课本中关于乙醛银镜反应实验的步骤进行实验,有时成功率不高。
那么,如何才能提高该实验的成功率?本人做了以下几方面的探究:1.试管的要求银镜反应实验的最终目的是让反应生成的银均匀地附在试管内壁,这就要求试管内壁必须是洁净光滑的。
依据这一点,我们对试管的选择遵循以下两点:1.1新试管可直接用于实验。
1.2旧试管,内壁附有一些杂质,试管内壁变得粗糙。
清洗如下:NaOH溶液洗,HNO3溶液洗,自来水冲洗,最后蒸馏水冲洗,直至管壁干净。
2.氨水浓度对银镜反应的影响各取2mL 2%的AgNO3溶液于6支新试管中,分别逐滴滴入浓度不同的氨水,至最初产生的沉淀恰好溶解为止。
再分别滴入6滴最新生产的原装瓶的乙醛(浓度40%),振荡后把试管放在80℃的水浴中加热,观察实验现象,记录如表1:表1:氨水浓度对银镜反应的影响氨水浓度%银镜开始出现时间(s)银镜形成时间(s)银镜效果6%6283少许银斑4%96125发亮、较黑的银镜3%117152发亮、偏黑的银镜2%132183灰亮偏黑的银镜,银镜偏薄1%179240偏黄、少量银膜从表1的数据分析可知,氨水浓度过大时,加入氨水的量比较难控制,容易导致过量,使实验失败。
经查阅资料可知,银氨溶液中真正起氧化作用的是[ Ag(NH3)2]+。
[Ag(NH3)2]+在溶液中可发生部分电离,产生Ag+和NH3。
相关的电离方程式如下:[ Ag(NH3)2]+Ag+ +2NH3正常情况下,当发生银镜反应时,Ag+被消耗,上述平衡正向移动,反应得以继续进行下去。

用正交法探究银镜反应的条件银镜反应实验是中学化学一个重要实验。
影响实验效果的因素很多,我用正交法的原理,用正交表做了个试验,探究了影响实验效果的3个因素。
通过实验观察分析和结果确定了各因素对实验效果的影响程度和最佳条件组合。
进而找到了实验现象不明的症结所在。
具体过程如下。
一。
设计正交表:通过对以往实验现象明显与否的总结,以及文献查找,安排了个探究因素,分别是:NaOH溶液的浓度、AgNO3溶液的浓度以及乙醛溶液加入进银氨溶液的方式。
每个因素又分别设定2个水平,具体设计如下表根据水平数以及因素个数,选择L4(23)做4次实验。
二。
实验用品1。
试剂:乙醛(40%),40%的NaOH溶液,20%的NaOH溶液,2%氨水溶液,4%的AgNO3溶液,2%AgNO3溶液2。
仪器:6支洁净的干燥试管,量筒,胶头滴管烧杯,酒精灯,石棉网,温度计三。
实验步骤:1 2 3 评分列号试验号1 20%的NaOH溶液倾倒2%AgNO3溶液702 20%的NaOH溶液滴管滴加4%的AgNO3溶50液903 40%的NaOH溶液倾倒4%的AgNO3溶液4 40%的NaOH溶液滴管滴加2%AgNO3溶液651。
取一支试管A,加入2mL 2% AgNO3溶液,再加1滴20%的NaOH溶液。
边振荡边加2%氨水溶液,直至沉淀恰好溶解;2。
另取试管B,加入0.5mL40%的乙醛溶液,再加5滴2% AgNO3溶液,振荡混匀;3。
将试管B中的溶液沿试管A的试管壁倾倒,使得两种溶液混合于A试管中,并水浴加热。
水温保持在40~50°Ⅽ之间。
4。
按照上述正交表,类比1~3的操作步骤进行实验,并对实验现象进行记录。
针对银镜呈现效果的情况来评分,满分为100分。
【注】:银镜质量:银镜质量的评分是最重要的,因为它占的权重最大。
笔者根据银镜层是否光亮、均匀、致密,是否发黑进行评分,实验3的银镜层质量最好,所以评90分。
其余按银镜层质量好坏分数依次减小,大部分面积不够均匀、不够致密,溶液上层稍有沉淀物。

实验名称:银镜反应实验日期:2023年X月X日实验地点:化学实验室实验目的:1. 理解银镜反应的原理及其在有机化学中的应用。
2. 掌握银镜反应的基本操作步骤。
3. 通过实验观察银镜反应的现象,验证醛类化合物的还原性。
实验原理:银镜反应是利用醛类化合物与银氨溶液([Ag(NH3)2]OH)在碱性条件下反应,将银离子还原为银单质,沉积在试管壁上形成光亮的银镜。
反应的化学方程式如下:\[ R-CHO + 2[Ag(NH3)2]^+ + 3OH^- \rightarrow R-COO^- + 2Ag↓ + 4NH3 + 2H2O \]实验用品:- 试管- 烧杯- 酒精灯- 玻璃棒- 硝酸银溶液(AgNO3)- 氨水(NH3·H2O)- 乙醛(CH3CHO)- 1mol/L氢氧化钠溶液(NaOH)- 蒸馏水- 酒精实验步骤:1. 在试管中加入1ml 2%硝酸银溶液。
2. 加入2ml 1mol/L氢氧化钠溶液,充分振荡,直至沉淀完全溶解。
3. 加入几滴氨水,振荡至溶液澄清。
4. 加入2-3滴乙醛溶液,轻轻振荡。
5. 将试管放入50-60℃的水浴中加热5-10分钟。
6. 观察并记录实验现象。
实验现象:加热后,试管壁上出现光亮的银镜。
实验结果分析:银镜反应的出现证明了乙醛具有还原性,可以将银离子还原为银单质。
实验中加热的目的是为了加快反应速率,而温度的控制是为了保证反应的顺利进行。
注意事项:1. 实验过程中要严格控制氨水的加入量,过量会导致银镜反应不彻底。
2. 加热时要注意安全,避免烫伤。
3. 实验结束后,要及时清洗实验器材。
实验总结:银镜反应是一种重要的有机化学反应,通过本实验,我们了解了银镜反应的原理和操作步骤,并掌握了观察实验现象的方法。
实验结果表明,乙醛具有还原性,可以将银离子还原为银单质。
通过本次实验,我们提高了实验操作能力和分析问题的能力。
实验报告:一、实验目的1. 理解银镜反应的原理及其在有机化学中的应用。

影响银镜反应的实验因素探讨韦春莉所谓银镜反应,是指醛与弱氧化剂发生氧化还原反应,醛被氧化成相同碳原子个数羧酸,而试剂中的银离子被还原成单质银,均匀地涂在试管壁上,形成一层明亮的银镜,故称银镜反应。
除醛类化合物可发生银镜反应外,其它结构中含有醛基的化合物也可发生此反应如葡萄糖、甲酸等均能发生银镜反应。
许多同学在做本实验时得不到理想结果,有的无任何现象,有的试管壁上银镜涂的不均匀,也有的只生成一些灰黑色沉淀,究竟哪些因素影响银镜的生成呢?可通过下面实验来说明。
第一组实验:取一支大试管,配制4m1银氨溶液,将其分装在两支试管中(一支很洁净A;另一支不太干净B).然后分别向A,B两试管中加入l ml 10%的葡萄糖溶液,同时置于70℃热水浴中,过一段时间后发现:A试管银镜比B试管中明亮很多。
因此可以得出结论:试管的洁净度直接影响银镜的质量。
但试管的洁净度是否是银镜反应成败的关键呢?第二组实验:取甲、乙两个试管,在甲试管(洁净)中加入2毫升5%的银氨溶液和1毫升10%的葡萄糖溶液,然后水浴加热;在乙试管(不洁净)中加入2毫升5%银氨溶液和2毫升10%的葡萄糖溶液,然后水浴加热。
几分钟后发现,乙试管中产生银镜比甲试管还要好。
由此可得出结论:试管的洁净度虽是影响银镜反应的条件,但并不是成败的关键。
那么影响银镜反应成败的关键因素是什么呢?第三组实验:用5%、10%、15%、20%的葡萄糖溶液做对比实验。
取干净试管四支,编号1、2、3、4,各加入2ml 2%的硝酸银溶液,再滴加2滴10%的氢氧化钠,再滴加2%的氨水(边加边振荡)至白色沉淀物恰好溶解,然后依次加入5%、10%、15%、20%的葡萄糖溶液1ml,快速振荡后置于70℃的水浴中。
1min后四支试管都有银镜生成,试管2的银镜质量最好,试管1、3次之,试管4的银镜质量最差。
实验结果说明,葡萄糖溶液浓度越大,反应速度越快,但是,反应速度太快,部分银粒不能及时附着到试管壁上,而沉淀在溶液中,形成的银镜层较薄。

第1篇一、实验目的1. 掌握乙醛银镜反应的基本原理和方法。
2. 熟悉银镜反应现象及实验条件对反应结果的影响。
3. 提高化学实验操作技能,培养严谨的科学态度。
二、实验原理乙醛银镜反应是一种检测醛类化合物的重要化学实验。
在碱性条件下,醛类化合物与银氨溶液反应,醛基被氧化成羧基,同时银离子被还原成金属银,形成光亮的银镜。
反应方程式如下:CH3CHO + 2[Ag(NH3)2]+ + 3OH- → CH3COO- + 2Ag↓ + 4NH3 + 2H2O三、实验材料1. 试剂:2%硝酸银溶液、2%氨水、5%氢氧化钠溶液、40%乙醛溶液、40%乙酸溶液。
2. 仪器:试管、滴管、酒精灯、水浴锅。
四、实验步骤1. 取一支洁净的试管,加入约1mL 2%硝酸银溶液。
2. 逐滴加入2%氨水,边滴边振荡,直至产生的沉淀刚好溶解为止,得到银氨溶液。
3. 另取一支洁净的试管,加入约1mL 40%乙醛溶液。
4. 将银氨溶液缓慢滴入乙醛溶液中,边滴边振荡。
5. 将混合溶液置于热水浴中加热,观察银镜反应现象。
6. 待银镜反应结束后,取出试管,观察银镜的光亮程度。
7. 重复步骤3-6,分别使用40%乙酸溶液进行实验,比较乙醛和乙酸的银镜反应现象。
五、实验结果与分析1. 乙醛银镜反应现象:在热水浴中加热后,试管内壁出现光亮的银镜。
2. 乙酸银镜反应现象:在热水浴中加热后,试管内壁无银镜出现。
分析:乙醛银镜反应中,乙醛具有还原性,可以将银氨溶液中的银离子还原成金属银,形成光亮的银镜。
而乙酸不具有还原性,无法与银氨溶液发生银镜反应。
六、实验结论1. 乙醛银镜反应是一种检测醛类化合物的重要化学实验,可用于检验醛类物质的存在。
2. 银镜反应现象与实验条件密切相关,如温度、pH值、反应物浓度等。
3. 通过本实验,提高了化学实验操作技能,培养了严谨的科学态度。
七、实验注意事项1. 实验过程中,注意试管洁净,以免影响实验结果。
2. 加入氨水时,应边滴边振荡,避免产生过多沉淀。

银镜反应条件银镜反应是一种常用的有机化学实验方法,用于检测还原糖和其他活性羟基化合物。
该反应基于还原糖在碱性条件下与银离子发生还原反应,生成银沉淀的原理。
在本文中,我们将深入探讨银镜反应的条件及其影响因素。
1. 实验原理银镜反应的基本原理是还原糖在碱性条件下将银离子还原为银沉淀,反应的化学方程式如下所示:还原糖 + Ag+ + OH- → 银沉淀 + 管式物质其中,还原糖是反应的底物,银离子与氢氧根离子提供反应所需的中间体和催化剂。
银沉淀的生成是反应的关键步骤,通常形成银镜沉淀,从而使试管内壁镀上一层银镜。
2. 反应条件2.1 碱性条件银镜反应的进行需要在碱性条件下进行。
通常使用氢氧化钠(NaOH)作为碱性试剂,使溶液呈现碱性pH值。
碱性条件有利于还原糖与银离子的反应进行,促进银沉淀的生成。
2.2 离子态银溶液银镜反应所需的银源通常是AgNO3等银盐,将其溶解在水中得到银离子溶液。
银离子的存在是银镜反应能够顺利进行的基础,它与还原糖在碱性条件下反应生成银沉淀。
2.3 适当温度适宜的温度有利于反应的进行,但过高的温度可能导致银沉淀脱落或溶解,影响实验结果。
一般在室温或略高的温度下进行银镜反应可以得到较好的反应效果。
3. 影响因素银镜反应的效果受到多种因素的影响,主要包括以下几个方面:3.1 pH值碱性条件下的pH值对反应的进行影响较大。
过高或过低的pH值都会影响反应的速率和产物的稳定性,影响银镜沉淀的生成。
3.2 浓度还原糖、银离子和碱性溶液的浓度均会对反应结果产生影响。
适当的浓度有利于生成理想的银镜沉淀,但过高或过低的浓度都可能引起反应不完全或副反应的发生。
3.3 反应时间反应时间对银镜反应的结果有很大影响。
反应时间过短可能导致还原糖无法充分反应,过长则有可能导致银沉淀的析出过多或溶解。
4. 实验操作银镜反应的具体实验操作包括以下步骤:1.配制适量的银离子溶液和氢氧化钠溶液;2.将待检测的还原糖添加到试管中;3.将银盐溶液滴加到反应体系中,反应溶液呈现混浊状态;4.放置一段时间,观察试管内壁是否形成银镜;5.根据实验现象判断还原糖的存在与否。

银镜反应反应原理(一)银镜反应反应原理解析什么是银镜反应?银镜反应是一种常见的化学反应,通常用于实验室或教学中展示。
这个反应以反应液的混合形成一层银色镜面为特征,因此得名为银镜反应。
反应原理银镜反应的主要原理是还原剂还原醛类化合物至醇,同时在氧化剂的氧化作用下,银离子被还原成银颗粒。
整个反应过程分为以下几个步骤:1.选择合适的醛类化合物作为反应物,常见的选择是葡萄糖或蔗糖。
这些化合物具有羟基和醛基的结构。
2.制备反应液,将含有氧化剂(如硝酸银、碳酸氢钠等)的溶液与还原剂(如氢氧化钠溶液)混合。
这样的反应液中,氧化剂提供氧化作用所需的氧气,还原剂提供电子供给还原过程。
3.反应开始,醛类化合物被氧化剂氧化为羧酸或酮,同时氧化剂被还原为银离子。
在整个过程中,还原剂将被氧化剂氧化的电子提供给氧化剂。
4.银离子进一步被还原成银颗粒,并在溶液中聚集形成银镜。
这些银颗粒具有反射光线的能力,因此反应容器形成一层银色镜面。
反应机理银镜反应的具体反应机理包括以下几个关键步骤:1.氧化剂(如硝酸银)与醛类化合物发生反应,醛基(CHO)被氧化成羧酸根离子(COO),同时氧化剂还原为银离子(Ag+)。
2.还原剂(如氢氧化钠)与氧化剂发生反应,还原剂的氢氧化物离子(OH-)给出电子,氧化剂的银离子(Ag+)接受电子并还原成银颗粒。
3.形成的银颗粒在溶液中迅速聚集,最终形成一层银镜。
实际应用银镜反应不仅仅是一种用于实验展示的化学反应,还具有实际应用价值。
例如,在镀银过程中,银镜反应被用于沉积银层在物体表面,以增加其装饰性和防腐性。
此外,银镜反应还在一些有机合成反应中起着重要的催化作用。
小结通过对银镜反应的原理解析,我们了解到这个常见的化学反应过程。
银镜反应以还原和氧化反应为基础,最终在溶液中形成一层银色镜面。
这个反应不仅仅是实验室中的一种展示,还具有实际应用价值。
银镜反应的机理是复杂而精妙的,并在镀银和有机合成等领域发挥重要作用。

银镜反应知识点总结一、反应原理银镜反应的原理是通过将银离子还原为银原子而生成银沉淀。
通常来说,银镜反应的化学方程式可以表示为:2Ag⁺+HCHO+2OH⁻→2Ag+CH₂O+2H₂O在该反应中,银离子被还原为银原子,而甲醛则充当了还原剂的角色。
在碱性条件下,还原剂能够夺取银离子的电子,从而使银离子还原为银原子并生成银沉淀。
由于银原子有较强的还原性,因此能与其他物质反应生成银镜。
二、影响因素银镜反应的结果受到多种因素的影响,主要包括以下几个方面:1. 离子浓度:银镜反应的结果与银离子和还原剂的浓度有着密切的关系。
通常来说,银离子的浓度越高,生成的银沉淀也会越多。
而还原剂的浓度则决定了反应的速率和终点。
2. pH值:银镜反应是在碱性条件下进行的,因此溶液的pH值会对反应结果产生一定的影响。
一般来说,碱性条件有利于银离子的还原,并且生成的银沉淀比较稳定。
3. 温度:温度对于银镜反应的影响相对较小,但在一定范围内,温度的升高会促进反应的进行,加快反应速率。
4. 其他杂质离子:除了银离子和还原剂外,溶液中的其他杂质离子也会对反应结果产生一定的影响。
某些离子的存在会影响银镜的形成和稳定性。
三、应用领域银镜反应由于其简便易行的特点,被广泛应用于实验室教学和工业生产中,包括以下几个方面:1. 实验教学:银镜反应是化学课程中常见的实验之一,通过观察反应结果,可以让学生了解还原反应的基本原理和特点。
2. 工业生产:银镜反应在工业生产中也有着重要的应用,例如用于银镜的制备、光学镜片的生产等方面。
3. 环境监测:银镜反应也可以用于环境监测中,例如用于检测水中甲醛的含量等。
四、实验操作进行银镜反应的实验操作一般包括以下几个步骤:1. 准备溶液:首先需要配制含有银离子和还原剂的溶液。
一般来说,可以用硝酸银溶液和氢氧化钠溶液作为原料。
其中硝酸银溶液是银离子的来源,而氢氧化钠溶液则用于提供碱性条件和还原剂。
2. 反应操作:将两种溶液混合在一起,并在碱性条件下进行搅拌。


银镜反应最佳条件的探索作者:刘淑芳来源:《新校园·理论版》2011年第01期银镜反应主要用于鉴定醛,特别是用以区别醛和酮;当醛比酸容易获得时,这个反应也有合成上的价值,所以银镜反应是醛酮性质实验中的一个典型实验。
然而,学生在操作过程中,由于种种原因,经常出现一些问题,如所形成的银镜不均匀,发乌,发黑,有时甚至看不到银镜。
实验中有诸多因素对反应有影响,如托伦试剂的配制,反应时水浴的温度,醛的用量,容器的光洁度等。
掌握这些因素对反应的影响,找到一个最佳反应条件,就会得到理想的实验效果。
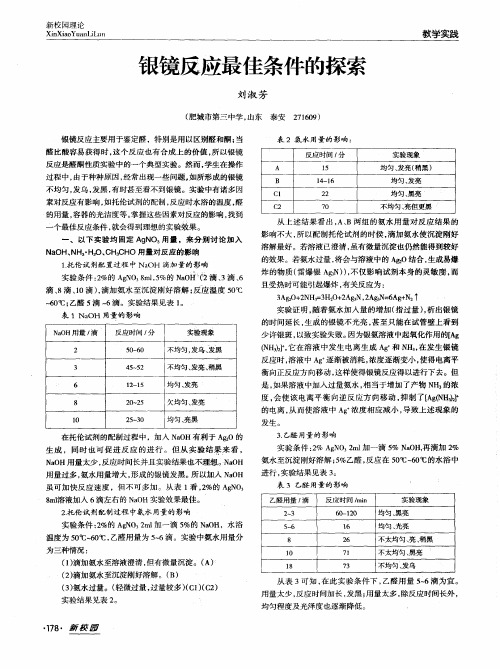
一、以下实验均固定AgNO3用量,来分别讨论加入 NaOH、NH3·H2O、CH3CHO用量对反应的影响1.托伦试剂配置过程中NaOH滴加量的影响实验条件:2%的AgNO3 8ml,5%的NaOH(2滴、3滴、6滴、8滴、10滴),滴加氨水至沉淀刚好溶解;反应温度50℃~60℃;乙醛5滴~6滴。
实验结果见表1。
表1 NaOH用量的影响■在托伦试剂的配制过程中,加入NaOH有利于Ag2O的生成,同时也可促进反应的进行。
但从实验结果来看, NaOH用量太少,反应时间长并且实验结果也不理想。
NaOH用量过多,氨水用量增大,形成的银镜发黑。
所以加入NaOH虽可加快反应速度,但不可多加。
从表1看,2%的AgNO3 8ml溶液加入6滴左右的NaOH实验效果最佳。
2.托伦试剂配制过程中氨水用量的影响实验条件:2%的AgNO3 2ml加一滴5%的NaOH,水浴温度为50℃~60℃,乙醛用量为5~6滴。
实验中氨水用量分为三种情况:(1)滴加氨水至溶液澄清,但有微量沉淀。
(A)(2)滴加氨水至沉淀刚好溶解。
(B)(3)氨水过量。
(轻微过量,过量较多)(C1)(C2)实验结果见表2。
表2 氨水用量的影响:■从上述结果看出,A、B两组的氨水用量对反应结果的影响不大,所以配制托伦试剂的时侯,滴加氨水使沉淀刚好溶解最好。
若溶液已澄清,虽有微量沉淀也仍然能得到较好的效果。

银镜反应实验中若干问题的讨论银镜反应实验是中学化学有机反应的重要实验,是用来检验含醛基物质的特性反应。
中学化学中能发生银镜反应的物质有醛类、甲酸、甲酸酯、葡萄糖、麦芽糖等。
下面就实验过程中涉及到的有关问题加以讨论。
1.银镜反应需要的仪器和药品仪器:洁净的试管、胶头滴管、烧杯。
药品:2%硝酸银溶液、5%NaOH溶液、2%氨水、热水、2%~4%乙醛溶液。
2.反应物用量和实验具体操作过程(1)银氨溶液的配制:先加入2mL2%硝酸银溶液,再逐渐滴入2%氨水,边滴加边震荡,直到生成的沉淀刚刚消失为止,得到无色银氨溶液,再加入1滴5%NaOH溶液。
(2)银镜的生成:将配置好的银氨溶液放在试管内,滴入5滴乙醛溶液,轻微震荡后放入盛有热水的烧杯里,此时不要再摇动试管,静置后银镜产生。
反应方程式:CH3CHO+2Ag(NH3)2OH→CH3COONH4+2Ag↓+3NH3+H2O3.实验注意事项(1)银氨溶液配制时氨水用量:滴加氨水使沉淀刚好溶解即可,应防止加入过量氨水。
一方面银氨溶液中如果有过量的NH3,银离子会被过度地络合,降低银氨溶液的氧化能力;另一方面氨水过量会使试剂不太灵敏,且有利于氨化银的生成,不利于〔Ag(NH3)2〕+的解离,不利于形成银镜,此时若加入醛,还易生成易爆的雷酸银(AgOCN)。
(2)银氨溶液要随配随用,不可久置不能贮存。
若长久放置,会析出黑色的易爆炸的物质一氮化三银沉淀(Ag3N)、AgN3(叠氮化银)、AgOCN(雷酸银)。
这些物质哪怕是用玻璃棒刮擦也会引起其分解而爆炸。
在干燥时受振动也会发生猛烈爆炸。
(3)反应条件:水浴加热且温度控制在60℃左右。
若水浴温度超过70℃或直接加热,因乙醛沸点低(20.8℃),乙醛会大量挥发而使反应效果变差,或难以得到光亮的银镜,只能得到黑色细粒银的沉淀且还会生成雷酸银(AgOCN),有可能发生爆炸。
(4)加入少量5%NaOH溶液的作用:2mL2%硝酸银溶液中加入1滴5%NaOH溶液,实验效果最佳。

一、实验目的1. 理解银镜反应的基本原理和过程。
2. 掌握银镜反应的实验操作方法。
3. 通过实验,观察并分析醛类化合物与银氨溶液反应生成的银镜现象。
4. 探究不同条件对银镜反应的影响。
二、实验原理银镜反应是一种利用醛类化合物还原银氨溶液中的银离子,使其在试管壁上沉积形成银镜的化学反应。
其基本原理如下:\[ R-CHO + 2[Ag(NH_3)_2]^+ + 3OH^- \rightarrow R-COO^- + 2Ag + 4NH_3 + 2H_2O \]其中,R-CHO代表醛类化合物,[Ag(NH_3)_2]^+代表银氨溶液中的银离子,R-COO^-代表醛类化合物被氧化后的羧酸根离子。
三、实验材料与仪器1. 实验材料:- 乙醛- 硝酸银溶液- 氨水- 稀氢氧化钠溶液- 蒸馏水- 试管- 热水浴2. 实验仪器:- 电子天平- 移液管- 滴定管- 烧杯- 酒精灯- 玻璃棒四、实验步骤1. 配制银氨溶液:向试管中加入1ml硝酸银溶液,滴加2-3滴稀氨水,振荡均匀,直至沉淀恰好完全溶解,形成无色透明溶液。
2. 配制醛溶液:向试管中加入2ml乙醛,加入少量蒸馏水稀释。
3. 将银氨溶液和醛溶液混合:将配制好的银氨溶液缓慢滴加到醛溶液中,边滴加边振荡,直至混合均匀。
4. 加热反应:将混合溶液置于热水浴中加热,保持50-60℃左右,持续反应30分钟。
5. 观察现象:反应结束后,取出试管,观察试管壁上是否出现银镜。
五、实验结果与分析1. 实验结果:在热水浴加热条件下,乙醛与银氨溶液发生反应,在试管壁上形成光亮的银镜。
2. 分析:- 银镜反应的发生需要满足以下条件:- 醛类化合物:实验中选用乙醛作为醛类化合物,其分子中含有醛基,可以与银氨溶液发生还原反应。
- 银氨溶液:银氨溶液中的银离子具有氧化性,可以将醛类化合物氧化为羧酸根离子,同时自身被还原为银。
- 碱性条件:银镜反应需要在碱性条件下进行,氢氧化钠溶液提供碱性环境。

银镜反应实验中若干问题的讨论银镜反应实验是中学化学有机反应的重要实验,是用来检验含醛基物质的特性反应。
中学化学中能发生银镜反应的物质有醛类、甲酸、甲酸酯、葡萄糖、麦芽糖等。
下面就实验过程中涉及到的有关问题加以讨论。
1.银镜反应需要的仪器和药品仪器:洁净的试管、胶头滴管、烧杯。
药品:2%硝酸银溶液、5%NaOH溶液、2%氨水、热水、2%~4%乙醛溶液。
2.反应物用量和实验具体操作过程(1)银氨溶液的配制:先加入2mL2%硝酸银溶液,再逐渐滴入2%氨水,边滴加边震荡,直到生成的沉淀刚刚消失为止,得到无色银氨溶液,再加入1滴5%NaOH溶液。
(2)银镜的生成:将配置好的银氨溶液放在试管内,滴入5滴乙醛溶液,轻微震荡后放入盛有热水的烧杯里,此时不要再摇动试管,静置后银镜产生。
反应方程式:CH3CHO+2Ag(NH3)2OH→CH3COONH4+2Ag↓+3NH3+H2O3.实验注意事项(1)银氨溶液配制时氨水用量:滴加氨水使沉淀刚好溶解即可,应防止加入过量氨水。
一方面银氨溶液中如果有过量的NH3,银离子会被过度地络合,降低银氨溶液的氧化能力;另一方面氨水过量会使试剂不太灵敏,且有利于氨化银的生成,不利于〔Ag(NH3)2〕+的解离,不利于形成银镜,此时若加入醛,还易生成易爆的雷酸银(AgOCN)。
(2)银氨溶液要随配随用,不可久置不能贮存。
若长久放置,会析出黑色的易爆炸的物质一氮化三银沉淀(Ag3N)、AgN3(叠氮化银)、AgOCN(雷酸银)。
这些物质哪怕是用玻璃棒刮擦也会引起其分解而爆炸。
在干燥时受振动也会发生猛烈爆炸。
(3)反应条件:水浴加热且温度控制在60℃左右。
若水浴温度超过70℃或直接加热,因乙醛沸点低(20.8℃),乙醛会大量挥发而使反应效果变差,或难以得到光亮的银镜,只能得到黑色细粒银的沉淀且还会生成雷酸银(AgOCN),有可能发生爆炸。
(4)加入少量5%NaOH溶液的作用:2mL2%硝酸银溶液中加入1滴5%NaOH溶液,实验效果最佳。
影响银镜反应的实验因素探讨
10111550109 韦春莉
所谓银镜反应,是指醛与弱氧化剂发生氧化还原反应,醛被氧化成相同碳原子个数羧酸,而试剂中的银离子被还原成单质银,均匀地涂在试管壁上,形成一层明亮的银镜,故称银镜反应。
除醛类化合物可发生银镜反应外,其它结构中含有醛基的化合物也可发生此反应如葡萄糖、甲酸等均能发生银镜反应。
许多同学在做本实验时得不到理想结果,有的无任何现象,有的试管壁上银镜涂的不均匀,也有的只生成一些灰黑色沉淀,究竟哪些因素影响银镜的生成呢?可通过下面实验来说明。
第一组实验:取一支大试管,配制4m1银氨溶液,将其分装在两支试管中(一支很洁净A;另一支不太干净B).然后分别向A,B两试管中加入l ml 10%的葡萄糖溶液,同时置于70℃热水浴中,过一段时间后发现:A试管银镜比B试管中明亮很多。
因此可以得出结论:试管的洁净度直接影响银镜的质量。
但试管的洁净度是否是银镜反应成败的关键呢?
第二组实验:取甲、乙两个试管,在甲试管(洁净)中加入2毫升5%的银氨溶液和1毫升10%的葡萄糖溶液,然后水浴加热;在乙试管(不洁净)中加入2毫升5%银氨溶液和2毫升10%的葡萄糖溶液,然后水浴加热。
几分钟后发现,乙试管中产生银镜比甲试管还要好。
由此可得出结论:试管的洁净度虽是影响银镜反应的条件,但并不是成败的关键。
那么影响银镜反应成败的关键因素是什么呢?
第三组实验:用5%、10%、15%、20%的葡萄糖溶液做对比实验。
取干净试管四支,编号1、2、3、4,各加入2ml 2%的硝酸银溶液,再滴加2滴10%的氢氧化钠,再滴加2%的氨水(边加边振荡)至白色沉淀物恰好溶解,然后依次加入5%、10%、15%、20%的葡萄糖溶液1ml,快速振荡后置于70℃的水浴中。
1min后四支试管都有银镜生成,试管2的银镜质量最好,试管1、3次之,试管4的银镜质量最差。
实验结果说明,葡萄糖溶液浓度越大,反应速度越快,但是,反应速度太快,部分银粒不能及时附着到试管壁上,而沉淀在溶液中,形成的银镜层较薄。
因此,用10%的葡萄糖溶液作银镜反应的还原剂最合适。
第四组实验:控制其他条件一样,用2ml 10%的葡萄糖溶液,1滴37~40%的甲醛溶液和4滴5~10%的乙醛溶液做还原剂分别加到三支试管中。
其中甲醛溶液不需加热。
三支试管都出现了光亮的银镜,甲醛溶液的试管最先出现银镜,接着是乙醛,最后是葡萄糖。
由于甲醛有毒,有条件可以考虑尝试甲酸;上述对比实验用的乙醛溶液是用新启封的乙醛试剂配制的。
乙醛久置后易发生聚合反应,在室温和有少量硫酸存在时,能生成三聚乙醛,三聚乙醛是微溶于水的液体,不能发生乙醛的特性反应。
和甲醛一样,实验室贮存的乙醛试剂通常是部分变质的,试剂瓶内的液体分上下二层,上层是三聚乙醛,下层是变稀的乙醛溶液,呈酸性(PH值为4);乙醛试剂配制的乙醛溶液,滴加到银氨溶液后,降低了反应液的碱性,醛浓度越高则滴加后反应液的碱性越低,反应速度越慢。
可用NaOH溶液把乙醛溶液调到PH在8~10之间,使得反应液呈微碱性。
因此综合考虑,用葡萄糖作银镜反应的还原剂最好。
而且由于葡萄糖在水溶液中存在下列平衡:
β- 葡萄糖(64%) −→←开链葡萄糖(0.01 %) −→← α一葡萄糖(36%)
由此可知:在葡萄糖的水溶液中醛式葡萄糖浓度很低,但由于银镜反应是不可逆的,随着反应的进行,可使平衡持续不断的向葡萄糖方向移动,保证了银镜反应的不断进行。
正由于葡萄糖溶液中醛基浓度很低,才能有效地控制了银镜反应的速度,使反应缓慢均匀地进行,致使还原出的银可均匀地有秩序地排列起来,形成明亮的银镜。
如果醛基浓度过大,被还原出的银在试管壁上不是缓慢、均匀有秩序地析出,而是快速析出,得到的就不是明亮的银镜,而是粗糙黑色的沉淀。
第五组实验:做一组对比实验,一组在配制银氨溶液时加1滴氢氧化钠溶液;另一组则不加氢氧化钠溶液,直接加氨水至溶液澄清,再反滴1滴硝酸银,防止银离子被过度络合而降低氧化能力。
70℃时,葡萄糖在不同pH 值时银镜反应情况见下表。
从表中可以看出,在配制银氨溶液时,不加氢氧化钠,反应液pH 值降低,不同浓度的葡萄糖产生银镜更快且银镜更加光亮。
银镜反应必须在微碱性溶液中进行,适当提高溶液的碱性,可提高 [Ag (NH 3)2]OH 的浓度,同时碱性的提高可能加速醛的氧化,因此,当溶液的PH 值增加,反应速度加快。
通常,当溶液PH<8时,不能形成银镜;溶液PH 为8~9 时,反应速度较慢;溶液PH 为9~10时,反应速度较快,能形成光亮的银镜。
但是溶液不能呈强碱性,因在强碱性条件下,银氨溶液本身也能形成银镜,无须含醛基化合物。
综上所述,影响银镜反应的因素有多种,但生成银镜的优劣、实验成败的关键是醛类化合物的浓度,控制好一定的浓度后还须注意以下几个方面的问题:第一、银氨溶液在配制时,氨水要适量,按书中耍求;第二、试管一定要十分洁净;第三、要水浴加热,不能在酒精灯上直接加热。
银镜反应的适宜操作如下:
还原剂实验操作甲醛溶液乙醛溶液葡萄糖溶液
2% AgNO3溶液2ml2ml2ml
1% NaOH溶液一滴
2%的氨水溶液滴至白色沉淀物恰好溶解滴至白色沉淀物恰好溶解滴至白色沉淀物恰好溶解一滴
37~40%的甲醛溶
液
5%~10%乙醛溶液4滴
10%葡萄糖溶液1ml
反应温度常温70℃70℃
反应时间~2min3min3~4min。