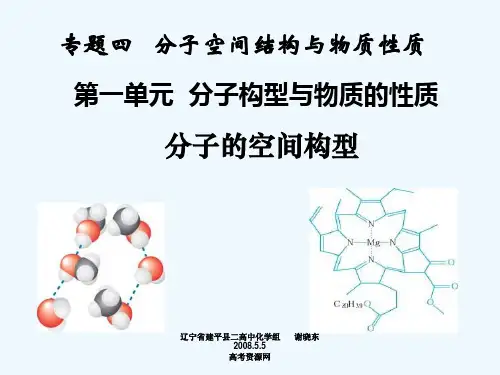
杂化轨道间 夹角
1800
1200
1090 28’
空间构型
直 线型
平面正三角形
正四面体型
共价键类型 3个σ键
5个σ键
与数量 2个p-p键 1个p-p键
可编辑课件PPT
4个σ键
14
含碳原子轨道杂化方式的判断
首先看中心原子有没有形成双键或叁键,如 果有1个叁键,则其中有2个π键,用去了2个 p轨道,形成的是sp杂化;如果有1个双键则 其中有1个π键,形成的是sp2杂化;如果全 部是单键,则形成的是sp3杂化.
问2:各个键的形成过程
3个H原子分别以3个s轨道与N原子上的3个含有 单电子的sp3杂化轨道相互重叠后,就形成了3个性 质、能量和键角都完全相同的s-sp3的σ键,同时剩 余一个sp3轨道,其中含有一对孤对电子,形成一个 三角பைடு நூலகம்型的分子。
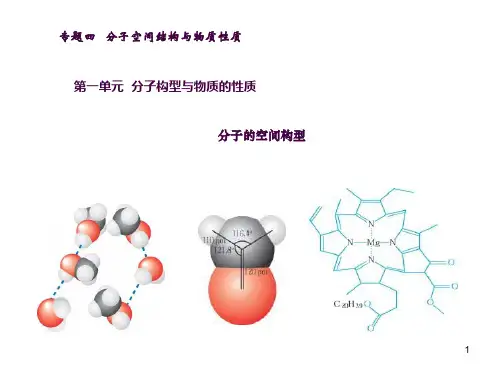
问3:键角为107.30而非109.50的原因。
氨分子中存在着未成键的孤对
类型。
可编辑课件PPT
4
问1、观察示意图,描述碳原子的杂化过程 SP2杂化过程
SP1杂化过程
可编辑课件PPT
5
问2:乙烯分子中碳原子的sp2杂化,描述各个轨道空间位置关系.
乙烯中的C在轨道杂化时,有一个P轨道未参与杂
化,只是C的2s与两个2p轨道发生杂化,形成三个
相同的sp2杂化轨道,三个sp2杂化轨道分别指向平面
19
水分子空间构型
通过氨分子的空间构型分析水分子的空间构型: 1、氧原子的杂化过程及各个杂化轨道中电子的 数目。 2、各个键的形成过程。 3、键角为104.50而非109.50的原因。
可编辑课件PPT
20
杂化轨道还可分为:等性杂化 和不等性杂化两种