分子的空间构型与分子结构
- 格式:ppt
- 大小:435.56 KB
- 文档页数:17


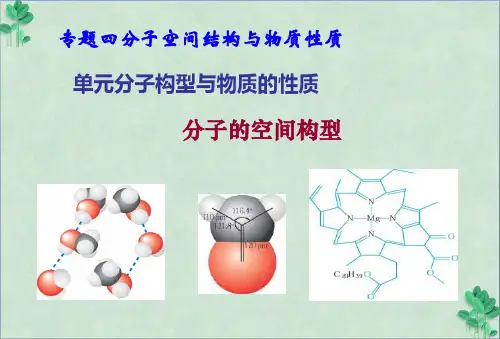

分子结构的空间构型和性质分子结构的空间构型是指分子中各个原子之间的排列方式和相对位置。
这种空间构型决定了分子的性质。
对于有机化合物和生物分子等大分子化合物,它们的空间构型尤为重要。
例如,蛋白质的结构决定了它的功能,而类固醇分子的空间构型也极大地影响了它的生物活性。
因此,对于化学家来说,深入了解分子结构的空间构型和性质是非常必要的。
分子的空间构型通常可以用分子模型来表示,分子模型可以是立体模型、分子球棍模型或者电子云模型。
其中,立体模型最能反映分子的三维结构,即原子之间的空间关系,而分子球棍模型主要用于直观地表示分子中各个原子的种类、数量和化学键。
电子云模型则通常用于描述分子中电子云的密度分布和化学键的性质。
当我们了解了分子的空间构型后,就可以进一步探讨分子的性质。
分子的性质包括化学性质和物理性质。
化学性质指的是分子在不同环境下的化学反应,而物理性质则包括分子的热力学性质和物理学性质等。
分子的空间构型决定了化学反应的发生方式和速度。
例如,不对称的分子更容易参与立体选择性反应,因为反应的发生取决于反应物之间的空间安排。
另外,分子的空间构型也会影响分子的手性。
手性指的是分子的镜面对称性,对称的手性分子和非对称的手性分子可能会具有完全不同的性质。
例如,抗生素“红霉素”和“克拉霉素”的化学结构几乎相同,但它们的空间构型不同,因此它们的手性也不同。
这意味着它们的生物活性、吸收性和代谢方式等都会有所不同。
此外,分子的空间构型也可以影响分子的热力学性质。
分子的热力学性质是指分子在不同温度和压力下的物理状态和热学性质。
例如,分子的空间构型可以影响分子的熔点和沸点,因为它们决定了分子中的各个原子的相对位置和分子之间的相互作用力。
分子的空间构型还可以影响分子的光学旋光度、溶解度、稳定性以及有机溶剂和水的亲疏性等性质。
总之,分子的空间构型和性质之间存在密切的关系。
了解分子的空间构型可以帮助我们深入了解分子的物理和化学性质,从而实现对分子结构和性质的精确设计和控制。



化学中的分子结构和空间构型分子结构和空间构型是化学中的重要概念,它们对于理解分子性质和反应机制具有重要意义。
在化学中,分子结构指的是分子中原子的相对位置和连接方式,而空间构型则描述了分子在三维空间中的排列方式。
本文将从分子结构和空间构型的基本概念、分子结构的表示方法和空间构型的分类等方面进行阐述。
首先,分子结构是指分子中原子之间的连接方式和排列。
原子之间的连接通过共价键或离子键实现,而原子之间的排列、相对位置则决定了分子的性质和反应行为。
分子结构的表示通常使用结构式、线角式、空间填充式等形式。
其中,结构式是一种常用的表示方法,它通过线段和点的连接来表达分子中的原子和它们之间的键。
线角式则通过将原子用线段表示,连接处的角度表示键的方向。
空间填充式则是以实心球来表示原子,通过球的大小来表示原子的大小,以及原子之间的空间关系。
这些表示方法可以有效地帮助我们理解分子结构和进行分子的模拟研究。
其次,空间构型描述了分子在三维空间中的排列方式。
分子的空间构型与原子的相对位置和取向有关,因此空间构型也影响着分子的性质和反应机制。
常见的空间构型包括线性构型、平面构型、三角锥构型、四面体构型等。
线性构型指的是分子中原子的排列呈直线状,如氨分子等。
平面构型指的是分子中原子排列在同一平面上,如苯分子等。
三角锥构型指的是分子中一个原子为顶点,其余原子排列在底面的三角形上,如三氯化硼分子等。
四面体构型指的是分子中一个原子为中心,三个原子排列在其周围的三个顶点上,如甲烷分子等。
空间构型的不同将导致分子具有不同的对称性和性质,进而影响分子的化学反应。
另外,化学中的分子结构和空间构型还涉及到立体化学的研究。
立体化学是研究分子空间构型和立体异构体的学科,它对于理解分子的构建和反应机理非常重要。
在研究立体化学时,我们常常使用斜角投影法和虚化键线法等技术来表示分子的三维构型。
斜角投影法是一种常用的表示方法,它使用斜线和角度表示分子中的原子和键,可以清晰地展示分子的空间构型。

化合物的结构与分子的空间构型化合物的结构和分子的空间构型是化学领域中重要的概念。
化合物的结构决定了其性质和行为,而分子的空间构型则描述了分子中原子的排列方式和空间取向。
通过研究化合物的结构和分子的空间构型,我们可以深入了解化学反应机理、材料特性以及生物活性等方面。
一、化合物的结构化合物的结构是指其组成元素之间的连接方式及原子之间的相对位置。
根据化学键的特性,化合物的结构可以分为离子化合物和共价化合物两类。
离子化合物通常由正负电荷吸引形成晶体结构,其中正负离子以离子键相连。
离子化合物的结构可由离子晶体结构描述,如氯化钠晶体中,钠离子与氯离子通过离子键相连。
共价化合物则由共用电子对形成共价键而连接原子。
共价化合物的结构可用共价键的方式来表示,例如水分子(H2O)中,氢原子与氧原子通过共价键连接。
除了离子晶体和共价键之外,还存在其他形式的化合物结构,如金属结构、配位化合物等。
这些不同的结构形式决定了化合物的性质和用途。
二、分子的空间构型分子的空间构型描述了分子中各原子的三维空间排列方式。
分子的空间构型能够影响分子的性质和反应活性。
分子的空间构型受到原子之间的键角、双键与单键之间的取向、空间位阻等因素的影响。
通过分子的空间构型,我们可以预测分子的形状和化学性质。
在描述分子的空间构型时,常常使用VSEPR理论(分子维氏知觉范式理论)。
VSEPR理论基于原子间的排斥,预测了分子的形状。
例如,在水分子中,氧原子的两对孤电子和两个氢原子形成了一个偏心分子,呈现出角度为104.5°的V形构型。
此外,分子的空间构型还与立体异构有关。
在立体异构中,分子的分子式不变,但原子在空间中的排列方式不同,导致产生不同的化学和生物活性。
例如,丙烯与环丁烯是同分异构体,分子式相同,但空间构型不同。
三、应用和意义化合物的结构和分子的空间构型的研究对于理解化学性质、反应机制以及预测材料性能具有重要意义。
在有机合成中,研究和确定化合物的结构和分子的空间构型有助于合成具有特定立体中心的化合物,并可以引导有机合成的路径及选择反应副路线。


分子和结构知识点总结一、分子和分子结构的概念1. 分子的概念分子是物质的最小单位,由原子组成,是具有一定稳定性和特定化学性质的微粒。
分子是原子通过共价键或离子键结合而成的。
每种物质都具有其特定的分子结构。
2. 分子结构的概念分子结构是指分子中各原子之间的相对位置和运动方式。
分子结构决定了事物的化学性质和物理性质。
二、分子模型1. 杨氏模型杨氏模型是用查特雷尔斯的图形分子构造理论来加以解释的,这是以“简单立方体”如稠密固体分子构造七普林排列更为合理。
这一模型在实验尚未确凿的情况下已通过推理来论证了分子的构造。
2. 平面六边形模型平面六边形模型是分子运动新用查特雷尔斯的图形分子构造理论为主的分子结构模型的简化记载,这种模型在理论预测结果尚未得到实验证实,实体没有确定以后就得已推证确立。
不过这一模型的基础概念是来自物理学中分子运动的图说文献。
3. 三角形分子模型三角形分子构造模型又从图说法中附加了以生成图论为基础的分子结构正面三角形模型更适用的构造分子理论来和辐射系议而较理想的融合型再得以进一步发展。
三、共价键和离子键1. 共价键共价键是由原子间的电子对相互共享而形成的化学键。
共价键又分为单共价键、双共价键和三共价键。
2. 离子键离子键是原子之间的电子迁移而形成的化学键。
在这种键中,金属原子失去电子为阳离子,非金属原子得到电子为阴离子。
四、分子结构的影响因素1. 电子构型原子的电子构型决定了分子的构造,包括了分子是由共价键还是离子键而成。
2. 氧化数氧化数是元素的化合价。
氧化数越高,化合物的共价性越大。
3. 原子大小原子大小对分子结构也有影响。
原子大小决定了分子的空间构型。
4. 分子间力分子间力是决定物质态的重要因素。
分子间力包括范德华力、氢键等。
五、共价分子结构1. 单原子分子单原子分子是由一种元素组成的分子。
例如,氢气、氮气、氧气。
2. 双原子分子双原子分子是由两种元素组成的分子。
例如,氧气(O2)、氮气(N2)。
杂化轨道类型及分子空间立体构型查缺补漏小专题1一、杂化轨道类型与分子构型分子结构与极性1.中心原子的杂化轨道类型与分子的空间构型参与杂化的原子轨道分子构型示例杂化轨道类型SP 一个S轨道,一个P轨道直线形CH三CHCO2BeCL2SP2一个S轨道,两个P轨道平面三角形CH2=CH2BF3\BCL3\CH2OSP3一个S轨道三个P轨道正四面体CH4\CCL4\NH4+三角锥形NH3V形H2S\H2O判断杂化轨道类型的一般方法:(1)看中心原子有没有形成双键或叁键.如果全为单键,则是SP3杂化,如果有一个双键,是SP2杂化,如果有2个双键或一个叁键,是SP杂化.(2)没有填充电子的空轨道,一般不参与杂化,1对孤电子对占据1个杂化轨道.价层电子对互斥理论几种分子或离子的立体构型:分子或离子中心原子的孤电子对数分子或离子的价层电子对数杂化轨道类型键角分子或离子的立体构型名称CO2 0 2 SP 180 直线形SO2 1 3 SP2120 V形BF3 0 3 SP2120 平面三角形CO32-0 3 SP2120 平面三角形CH4 0 4 SP3109.28 正四面体形NH4 + 0 4 SP3109.28 正四面体NH3 1 4 SP3107 三角锥形H2O 2 4 SP3105 V形另:CH3+.中心原子的价层电子对数与分子立体构型有密切的关系.对ABm型化合物,中心原子A的价层电子对数n的计算方法:n=[A的价电子数+m(8-B的价电子数)]/2;主族元素来说,价电子数等于原子的最外层电子数,计算当B为H时将式中的8改成2.高考题中考查方式:1.CO2与SO2分子的立体结构分别是和。
2.在碳酸二甲酯分子中,碳原子采用的杂化方式有,O-C-O的键角约。
3.P的氢化物的分子构型为 .其中原子采取杂化.4. 用价层电子互斥理论推断SnBr2分子中Sn-Br键的键角 120°(填大于或小于或等于),石墨晶体中,每个碳原子通过杂化与周围碳原子成键.5.丙烯腈(H2C=CH-CH三N)分子中碳原子轨道杂化类型是.6.SiF4和SO32-的中心原子杂化类型是 ,ClO3-的空间构型为 .7.甲醛分子的空间构型是C原子的轨道杂化类型是1mol甲醛分子中§键的数目为 .。
促敦市安顿阳光实验学校第二章分子结构与性质第二节分子的立体构型第1课时分子的立体构型(1)知识归纳一、形形色色的分子单原子分子(稀有气体)、双原子分子不存在立体构型,多原子分子中,由于空间的位置关系,会有不同类型的立体异构。
1.子分子——直线形和V形化学式立体构型结构式键角比例模型球棍模型CO2直线形______H 2O V形105°2.四原子分子——平面三角形和三角锥形化学式立体构型结构式键角比例模型球棍模型CH2O 平面三角形120°NH3三角锥形107°3.子分子化学式立体构型结构式键角比例模型球棍模型CH4________ 109°28'4.其他多原子分子的立体构型多原子分子的立体构型形形色色,异彩纷呈。
如白磷(P4,正四面体)、PCl5(三角双锥)、SF6(正八面体)、P4O6、P4O10、C60(“足球”状分子,由平面正五边形和正六边形组成)、C6H12(环己烷)、C10H16(烷)、S8、B12(硼单质)的立体构型如图所示。
P4(正四面体) PCl5(三角双锥)SF6(正八面体)P4O6P4O10 C60椅式C6H12船式C6H12C10H16S8B12二、价层电子对互斥理论1.价层电子对互斥理论的含义价层电子对互斥理论认为,分子的立体构型是价层电子对_____________的结果,价层电子对是指分子中的中心原子上的电子对,包括______________和中心原子上的_____________(未形成共价键的电子对)。
分子中的价层电子对由于_________作用而趋向于尽可能远离以减小排斥力,分子尽可能采取对称的立体构型。
电子对之间的夹角越大,排斥力_______。
2.价层电子对互斥模型电子对数成键电子对数孤电子对数价层电子对立体构型分子的立体构型典例2 2 0 直线形直线形BeCl23 3 0三角形三角形BF3 2 1 V形SnBr24 4 0四面体___________ CH4 3 1 三角锥形NH3 2 2 V形H2O3.价层电子对互斥模型说明的是价层电子对的立体构型,而分子的立体构型指的是成键电子对的立体构型,不包括孤电子对。
有机物的分子结构特点和主要化学性质有机物是由碳元素构成的化合物,具有分子结构特点和主要化学性质。
1.分子结构特点:(1)有机物分子中的碳原子通常以单、双或三键的形式与其他原子连接,形成杂化轨道,使碳原子能够与多个原子组成稳定的分子框架。
(2)有机物分子中常见的官能团包括羟基(-OH)、羰基(-C=O)、羧基(-COOH)、氨基(-NH2)等,这些官能团能够赋予有机物特定的化学性质和反应能力。
(3)有机物分子的空间构型通常存在立体异构体,即同一分子式但结构不同的化合物,如顺式异构体和反式异构体以及手性异构体。
这种立体异构体的存在使得有机物表现出不同的物理性质和化学性质。
2.主要化学性质:(1)燃烧性质:有机物可在氧气存在下燃烧,产生二氧化碳和水,并释放能量。
(2)反应活性:有机物分子中的官能团赋予了有机物在化学反应中的特定活性。
例如,羟基使有机物具有酸碱性质,能够与金属氢氧化物反应生成盐和水;羰基使有机物具有亲电性,容易发生加成反应、亲核取代反应和氧化反应等。
(3)氧化还原性质:有机物可以发生氧化反应和还原反应。
在氧化反应中,有机物失去氢原子或获得氧原子;在还原反应中,有机物获得氢原子或失去氧原子。
(4)酸碱性质:有机物中的羟基、羧基等官能团可以表现出酸碱性质。
羧基与碱反应生成盐,羟基与酸反应生成盐。
(5)缩合反应:有机物分子中的官能团可通过缩合反应与其他分子中的官能团结合形成新的化合物,如醛缩、酮缩等。
(6)聚合反应:有机物中的双键或三键可以发生聚合反应,使有机物分子通过共价键连接形成高分子化合物。
总之,有机物的分子结构特点和主要化学性质决定了其具有广泛的应用领域和重要的化学意义。
通过研究有机物的分子结构和化学性质,可以推动有机化学领域的发展,并开发出更多有机化合物的应用。