高中化学典型物质分子的空间构型
- 格式:doc
- 大小:39.00 KB
- 文档页数:1

第1课时分子的空间结构模型课程目标1.能用杂化轨道理论判断分子的空间构型。
2.理解价层电子对互斥理论的含义。
3.知道一些常见简单分子的空间构型。
图说考点基础知识[新知预习]一、杂化轨道理论1.杂化轨道在形成多原子分子的过程中,中心原子的若干____________的原子轨道重新组合,形成的一组能量相等、成分相同的新轨道。
.用杂化轨道理论解释甲烷分子的空间构型碳原子2s轨道上的1个电子进入2p空轨道,________2s轨道和________2p轨道“混合”,形成________________的4个sp3杂化轨道碳原子的4个____________轨道分别与氢原子的________轨道重叠,形成4个相同的σ键CH分子为____________结构,分子中C—H键之间的夹角都是3.用杂化轨道理论分析C2H6、C2H4、C2H2的成键情况烷烃中C原子均采取sp3杂化;烯烃中碳碳双键两端的碳原子采取sp2杂化;炔烃中碳碳三键两端的碳原子采取sp杂化。
二、价层电子对互斥理论1.价层电子对互斥理论分子的____________是“价层电子对”相互________的结果。
2.价层电子对互斥模型与分子的立体结构(1)(2)中心原子有孤电子对的分子[即时性自测]1.下列关于杂化轨道的叙述中,不正确的是( )A.分子的中心原子通过sp3杂化轨道成键时,该分子不一定为正四面体结构B.杂化轨道可用于形成σ键、π键或用于容纳未参与成键的孤电子对C.杂化前后的轨道数不变,但轨道的形状发生了改变D.sp3、sp2、sp杂化轨道的夹角分别为109° 28′、120°、180°2.下列分子的立体构型,可以用sp杂化方式解释的是( )A.HCl B.BeCl2C.BCl3 D.CCl43.下列对sp3、sp2、sp杂化轨道的夹角的比较,得出结论正确的是( )A.sp杂化轨道的夹角最大B.sp2杂化轨道的夹角最大C.sp3杂化轨道的夹角最大D.sp3、sp2、sp杂化轨道的夹角相等4.用价层电子对互斥理论预测下列粒子的立体结构是三角锥形的是( )A.PCl3 B.BeCl2C. N H4+ D.SO35.下列分子或离子中心原子形成4对σ键电子对的是( )A.CO2 B.SO2C. C O32− D.CH46.回答下列问题:(1)计算下列分子或离子中点“·”原子的价电子对数。

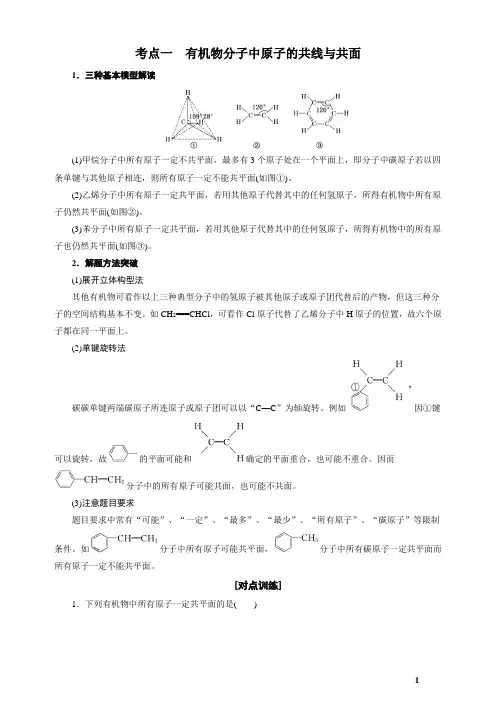
考点一有机物分子中原子的共线与共面1.三种基本模型解读(1)甲烷分子中所有原子一定不共平面,最多有3个原子处在一个平面上,即分子中碳原子若以四条单键与其他原子相连,则所有原子一定不能共平面(如图①)。
(2)乙烯分子中所有原子一定共平面,若用其他原子代替其中的任何氢原子,所得有机物中所有原子仍然共平面(如图②)。
(3)苯分子中所有原子一定共平面,若用其他原子代替其中的任何氢原子,所得有机物中的所有原子也仍然共平面(如图③)。
2.解题方法突破(1)展开立体构型法其他有机物可看作以上三种典型分子中的氢原子被其他原子或原子团代替后的产物,但这三种分子的空间结构基本不变。
如CH2===CHCl,可看作Cl原子代替了乙烯分子中H原子的位置,故六个原子都在同一平面上。
(2)单键旋转法碳碳单键两端碳原子所连原子或原子团可以以“C—C”为轴旋转。
例如因①键可以旋转,故的平面可能和确定的平面重合,也可能不重合。
因而分子中的所有原子可能共面,也可能不共面。
(3)注意题目要求题目要求中常有“可能”、“一定”、“最多”、“最少”、“所有原子”、“碳原子”等限制条件。
如分子中所有原子可能共平面,分子中所有碳原子一定共平面而所有原子一定不能共平面。
[对点训练]1.下列有机物中所有原子一定共平面的是()A.B.C.D.2.下列有机物分子中,所有原子一定处于同一平面的是()3.下列有关CH3—CH===CH—C≡C—CF3分子结构的叙述中,正确的是()A.6个碳原子有可能都在一条直线上B.6个碳原子不可能都在一条直线上C.6个碳原子不可能都在同一平面上D.所有原子有可能在同一平面上4.下列有关分子结构的叙述中正确的是()①除苯环外的其余碳原子有可能都在一条直线上②除苯环外的其余碳原子不可能都在一条直线上③12个碳原子不可能都在同一平面上④12个碳原子有可能都在同一平面上A.①②B.②③C.①③D.②④5.下列分子中的碳原子可能处在同一平面内的是()6.有机化合物X是一种医药中间体,其结构简式如图所示。
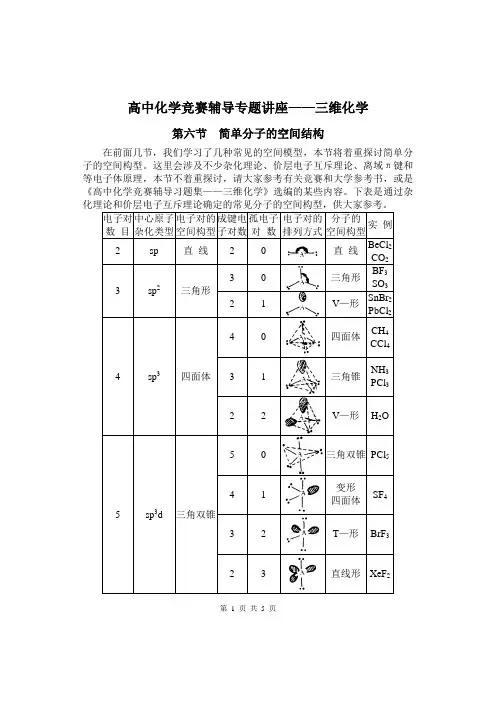
高中化学竞赛辅导专题讲座——三维化学第六节简单分子的空间结构在前面几节,我们学习了几种常见的空间模型,本节将着重探讨简单分子的空间构型。
这里会涉及不少杂化理论、价层电子互斥理论、离域π键和等电子体原理,本节不着重探讨,请大家参考有关竞赛和大学参考书,或是《高中化学竞赛辅导习题集——三维化学》选编的某些内容。
下表是通过杂第 1 页共 5 页【讨论】给出一个分子或离子,我们一般先找出中心原子,确定它的成键电子对数和孤电子对数,判断杂化类型和电子对构型,再判断分子或离子的构型。
由于等电子体具有类似的空间结构,我们也可以据此判断复杂的分子或离子的空间构型。
我们结合以下例题具体讨论。
【例题1】磷的氯化物有PCl3和PCl5,氮的氯化物只有NCl3,为什么没有NCl5?白磷在过量氯气(其分子有三种不同的相对分子质量)中燃烧时,其产物共有几种不同分子。
①【分析】PCl5中心原子P有3d轨道,能与3s、3p轨道一起参与杂化,杂化类型为sp3d,构型为三角双锥。
第二问是通过同位素来考察三角双锥的空间构型:“三角”是一个正三角形的三个顶点,等价的三个点;“双锥”是对称的两个锥顶。
P35Cl5的37Cl的一取代物可在角上和锥顶上2种情况;37Cl 的二取代物可在两个角上、两个锥顶上和一个角一个锥顶上3种情况;利用对称性,三取代物、四取代物与二取代物、一取代物是相同的。
共计有(1+2+3)×2=12种。
【解答】N原子最外层无d轨道,不能发生sp3d杂化,故无NCl5。
12种。
【练习1】PCl5是一种白色固体,加热到160℃不经过液态阶段就变成蒸气,测得180℃下的蒸气密度(折合成标准状况)为9.3g/L,极性为零,P-Cl键长为204pm和211pm两种。
继续加热到250℃时测得压力为计算值的两倍。
PCl5在加压下于148℃液化,形成一种能导电的熔体,测得P-Cl的键长为198pm和206pm两种。
(P、Cl相对原子质量为31.0、35.5)回答如下问题:①180℃下,PCl5蒸气中存在什么分子?为什么?写出分子式,画出立体结构。



高中化学分子立体结构知识点讲解高中化学对于大多数同学来说都是一门难学的功课。
不仅化学方程式需要记忆,还要记忆各种化学物质的性质及化学反应现象,更别说计算了。
一、常见分子的空间构型1.双原子分子都是直线形,如:HCl、NO、O2、N2等。
2.三原子分子有直线形,如CO2、CS2等;还有“V”形,如H2O、H2S、SO2等。
3.四原子分子有平面三角形,如BF3、BCl3、CH2O等;有三角锥形,如NH3、PH3等;也有正四面体,如P4。
4.五原子分子有正四面体,如CH4、CCl4等,也有不规则四面体,如CH3Cl、CH2Cl2、CHCl3。
另外乙烯分子和苯分子都是平面形分子。
二、价层电子对互斥模型1.理论模型分子中的价电子对(包括成键电子对和孤电子对),由于相互排斥作用,而趋向尽可能彼此远离以减小斥力,分子尽可能采取对称的空间构型。
2.价电子对之间的斥力(1)电子对之间的夹角越小,排斥力越大。
(2)由于成键电子对受两个原子核的吸引,所以电子云比较紧缩,而孤对电子只受到中心原子的吸引,电子云比较“肥大”,对邻近电子对的斥力较大,所以电子对之间斥力大小如下:孤电子对-孤电子对>孤电子对-成键电子>成键电子-成键电子(3)由于三键、双键比单键包含的电子数多,所以其斥力大小次序为三键>双键>单键。
3.价层电子对互斥模型的两种类型价层电子对互斥模型说明的是价层电子对的空间构型,而分子的空间构型指的是成键电子对空间构型,不包括孤对电子。
(1)当中心原子无孤对电子时,两者的构型一致;(2)当中心原子有孤对电子时,两者的构型不一致。
4.用价层电子对互斥理论推断分子或离子的空间构型具体步骤:(1)确定中心原子A价层电子对数目中心原子A的价电子数与配体X提供共用的电子数之和的一半,即中心原子A价层电子对数目。
计算时注意:氧族元素原子作为配位原子时,可认为不提供电子,但作中心原子时可认为它提供所有的6个价电子。

一、乙炔分子的结构和组成分子式电子式结构式C 2H2 H-C≡C-H 乙炔分子的比例模型二、乙炔的实验室制法CaC 2+2H2O C2H2↑+Ca(OH)2乙炔可以通过电石和水反应得到。
实验中又该注意哪些问题呢?实验室制乙炔的几点说明:①实验装置在使用前要先检验气密性,只有气密性合格才能使用;②盛电石的试剂瓶要及时密封,严防电石吸水而失效;③取电石要用镊子夹取,切忌用手拿电石;④作为反应容器的烧瓶在使用前要进行干燥处理;⑤向烧瓶里加入电石时,要使电石沿烧瓶内壁慢慢滑下,严防让电石打破烧瓶;⑥电石与水反应很剧烈,向烧瓶里加水时要使水逐滴慢慢地滴下,当乙炔气流达到所需要求时,要及时关闭分液漏斗活塞,停止加水;电石是固体,水是液体,且二者很易发生反应生成C2H2气体。
很显然C2H2的生成符合固、液,且不加热制气体型的特点,那是不是说就可以用启普发生器或简易的启普发生器来制取乙炔呢?⑦实验室中不可用启普发生器或具有启普发生器原理的实验装置作制备乙炔气体的实验装置。
主要原因是:a.反应剧烈,难以控制。
b.当关闭启普发生器导气管上的活塞使液态水和电石固体分离后,电石与水蒸气的反应还在进行,不能达到“关之即停”的目的。
c.反应放出大量的热,启普发生器是厚玻璃仪器,容易因受热不均而炸裂。
d.生成物Ca(OH)2微溶于水,易形成糊状泡沫,堵塞导气管与球形漏斗。
该如何收集乙炔气呢?乙炔的相对分子质量为26,与空气比较接近,还是用排水法合适。
熟悉和体会有关乙炔气体制备的注意事项及收集方法,并由两名学生上前按教材乙炔的制取装置图组装仪器,检查气密性,将电石用镊子小心地夹取沿平底烧瓶内壁缓慢滑下,打开分液漏斗的活塞使水一滴一滴地缓慢滴下,排空气后,用排水法收集乙炔气于一大试管中。
由几个学生代表嗅闻所制乙炔气的气味。
请大家根据乙炔分子的结构和所收集的乙炔气来总结乙炔具有哪些物理性质?三、乙炔的性质1.物理性质无色、无味、ρ=1.16g/L、微溶于水、易溶于有机溶剂实际上纯的乙炔气是没有气味的,大家之所以闻到特殊难闻的臭味是由于一般所制备得到的乙炔气中常含有PH3、H2S等杂质造成的。

【大题逐点过】2022年高考化学二轮复习专项练习(全国通用)专练18 分子结构和性质一、微粒的空间构型和杂化1.(2021·天津河西区一模)NH 3分子的VSEPR 模型名称为______________【解析】NH 3分子中,N 23×15-=1,成键电子对数为3,价层电子对为n =1+3=4,则氮原子的轨道杂化类型为3分子的VSEPR 模型名称为正四面体形,分子的实际构型为三角锥形。
【答案】正四面体形2.(2021·哈尔滨第一次调研)Ti (BH 4)2是一种储氢材料。
BH 4-的空间构型是_____________,B 原子的杂化方式_____。
【解析】BH 4-中B 原子的孤电子对数=21413⨯+-=0,价层电子对数=0+4=4,BH 4-的空间构型与VSEPR 模型相同,即为正四面体,杂化轨道数目为4,B 原子采取sp 3杂化;【答案】正四面体;sp 33.(2021·石嘴山一模)Na 3[Co (NO 2)6]常用作检验K +的试剂,配位体NO 2-的中心原子的杂化形式为______,空间构型为__________。
【解析】配位体NO 2-的中心原子N 原子价层电子对个数n =2+22×215-+=3,且含有1个孤电子对,根据价层电子对互斥理论判断N sp 2、V 形。
【答案】sp 2;V 形4.(2019·全国卷Ⅲ)NH 4H 2PO 4中,P 的____杂化轨道与O 的2p 轨道形成_______键。
【解析】P 的杂化轨道计算公式为4+21(5+3-8)=4,所以P 的sp 3杂化轨道与O 的2p 轨道形成σ键。
【答案】sp 3;σ5.(2021·湖北省示范高中联考)H 3BO 3为一元酸,与足量NaOH 溶液反应得到[B (OH )4]-,H 3BO 3和[B (OH )4]-中B 的杂化轨道类型分别为为____________、____________。
第2节共价键与分子的空间构型第1课时一些典型分子的空间构型学习目标 1.掌握轨道杂化的基本思想,并能用杂化轨道理论判断简单分子共价键的形成和空间构型。
一、甲烷分子的空间构型化学式:________,结构式:________________,分子的立体结构模型:二、杂化轨道理论1.杂化轨道在外界条件影响下,原子内部能量________的原子轨道重新组合的过程叫做原子轨道的杂化,组合后形成的一组新的原子轨道,叫做________________,简称杂化轨道。
杂化轨道在角度分布上比单纯的s或p轨道在某一方向上更________,从而使它与其他原子的原子轨道重叠的程度更大,形成的共价键更__________。
通常,有多少个原子轨道参加杂化,就形成多少个杂化轨道。
2.杂化轨道的类型1.下列分子的空间构型是正四面体形的是( )①CH4②NH3③CF4④SiH4⑤C2H4⑥CO2A.①②③ B.①③④C.②④⑤ D.①③⑤2.下列分子的空间构型,可以用sp1杂化方式解释的是( )A.HCl B.BeCl2 C.PCl3 D.CCl43.在BrCH===CHBr分子中,C—Br键采用的成键轨道是( )A.sp1—p B.sp3—sC.sp2—p D.sp3—p4.下列分子的中心原子形成sp2杂化轨道的是( )A.H2O B.NH3C.C2H4 D.CH45.下列分子中的中心原子杂化轨道的类型相同的是( )A.CO2与SO2 B.CH4与NH3C.BeCl2与BF3 D.C2H4与C2H2练基础落实知识点一一些典型分子的空间构型1.下列分子中键角最小的是( )A.H2O B.CO2 C.BF3 D.CH42.NH3分子空间构型是三角锥形,而CH4是正四面体形,这是因为( )A.两种分子的中心原子杂化轨道类型不同,NH3为sp2杂化,而CH4是sp3杂化B.NH3分子中N原子形成3个杂化轨道,CH4分子中C原子形成4个杂化轨道C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强D.NH3分子中有3个σ键,而CH4分子中有4个σ键知识点二杂化轨道理论3.sp3杂化形成的AB4型分子的空间构型是( )A.平面四边形 B.四面体形C.四角锥形 D.平面三角形4.下列分子中的碳原子采取sp2杂化的是( )A.C2H2 B.C2H4C.C3H8 D.CO25.有关甲醛分子的说法正确的是( )A.C原子采取sp1杂化B.甲醛分子为三角锥形结构C.C原子采取sp2杂化D.甲醛分子为三角锥形结构6.三氯化磷分子的空间构型是三角锥形而不是平面正三角形,下列关于三氯化磷分子空间构型的叙述,不正确的是( )A.PCl3分子中P采用sp3杂化B.PCl3分子中P—Cl键属于极性共价键C.PCl3分子中三个共价键键能、键角均相等D.PCl3是非极性分子练方法技巧较复杂分子的空间构型的判断7.下列关于丙烯()的说法不正确的是( )A.丙烯分子有8个σ键,1个π键B.丙烯分子中3个碳原子都是sp3杂化C.丙烯分子中存在非极性键D.丙烯分子中3个碳原子不在同一直线上8.下列关于分子结构的叙述中,正确的是( )①6个碳原子可能都在一条直线上②6个碳原子不可能都在同一条直线上③6个碳原子可能都在同一平面上④6个碳原子不可能都在同一平面上A.①③ B.②③C.①④ D.②④练高考真题9.(2008·四川理综,27)D、E、X、Y、Z是周期表中的前20号元素,且原子序数逐渐增大,它们的最简单氢化物分子的空间结构依次是正四面体、三角锥形、正四面体、角形(V形)、直线形。
第二节分子的立体构型第1课时价层电子对互斥理论[学习目标定位] 1.认识共价分子结构的多样性和复杂性。
2.理解价层电子对互斥理论的含义。
3.能根据有关理论判断简单分子或离子的构型。
一、常见分子的立体构型写出下列物质分子的电子式和结构式,并根据键角确定其分子构型:(1)分子的立体构型与键角的关系:(2)典型有机物分子的立体结构:C2H4、苯(C6H6)、CH2==CH—CH==CH2(1,3-丁二烯)、CH2==CH—C≡CH(乙烯基乙炔)等都是平面形分子;C2H2为直线形分子。
例1(2017·衡水中学高二调考)下列有关键角与分子立体构型的说法不正确的是()A.键角为180°的分子,立体构型是直线形B.键角为120°的分子,立体构型是平面三角形C.键角为60°的分子,立体构型可能是正四面体形D.键角为90°~109°28′之间的分子,立体构型可能是V形【考点】常见分子的立体构型【题点】键角与分子立体构型的关系答案 B解析键角为180°的分子,立体构型是直线形,例如CO2分子是直线形分子,A正确;苯分子的键角为120°,但其立体构型是平面正六边形,B错误;白磷分子的键角为60°,立体构型为正四面体形,C正确;水分子的键角为105°,立体构型为V形,D正确。
例2下列各组分子中所有原子都可能处于同一平面的是()A.CH4、CS2、BF3B.CO2、H2O、NH3C.C2H4、C2H2、C6H6l4、BeCl2、PH3【考点】常见分子的立体构型【题点】常见分子立体构型的综合判断答案 C解析题中的CH4和CCl4为正四面体形分子,NH3和PH3为三角锥形分子,这几种分子的所有原子不可能都在同一平面上。
CS2、CO2、C2H2和BeCl2为直线形分子,C2H4为平面形分子,C6H6为平面正六边形分子,这些分子都是平面形结构。