分子的空间构型
- 格式:ppt
- 大小:859.50 KB
- 文档页数:27

化学键与分子的空间构型化学键是化学中的一个重要概念,它是描述原子之间结合的力。
在化学键的形成中,电子在原子之间转移、共享或重排,从而形成化学键。
通过化学键,原子可以组合成分子,并且这些分子的三维空间构型对它们在化学反应中的性质和活性起着至关重要的影响。
分子的空间构型是指分子中原子的空间排列方式。
原子之间的化学键的性质决定了分子的空间构型。
例如,共价键是由共享电子形成的一种连接形式。
共价键的键长和键角对分子的结构起着重要作用。
不同键长和键角会导致分子的不同构型。
例如,氨分子(NH3)和水分子(H2O)中的键角不同,从而使得氨分子呈现三角锥形构型,而水分子呈现微弯的构型。
除了共价键,离子键也是分子空间构型的一个重要因素。
离子键是由原子之间的电荷吸引力形成的。
正离子和负离子通过电荷吸引力相互结合形成离子键。
离子键的键能较高,使得离子在晶体中排列有序。
这种有序排列决定了离子晶体的空间构型。
例如,氯化钠晶体中,钠离子和氯离子以菱形密堆积的方式排列,形成立方晶系的构型。
另一种常见的化学键类型是金属键。
在金属中,金属原子之间通过顺滑的电子云相互结合形成金属键。
由于金属键的性质,金属具有良好的导电性和导热性。
金属键的强度和金属原子之间的排列方式决定了金属的物理性质和力学性质。
例如,钢中的铁原子通过金属键排列有序,形成具有高强度和韧性的晶格结构。
还有一种特殊的化学键类型是氢键。
氢键是由氢原子与较电负的原子(如氮、氧、氟)之间的电荷吸引力形成的键。
氢键通常较强,但比共价键和离子键弱。
氢键在生物体系中起着重要的作用。
例如,DNA分子的螺旋结构就是由氢键稳定的,这使得DNA能够保存遗传信息。
化学键的性质和分子的空间构型是相互关联的。
化学键的类型和强度决定了分子的整体结构。
分子的空间构型会影响分子的性质和反应性质。
例如,如果一个分子具有线性构型,那么它的极性可能较强,从而影响溶解度和反应性。
此外,分子的空间构型还与分子之间的相互作用有关,从而影响化学反应的速率和选择性。


解析有机物分⼦中原⼦共平⾯、共直线问题_【最全⾯】如何分析有机物分⼦中原⼦共平⾯的问题分⼦内原⼦共线、共⾯的判定,仅为⼀维、⼆维想象,但存在线⾯、⾯⾯的交叉,所以有⼀定的难度。
⼀、⼏个特殊分⼦的空间构型1.常见分⼦的空间构型:①CH4分⼦为正四⾯体结构,其分⼦最多有3个原⼦共处同⼀平⾯。
②⼄烯分⼦中所有原⼦共平⾯。
③⼄炔分⼦中所有原⼦共直线。
④苯分⼦中所有原⼦共平⾯。
⑤H—CHO分⼦中所有原⼦共平⾯。
(1)熟记四类空间构型中学有机化学空间结构问题的基⽯是甲烷、⼄烯、⼄炔和苯的分⼦结构。
甲烷型:正四⾯体结构,4个C—H健不在同⼀平⾯上凡是碳原⼦与4个原⼦形成4个共价键时,空间结构都是正四⾯体结构以及烷烃的空间构型 5个原⼦中最多有3个原⼦共平⾯。
⼄烯型:平⾯结构。
六个原⼦均在同⼀平⾯上凡是位于⼄烯结构上的六个原⼦共平⾯。
⼄炔型:直线型结构。
四个原⼦在同⼀条直线上凡是位于⼄炔结构上的四个原⼦共直线。
苯型:平⾯正六边形结构。
六个碳原⼦和六个氢原⼦共平⾯凡是位于苯环上的12个原⼦共平⾯。
(2)理解三键三⾓三键:C—C键可以旋转,⽽C=C键、C≡C键不能旋转。
三⾓:甲烷中的C—H键之间的夹⾓为109°28′,⼄烯和苯环中的C—H键之间的夹⾓为120°,⼄炔中的C—H键之间的夹⾓为180°。
2.单键的转动思想有机物分⼦中的单键,包括碳碳单键、碳氢单键、碳氧单键等可转动。
⼆、结构不同的基团连接后原⼦共⾯分析例1请分析苯⼄炔(C CH)分⼦中最多有多少个原⼦共平⾯?分析:与C CH直接相连的苯环上的碳原⼦相当于C C HH分⼦中1个氢原⼦所处的位置,应与C CH在同⼀条直线上;与苯环相连的C CH中碳原⼦相当于苯分⼦中氢原予所处的位置,应在苯环所在的平⾯内。
由此可知C CH所在直线上有两点在苯环的平⾯内,所以苯⼰炔分⼦中所有原⼦均在同⼀平⾯,即苯⼄炔分⼦中8个碳原⼦、6个氢原⼦均在同⼀平⾯内。


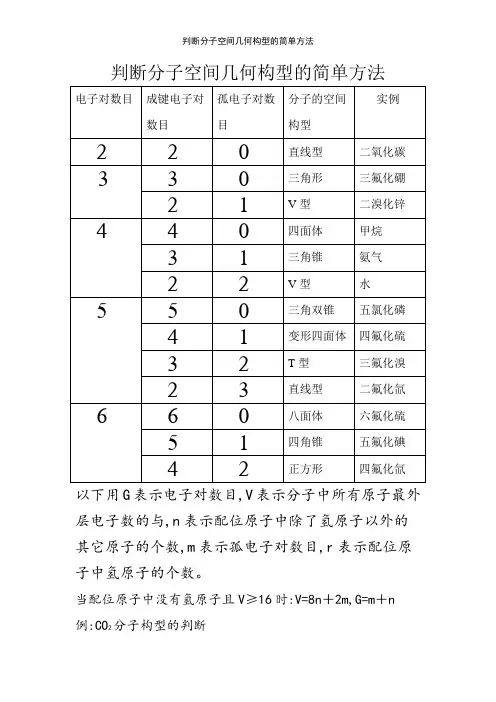
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的与,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0, ∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V为奇数时,只需将V与G瞧成比它们大1的偶数即可!。

有机化学基础知识点整理有机分子的空间构型的确定方法和实验技术有机分子的空间构型是指分子中各原子的空间排列方式,它决定了分子的化学性质和活性。
为了确定有机分子的空间构型,需要掌握一些基础知识和实验技术。
本文将整理有机化学的基础知识点,并介绍确定有机分子空间构型的方法和实验技术。
一、手性和对映体1. 手性:手性是指分子或物体与其镜像不能完全重合的性质。
手性分子是由手性中心或轴对称的手性体构成的。
2. 手性中心:手性中心是指一个碳原子上有四个不同的基团,使得原子周围的立体结构非对称。
3. 对映体:对映体是指与手性分子镜像关系的化学物质。
对映体具有相同的物理和化学性质,但对旋光性和反应性可能有不同的影响。
二、有机分子的构型表示1. 三维投影式:通过三维投影式可以直观地表示有机分子的立体结构。
常用的三维投影式有齐式、轴式和斜式。
2. 锥式结构:锥式结构可以用来表示旋转受限的有机分子的构型。
锥式结构通过锥角的不同来表示分子的构型。
三、确定有机分子空间构型的方法1. X射线衍射:X射线衍射是一个确定有机分子三维结构的重要方法。
通过测定X射线的衍射图案,可以得到分子的原子坐标和键角等信息。
2. 红外光谱:红外光谱可以提供分子的振动信息,从而得到有机分子的几何结构。
3. 核磁共振(NMR):核磁共振可以通过观察核磁共振信号的耦合常数来确定有机分子的构型。
4. 紫外-可见光谱:紫外-可见光谱通过分析物质对紫外和可见光的吸收和发射,可以得到一些关于分子构型的信息。
四、实验技术1. 气相色谱:气相色谱是一种常用的有机物分离和鉴定技术。
通过气相色谱的分离和检测方法,可以确定有机分子的构型。
2. 液相色谱:液相色谱包括高效液相色谱和常压液相色谱等,可以用于有机分子的纯化和分析。
3. 质谱:质谱是一种高分辨率、高灵敏度的分析技术,可以用于有机分子的分子量测定和结构鉴定。
五、总结有机分子的空间构型的确定对于了解分子的结构和性质至关重要。



空间构型的计算方法
空间构型是指分子或离子中原子的排列方式,它是化学中的重要概念。
空间构型的计算方法是通过计算原子之间的键角、键长、电子云密度等物理量来确定分子的空间结构。
下面将介绍几种常见的空间构型计算方法。
1. VSEPR理论
VSEPR理论即“分子的电子对排斥作用理论”,它认为原子之间的键角是由于电子对的相互排斥而形成的。
VSEPR理论的计算方法是通过计算分子中每个原子的电子对数和分子的空间构型,进而推导出分子的键角。
例如,对于氨分子,它的分子式为NH3,其中氮原子的电子对数为3,所以它的空间构型是三角锥形。
根据VSEPR理论,氨分子的键角为107度。
2. 分子轨道理论
分子轨道理论认为分子中的电子并不是单独存在的,它们形成了一系列的分子轨道。
分子轨道的计算方法是通过计算原子之间的键长和电子云密度来确定分子的空间结构。
例如,对于氧分子,它的分子式为O2,其中氧原子之间的键长为1.21埃,根据分子轨道理论,氧分子的空间构型是线性的。
3. 密度泛函理论
密度泛函理论是一种基于电子密度分布的理论,它认为分子中的电子云密度是决定分子结构的关键因素。
密度泛函理论的计算方法是通过计算分子中每个原子的电子密度和分子的电子云密度分布来确定分子的空间结构。
例如,对于甲烷分子,它的分子式为CH4,其中碳原子的电子密度较高,而氢原子的电子密度较低,根据密度泛函理论,甲烷分子的空间构型是四面体形。
空间构型的计算方法在化学中具有重要的应用价值,它可以帮助我们更好地理解分子的结构和性质。
不同的计算方法具有不同的优缺点,我们需要根据具体情况选择合适的方法来进行计算。
(1)线性分子,中心原子为sp杂化,如乙炔。
(2)平面内的分子形如乙烯的,中心原子为sp2杂化。
(3)空间(正)四面体,中心原子sp3杂化,如四氯化碳。
(4)空间六面体(形如两个空间正四面体底对底拼在一起),中心原子为sp3d杂化。
(5)空间八面体(形如两个金字塔底对底拼在一起),中心原子为sp3d2杂化。
相关介绍:
分子的空间构型是指分子中各种基团或原子在空间分布的几何形状。
分子中的原子不是杂乱无章地堆积在一起,而是按照一定规律结合的整体,使分子在空间呈现出一定的几何形状(即空间构型)。
如果确定了某分子内化学键的键长和键角数据,那么这个分子的几何构型就确立了。
1940年美国的Sidgwick N.V.等人相继提出了价层电子对互斥理论,简称VSEPR法,该法适用于主族元素间形成的ABn型分子或离子。
该理论认为,一个共价分子或离子中,中心原子A周围所配置的原子B(配位原子)的几何构型,主要决定于中心原子的价电子层中各电子对间的相互排斥作用。
这些电子对在中心原子周围按尽可能互相远离的位置排布。
以使彼此间的排斥能最小。
所谓价层电子对,指的是形成σ键的电子对和孤对电子。
孤对电子的存在,增加了电子对间
的排斥力,影响了分子中的键角。
会改变分子构型的基本类型。
判断分子空间几何构型的简单方法以下用G表示电子对数目,V表示分子中所有原子最外层电子数的和,n表示配位原子中除了氢原子以外的其它原子的个数,m表示孤电子对数目,r表示配位原子中氢原子的个数。
当配位原子中没有氢原子且V≥16时:V=8n+2m,G=m+n 例:CO2分子构型的判断V=4+6×2=8n+2m,这里n=2,∴m=0,∴G=m+n=0+2=2,所以CO2的分子构型为直线型BF3分子构型的判断V=3+7×3=8n+2m,这里n=3,∴m=0,∴G=m+n=0+3=3,所以BF3的分子构型为三角形PCl5分子构型的判断V=5+7×5=8n+2m,这里n=5,∴m=0,∴G=m+n=0+5=5,所以PCl5的分子构型为三角双锥SF4分子构型的判断V=6+7×4=8n+2m,这里n=4,∴m=1,∴G=m+n=1+4=5,所以SF4的分子构型为变形四面体BrF3分子构型的判断V=7+7×3=8n+2m,这里n=3,∴m=2,∴G=m+n=2+3=5,所以BrF3的分子构型为T型SF6分子构型的判断V=6+7×6=8n+2m,这里n=6,∴m=0,∴G=m+n=0+6=6,所以SF6的分子构型为八面体XeF4分子构型的判断V=8+7×4=8n+2m,这里n=4,∴m=2,∴G=m+n=2+4=6,所以XeF4的分子构型为正方形当配位原子中有氢原子且V<16时:V=2r+8n+2m, G=m+n+r。
例:CH4分子构型的判断V=4+1×4=2r+8n+2m,这里r=4,n=0,∴m=0,∴G=m+n+r=0+0+4=4,所以CH4的分子构型为四面体NH3分子构型的判断V=5+1×3=2r+8n+2m,这里r=3,n=0,∴m=1,∴G=m+n+r=1+0+3=4,所以NH3的分子构型为三角锥 H2O分子构型的判断V=6+1×2=2r+8n+2m,这里r=2,n=0,∴m=2,∴G=m+n+r=2+0+2=4,所以H2O的分子构型为V型HClO分子构型的判断V=1+7+6=2r+8n+2m,这里r=1,n=1,∴m=2,∴G=m+n+r=2+1+1=4,所以HClO的分子构型为V型HNO分子构型的判断V=1+5+6=2r+8n+2m,这里r=1,n=1,∴m=1,∴G=m+n+r=1+1+1=3,所以HNO的分子构型为V型HCN分子构型的判断V=1+4+5=2r+8n+2m,这里r=1,n=1,∴m=0,∴G=m+n+r=0+1+1=2,所以HCN的分子构型为直线型注:以上所介绍的方法只有当V为偶数时才适用,当V 为奇数时,只需将V和G看成比它们大1的偶数即可!。