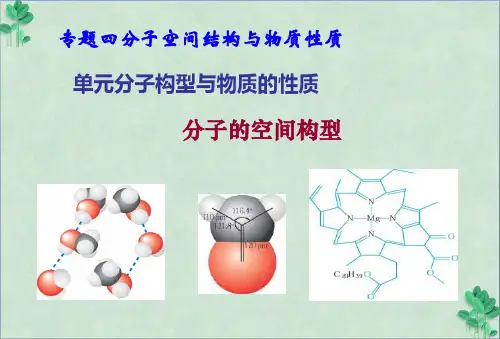
SO2
三、价中层心原互子斥的理孤论对电子也要占据中心原子的空间,并与成键电
子对互相排斥。推测分子的立体模型必须略去VSEPR模型中的孤
电子VS对E。PR模型应用——预测分子立体构型
分子或离子 σ键电 孤电子 VSEPR模型及名称
子对数 对数
分子的立体构 型及名称
CO2
2
0
直线形
CO32-
SO2
三、价中层心原互子斥的理孤论对电子也要占据中心原子的空间,并与成键电
合原子数
子对
子对 子对数
H2O
NH3
CH4
CO2
1. 价层电子对(成键的σ键电子对和未成键的孤电子对)
代表物 电子式 中心原子结 σ键电 孤对电 价层电
合原子数
子对
子对 子对数
::
H2O H:O :H
2
2
2
NH3
CH4
CO2
1. 价层电子对(成键的σ键电子对和未成键的孤电子对)
代表物 电子式 中心原子结 σ键电 孤对电 价层电
键角
子对 模型
体构型
CH4 4+0=4
没有孤电子对,排斥力较小, 键角较大,为109°28′
NH3 3+1=4 H2O 2+2=4
有1对孤电子,排斥力比甲烷 大,键角比甲烷小,为107°
有2对孤电子,排斥力更大, 键角更小,为105°
【小试牛刀】下列说法正确的是( )
A.CS2分子的立体构型是V形 B.NF3分子的立体构型是四面体形 C.键长、键角不同是导致分子构型不同的主要原因
H2O 2+2=4
思考:为什么CH4、NH3、H2O价层电子对都是四对,但键角却逐渐减小呢? 分子的立体构型实质是价层电子对相互排斥的结果