大学化学_甘孟瑜_第4章电化学原理及其应用
- 格式:ppt
- 大小:572.50 KB
- 文档页数:35

电解原理及其应用一、选择题(每小题4分,每小题有1~2个正确选项,共40分)1.有关电解原理的说法正确的是( )①电解是把电能转变成化学能 ②电解是把化学能转变成电能 ③电解质溶液导电是化学变化,金属导电是物理变化④不能自发进行的氧化还原反应,通过电解的原理可以实现⑤任何溶液被电解时,必然导致氧化还原反应的发生A .①②③④B .②③⑤C .③④D .①③④⑤答案:D 解析:本题考查电解原理,清楚电解是把电能转变为化学能,故①正确、②错误;电解质溶液导电是靠阴、阳离子定向移动而实现的,即是一个电解过程,故是化学变化,金属导电是电子定向移动而产生电流,是物理变化,故③正确;电解是加强条件下进行的氧化还原反应,是不能自发进行的,故④正确。
2.根据金属活动性顺序表,Cu 不能发生Cu +2H 2O===Cu(OH)2↓+H 2↑的反应。
但选择恰当电极材料和( )答案:B Cu 作阳极时,自身失电子,电极反应为Cu -2e -===Cu 2+,阴极反应为2H ++2e -===H 2↑,A 项不符合;B 项,Na 2SO 4溶液起增强导电性作用,电解总反应为Cu +2H 2O =====电解Cu(OH)2+H 2↑,符合题意;C 项,电解液H 2SO 4会与生成的Cu(OH)2发生中和反应,实际上不会生成Cu(OH)2,不符合;D 项,H 2O 导电能力不强,不符合。
3.如图所示的两个装置中,溶液的体积均为200 mL ,开始时电解质溶液的浓度均为0.1 mol/L 。
工作一段时间后,测得导线中均通过0.02 mol 电子。
若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是A .产生气体的体积:①>②B .溶液的pH 变化:①增大,②减小C .电极上析出固体物质的质量:①>②D .电极反应式:①的阴极:Cu 2++2e -===Cu ,②的负极:2H ++2e -===H 2↑答案:C 解析:本题考查电解原理和原电池知识。




电化学原理及其应用第4章电化学原理及应用5课时教学目标及基本要求1. 明确原电池及相关的概念。
了解电极的分类,了解电极电势的概念。
2. 能用能斯特方程式进行有关计算。
能应用电极电势的数据判断氧化剂、还原剂的相对强弱及氧化还原反应自发进行的方向和程度。
3. 了解摩尔吉布斯自由能变与原电池电动势,标准摩尔吉布斯自由能变与氧化还原反应平衡常数的关系。
4. 了解电解、电镀、电抛光的基本原理,了解它们在工程上的应用。
了解金属腐蚀及防护原理。
教学重点1. 原电池符号的书写2. 影响电极电势的因素3. 电极电势与吉布斯的关系4. 电极电势的应用教学难点1. 电极类型2. 能斯特方程及相关计算3. 应用电极电势判断氧化剂、还原剂的相对强弱本章教学方式(手段)及教学过程中应注意的问题本章采用多媒体结合板书的方式进行教学。
在教学过程中注意1. 原电池的设计2. 浓度、酸度对电极电势的影响3. 电极电势的应用主要教学内容4.1 原电池(Electrochemical cell)任何自发进行的氧化还原(oxidation-reduction) 反应,只要设计适当,都可以设计成原电池用以产生电流。
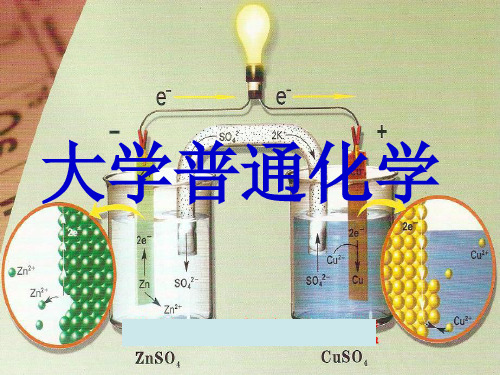
4.1.1 原电池的结构与工作原理Zn(s)+Cu2+(aq)=Zn2+(aq)+Cu(s)负极Zn(s) → Zn2+(aq)+2e-(Oxidation)正极Cu2+(aq)+2e-→ Cu(s) (Reduction)总反应:Zn(s)+ Cu2+(aq) → Zn2+(aq)+ Cu(s)原电池的符号(图式)(cell diagram) 表示: 如铜- 锌原电池, :Zn ∣ZnSO4(c1) ┊┊CuSO4(c2) ∣Cu规定:(1) 负极(anode) 在左边,正极(Cathode) 在右边,按实际顺序从左至右依次排列出各个相的组成及相态;(2) 用单实竖线表示相界面, 用双虚竖线表示盐桥; (3) 溶液注明浓度,气体注明分压;(4) 若溶液中含有两种离子参加电极反应, 可用逗号隔开,并加上惰性电极.4.1.2 电极类型按氧化态、还原态物质的状态分类:第一类电极:元素与含有这种元素离子的溶液一起构成的电极。
化学教案:电化学反应的基本原理与应用一、电化学反应的基本原理电化学是研究电与化学变化之间关系的科学,它涉及了许多重要的概念和原理。
在电化学反应中,电子转移和离子迁移是两个基本过程,通过它们可以实现物质的氧化还原和电解。
1. 电子转移在电化学反应中,发生氧化还原反应时,会存在一个或多个物质失去或获得电子。
这种电子转移过程称为电子转移。
在一个完整的氧化还原反应中,就必须有一个物质被氧化(失去电子),同时另一个物质被还原(获得电子)。
这样的转移过程使得正负荷分离,并产生了引起进一步反应的活力。
2. 离子迁移除了电子转移外,在某些情况下也会发生离子迁移。
当溶液中存在能够形成离解出来的离子时,这些离子可以自由地在溶液中游动,并参与到其他化学反应中。
例如,在溶液中进行的酸碱滴定反应中,H+离子和OH-离子可以相互结合生成水分子。
二、电化学反应的应用电化学反应在许多领域中都有着广泛的应用。
下面将介绍一些典型的应用,并说明其原理和特点。
1. 电池(电能转换)电池是一种将化学能转换为电能的装置。
它基于氧化还原反应,在其中可以通过外部设备将产生的电子流动起来,实现对其他设备或系统提供稳定的电能。
常见的干电池、蓄电池以及燃料电池等都属于这种类型。
例如,蓄电池中,正极材料与负极材料之间发生氧化还原反应,产生了可供外接设备使用的电流。
2. 金属表面处理通过控制正好性质和溶液条件,可以利用电化学反应对金属表面进行改性和保护。
这种方法被称为金属表面处理技术。
例如,在镀铬工艺中,利用氧化铬沉积在金属基体表面上形成保护膜,提高其耐腐蚀性。
3. 腐蚀和防腐具有氧化还原活力差异的金属和非金属相接触时,会发生一种自发性的氧化还原反应,即腐蚀。
电化学反应可以通过控制腐蚀过程来减缓或防止金属的损失。
例如,在汽车制造中使用的防锈涂料就可以通过形成一个不溶于水的氧化物层来保护金属表面。
4. 电解与电镀电解是利用直流电源驱动非自发性的化学变化。