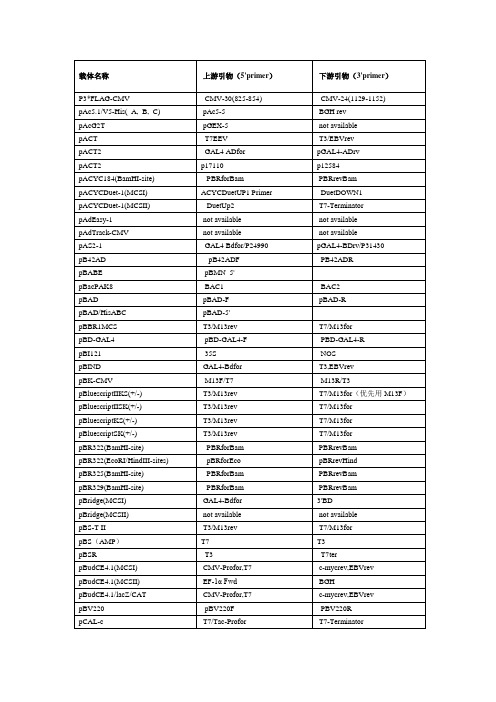
质粒测序引物设计
- 格式:doc
- 大小:12.33 KB
- 文档页数:1

从puc质粒中扩增lacz引物设计primer步骤
扩增 lacZ 引物设计 primers 的步骤
一、准备工作
2、准备相关知识
要熟悉 lacZ 基因引物的相关知识,包括 lacZ 基因的结构、它们的
编码区域以及其他情况。
二、设计 primers
1、检索 lacZ 基因的序列
使用 NCBI 的 BLAST 来检索 lacZ 基因的序列,以得到正确的序列。
2、设计primers
使用软件如 OligoCalc 中的 Primer Design 功能,设计适合 lacZ
基因上下游的引物,以完成正确的 PCR 反应。
一般情况下,一对引物的
长度应该在 18-24 bp 之间,Tm 值应该在 60-64 度之间。
3、校验 primers
使用软件如 Primer 3 中的 Primer Analysis 功能,校验所设计出
的引物对是否满足一定要求。
三、实验测试
1、样品提取
根据实验需求,从pUC质粒中提取相应的样品进行实验。
2、PCR实验
使用上述设计的引物对,进行PCR扩增实验,以确认引物对的有效性。
3、结果分析
从PCR实验中得到的结果,对其进行分析。
如果扩增的片段同预期一致,则表明引物设计正确;如果与预期不一致,则表明引物设计不正确,
需要进行重新设计。
以上就是 lacZ 引物设计 primers 的步骤,通过这些步骤可以为
pUC 质粒中的 lacZ 基因扩增准备相应的 primers 对。

质粒测序引物设计随着基因研究的不断深入,质粒测序成为了分析基因信息的重要工具之一,同时,为了获得更真实、更准确的序列,准确设计序列特异性强的引物是非常重要的。
本文将重点讲述质粒测序所需的引物设计流程及其注意事项,以期为大家提供参考。
1. 引物设计的基本原则引物是一种在PCR反应体系中使DNA聚合酶特异性扩增所需的寡核苷酸。
正确认识引物的作用和特点,对于准确设计合适的引物具有很重要的意义。
引物的主要特点有以下几个方面:(1)序列特异性:引物应特异性地与目标序列结合,确保扩增出的片段为所需的序列,而非与其它非靶DNA结合。
(2)稳定性:使其与模板DNA的双链DNA进行稳定的配对。
(3)温度特异性:引物与模板结合的温度应该略低于生产它们的反应体系的温度。
基于以上特点,我们需要基于引物设计的原则进行质粒测序引物的设计。
具体来说,主要考虑以下几个方面:(1)序列特异性:引物应设计成特异性的,避免产生与目标序列无关的PCR产物。
其特异性应通过序列比对和BLAST进行验证,以确保最终设计出的引物能够对所需的目标序列特异性扩增。
在引物设计时,还应注意要在引物中避开GC/AT区域和重复序列的部位。
(2)长度优化:引物的长度应该合适,过短容易导致扩增不全,过长则容易出现引物间的竞争关系,同时也容易产生温度特异性方面的问题。
一般来说,引物长度应该控制在20个核苷酸左右,但是对于某些特殊的情况,比如复杂基因组、高度变异基因等,可能需要设计更长的引物。
(3)序列特征:引物中不应含有重复结构、长程序列、寡聚物或者常见的RNA序列,这些都可能导致不特异扩增、引物二聚或聚合酶滞留等问题。
2. 引物设计流程在对质粒进行测序之前,需要先设计合适的引物,紧密契合上述引物设计原则,具体流程如下:(1)数据获取:首先需要获取目标DNA序列,并确定所需要进行的PCR扩增区域。
(2)引物设计:根据目标区域,按照上述设计原则进行引物的设计。
一般来说,可以利用一些公共的软件或者在线工具进行引物设计,比如Primer 3、OligoCalc、Primer Premier等。


在科学研究和基因工程领域中,检测质粒polyA尾长度的引物和方法与流程是非常重要的。
质粒polyA尾长度的变化可能会影响基因的表达和功能,因此需要准确可靠地检测和测量。
本文将从深度和广度的角度进行全面评估,探讨质粒polyA尾长度检测的引物和方法,并以此撰写有价值的文章。
1. 引物设计在检测质粒polyA尾长度时,引物的设计是至关重要的。
引物应该与目标序列高度特异性地结合,避免与其他非目标序列结合。
引物的长度和Tm值需合适,确保引物能够特异性地结合目标序列,而不会产生非特异性扩增。
引物的设计还需要考虑其在PCR反应中的效率和稳定性,以确保能够可靠地检测质粒polyA尾长度。
2. PCR方法在检测质粒polyA尾长度时,PCR方法是常用的技术手段。
通过PCR反应扩增目标序列,然后通过电泳或其他方法检测扩增产物的长度,可以间接地测量质粒polyA尾的长度。
在PCR方法中,需要优化反应体系,确定最佳的扩增条件,以保证扩增产物的特异性和准确性。
3. 实时荧光定量PCR除了普通的PCR方法外,实时荧光定量PCR也是一种常用的检测质粒polyA尾长度的方法。
实时荧光定量PCR具有高灵敏度、高特异性和高准确性的优点,能够快速、准确地测量扩增产物的数量和长度,从而实现对质粒polyA尾长度的精准检测。
4. 流程和注意事项在进行质粒polyA尾长度的检测时,需要严格按照操作流程进行实验操作,并且要注意一些关键的实验技巧和注意事项。
在引物设计和PCR方法中,需要注意引物的纯度和浓度,PCR反应条件的优化等。
在实时荧光定量PCR中,需要准确配置实验体系,合理选择荧光探针和引物等。
总结来说,通过引物的合理设计和PCR方法、实时荧光定量PCR等技术手段的使用,可以准确、可靠地检测质粒polyA尾长度。
在实际操作中,需要严格按照操作流程进行实验,并且要注意一些关键的实验技巧和注意事项。
个人观点:质粒polyA尾长度的检测在基因工程和基因表达调控等领域具有重要意义。

质粒的反向 pcr质粒的反向PCR是一种常用的分子生物学技术,可以用于检测和确定质粒中目的基因的序列。
下面将详细介绍反向PCR的原理及步骤。
反向PCR是一种特殊的PCR方法,它与常规PCR的不同之处在于引物的设计。
在常规PCR中,引物是根据目的基因的已知序列设计的,用于扩增目的基因的片段。
而在反向PCR 中,引物则是根据已知的质粒序列设计的,用于扩增质粒中未知区域的片段。
反向PCR的原理基于以下几个假设:1) 质粒的已知序列和未知区域是相邻的;2) 扩增产物在PCR反应中会扩增未知区域的两侧序列。
反向PCR的步骤如下:1. DNA提取与限制性内切酶切割:首先,从含有目标质粒的菌株中提取质粒DNA。
接下来,用限制性内切酶切割质粒DNA,使未知区域与已知序列分开。
2. 偏移引物的设计:根据已知的质粒序列,设计一对偏移引物。
这对引物分别位于未知区域的两侧,并有适当的长度和碱基组成。
3. 反向PCR扩增:将切割后的质粒DNA作为模板,使用偏移引物进行反向PCR扩增。
PCR反应的条件包括合适的温度和时间参数,以确保目标序列的高效扩增。
4. 凝胶电泳和提取扩增产物:将反向PCR扩增后的产物进行凝胶电泳分离,通过电泳结果可以确定未知区域的大小和存在与否。
然后,从凝胶中提取目标产物,以便进一步分析和测序。
5. 序列分析:用测序方法对扩增产物进行测序,以确定未知区域的序列。
通过反向PCR技术,研究人员可以获取目标质粒中未知区域的序列信息。
这对于研究质粒功能以及质粒在基因克隆和表达中的应用具有重要意义。
总结起来,反向PCR是一种重要的质粒分析技术,通过设计合适的引物和PCR反应条件,可以扩增和测序未知区域的序列。
这种技术在基因克隆、质粒分析和分子生物学研究中具有广泛的应用前景。
环状质粒 pcr 构建定点突变序列
定点突变是一种将特定位点上的碱基改变为另一种碱基的技术,在分子生物学研究中有广泛应用。
通过 PCR 构建定点突变序列可以方便快速地获得预期的突变序列。
以下是环状质粒 PCR 构建定点突变序列的步骤:
1. 设计引物:设计两对引物,其中一对含有突变序列,另一对不含突变序列,使其在 PCR 反应中扩增出突变序列的目的片段。
2. 生成模板 DNA:从目标环状质粒中提取 DNA,并按照 PCR 反应条件进行适当稀释和纯化,以获得合适的模板DNA。
3. PCR 扩增:使用上述引物对模板 DNA 进行 PCR 扩增,生成包含突变序列的 PCR 产物。
4. 酶处理:将 PCR 产物用限制酶进行酶切,以将突变序列与目标环状质粒分开。
5. 连接重新组装:使用 T4 连接酶将酶切产物重新连接为完整的环状质粒,并进行适当纯化和检测。
通过上述步骤,可以方便快速地获得定点突变的环状质粒序列,为分子生物学研究提供了有力的工具。
质粒 pcr传代稳定性引物设计流程或方法下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by the editor. I hope that after you download them, they can help you solve practical problems. The document can be customized and modified after downloading, please adjust and use it according to actual needs, thank you!In addition, our shop provides you with various types of practical materials, such as educational essays, diary appreciation, sentence excerpts, ancient poems, classic articles, topic composition, work summary, word parsing, copy excerpts, other materials and so on, want to know different data formats and writing methods, please pay attention!质粒的传代稳定性是在分子生物学研究中一个非常重要的问题,尤其是在进行PCR 传代实验时。
载体构建质粒构建步骤有哪些?载体构建过程:1、引物设计2、⽬的⽚段选取:RNA提取、RNA反转录、PCR扩增、PCR产物纯化3、双酶切4、连接:T4 DNA ligase连接或者同源重组连接(新贝⽣物:#B101、#B102)5、转化6、菌落PCR7、测序:1)摇菌;2)送样; 3)⽐对;8、菌种保存:菌种⽐对成功,则可保存菌种备⽤。
9、质粒提取:菌种⽐对成功,冻存菌种后,菌液⽤于提取质粒。
⼀、载体构建基本原理分、切、连、转、筛1、分:分离出要克隆的⽬的基因及载体。
2、切:⽤限制性内切酶切割⽬的基因和载体,使其产⽣便于连接的末端。
限制性内切酶:是⼀类能识别双链DNA中特定碱基顺序的核酸⽔解酶。
限制性核酸内切酶根据识别切割特性,催化条件及是否具有修饰酶活性分为三⼤类。
其中Ⅱ型酶能识别双链DNA的特异顺序,并在这个顺序内切割,产⽣特异性DNA⽚段,是DNA 重组技术中常⽤的酶。
Ⅰ型酶:具有修饰和切割功能,⽆固定切割位点Ⅲ型酶与Ⅰ型类似,能识别特异位点,但切割位点在识别位点以外Ⅱ型酶特点:①识别顺序⼀般为4-6个碱基对②识别顺序具有180度的旋转对称性,呈完全的回⽂结构③Ⅱ型酶对双链DNA两条链同时切割,可产⽣两种不同末端:平末端,粘末端平末端:在识别顺序的对称轴上,对DNA同时切割形成平末端,如:SmaI5’-CCC GGG-3’ 5’-CCC GGG-3’3’-GGG CCC-5’ 3’-GGG CCC-5’5′突出粘末端:在识别序列的两侧末端切割DNA双链,于对称轴的5 ′末端切割产⽣5 ′端突出的粘性末端,如:Hind Ⅲ5’―AAGCTT―3’ 5’― A 5’-AGCTT―3’3’―TTCGAA―5’ 3’― TTCGA-5’ A―5’3′突出粘末端:与5′突出粘末端作⽤相反,产⽣3 ′端突出粘末端,如:PstI5’―CTGCAG―3’ 5’―CTGCA-3’ G―3’3’―GACGTC―5’ 3’―G 3’-ACGTC―5’3、连:将切割后的⽬的基因和载体⽤T4 DNA连接酶连接或者同源重组⽅法连接。
质粒测序引物设计
质粒测序是一种常用的分子生物学技术,用于分析质粒的基因组成和结构。
在质粒测序过程中,引物是至关重要的组成部分,其质量和设计直接影响到测序数据的准确性和可靠性。
因此,正确设计合适的引物至关重要。
设计引物的首要步骤是选择目标序列。
质粒测序通常需要分析全长或部分序列,因此需要确定目标序列的起止位置。
在选择目标序列时,还需要考虑序列的特点,如长度、GC含量和反向互补性等。
这些因素将影响引物的长度和特异性。
设计引物时,需要遵循一些基本原则。
首先,引物的长度应该在18-25个碱基对之间,以保证特异性和特异性。
其次,引物的GC含量应该在40-60%之间,以确保引物与目标序列的结合。
此外,还需要确保引物的特异性,以避免与其他序列的杂交信号。
引物设计时还需要考虑引物间的距离和方向。
引物之间的距离应该足够远,以避免重叠或杂交。
另外,正向和反向引物之间的距离应该相等,以确保扩增产物的长度均匀。
总之,正确设计引物对质粒测序的结果至关重要。
根据目标序列的特点,采用合适的引物设计策略和软件,可以设计出高质量的引物,从而获得更加准确和可靠的测序数据。
- 1 -。