陌生情景化学方程式的书写
- 格式:doc
- 大小:387.50 KB
- 文档页数:6

陌生情境下化学方程式或离子方程式书写1.某研究小组研究消毒液(主要成分为NaCl和NaClO)的变质情况。
当NaClO吸收空气中的CO2时,会生成NaHCO3和HClO,化学反应方程式为:NaClO + CO2 → NaHCO3 + HClO2.已知FeS中的铁元素生成Fe3+,则FeS、O2、H2SO4反应的化学方程式为:FeS + O2 + 2H2SO4 → Fe2(SO4)3 + H2O3.氯化亚铁溶液经高温喷雾焙烧时转化为氯化氢气体和氧化铁粉末,化学方程式为:2FeCl2 → 2FeCl3 + Cl2↑4FeCl3 → 4FeO + 3Cl2↑4.完成氧化焙烧过程中生成Na2CrO4的化学方程式为:Cr(OH)3 + 2Na2CO3 → Na2CrO4 + CO2↑ + 3H2O5.洗涤剂中的双氧水可以将废水中的氰化物转化为无毒物同时生成NH3,反应的离子方程式为:CN- + 2H2O2 + 2OH- → CNO- + 2H2O + 2H2O6.碱性条件下煅烧铬铁矿(FeO·Cr2O3)生成Na2CrO4和NaFeO2反应的化学方程式为:4FeO·Cr2O3 + 16NaOH → 8Na2CrO4 + 2Na2FeO2 + 8H2O7.废旧锂离子电池的正极材料(主要含有LiCoO2及少量Al、Fe等)可用于回收钴、锂。
LiCoO2在溶解过程中反应的化学方程式为:LiCoO2 + 2H2SO4 → Li2SO4 + CoSO4 + 2H2O + O2↑8.工业上采用NaClO氧化法生产高铁酸钾,反应①的离子方程式为:NaClO + Fe(NO3)3 + NaOH → Na2FeO4↓ + NaCl + NaNO3 + H2O当NaClO加入过量时,会生成Fe(OH)3,反应的离子方程式为:Fe3+ + 3OH- → Fe(OH)3↓若Fe(NO3)3加入过量,在碱性介质中K2FeO4与Fe3+发生氧化还原反应生成K3FeO4,反应的离子方程式为:K2FeO4 + 2Fe3+ + 2OH- → 2K3FeO4 + H2O9.工业上利用硫酸渣(含Fe2+、Fe3+的硫酸盐及少量CaO和MgO)制备高档颜料铁红(Fe2O3)和回收(NH4)2SO4,具体生产流程如下:FeSO4 + CaO + 1/2O2 → Fe2O3 + CaSO4Fe3+ + 3NH3 + 3H2O → Fe(OH)3↓ + 3NH4+1.直接加热AlCl3·6H2O不能得到无水AlCl3.为制取无水AlCl3,可以将AlCl3·6H2O与SOCl2混合加热反应,生成无水AlCl3和HCl和一种具有漂白性的气体。


工艺流程题的解题策略——陌生情境下方程式的书写发布时间:2022-10-21T07:45:20.002Z 来源:《教育学》2022年8月总第293期作者:曹俊尧[导读] 新课程标准下对高考试题选择的要求体现问题设置情境既熟悉又有新意、既真实又简约,但学生的答题并不理想,故本文针对工艺流程题中陌生情境下方程式的书写进行了分析,并建构解题模板。
福建省龙岩第一中学锦山学校364000摘要:新课程标准下对高考试题选择的要求体现问题设置情境既熟悉又有新意、既真实又简约,但学生的答题并不理想,故本文针对工艺流程题中陌生情境下方程式的书写进行了分析,并建构解题模板。
关键词:陌生情境方程式书写解题策略传统的教学模式下,学生只是教学内容的被动接受者,在这种形式下很难培养出有创新的人才。
新课标就是对传统课堂进行改革,全新的课标理念呼唤全新的教学方式,为进一步深化新课程改革,在新的课程标准和高考考纲中都明确要求,精选试题情境,呈现真实问题,加强对关键能力的考查,彰显教育改革的鲜明导向,故真实化学情境下问题解决的教学探究就很有必要了。
新情境下学生如何获得解题信息,如何利用已有陌生资源转换为熟悉的知识点,是目前很多学生比较难得分的关键点。
下面以工艺流程题中陌生情境下方程式的书写课例来阐述解题策略。
一、“析”高考——高考分析1.高考特点。
“陌生情境下反应方程式的书写”高考题中常见的题型,具有陌生度高、综合性强、能力要求高的特点。
2.存在问题。
(1)对于“陌生情境下反应方程式的书写”,学生无法抓住情境中的关键信息,不善于价类思维分析反应物性质、分析与预测反应产物,没能抓住守恒关系进行方程式配平,导致错误率较高。
(2)对于“电极反应式”,学生往往会受复杂电化学装置的干扰,没能把握体系中微粒移动情况等,导致无法判断电极,无法正确书写电极反应式。
二、“冲”高考——复习目标1.结合具体例题,认识情境信息的特点,准确把握关键信息并提取实质内涵。

1.铁酸钠(Na2FeO4)是一种新型净水剂,制取铁酸钠的离子反应方程式为:Fe3++OH-+Cl2-→FeO42-+Cl-+H2O,配平该反应的离子方程式。
2.硫在碱液中加热,零价的硫被歧化为负二价态和正四价态;碘在碱液中能歧化为负一价态和正五价态。
试分别写出硫和碘在碱液中发生歧化反应的离子方程式、。
3.食盐必须加碘,其中碘以碘酸钾或碘化钾的形式存在。
有人烹调时,分别含有碘化钾和碘酸钾的加碘食盐混合,当滴食醋时,产生紫色蒸气,反应的离子方程为。
4.在SnCl2的硫酸溶液中滴入KMnO4至刚好反应完全,完成离子方程式。
5.实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿和过量的固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl;用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4。
试回答:(1)软锰矿制备K2MnO4的化学方程式是;(2)K2MnO4制备KMnO4的离子方程式是;(3)KMnO4能与热的经硫酸酸化的Na2C2O4反应,生成Mn2+和CO2,该反应的化学方程式是。
6.将20mL 0.5mol·L-1 K2SO3溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。
写出反应的离子方程式:________________________________。
7.在氢氧化钠的环境中,Cl2与碘化钠反应,每1mol碘化钠完全反应转移6摩尔电子,反应的离子方程式为8.氮气的实验室制法是用氯化铵(NH4Cl)与亚硝酸钠(NaNO2)反应,同时生成氯化钠和水。
写出该反应的化学方程式。
9.氧化还原反应中实际上包含氧化和还原两个过程。
下面是一个还原过程的反应式:NO3-+4H++3e→NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质能使上述还原过程发生。

陌生氧化还原反应方程式的书写1.“四步法”书写陌生氧化还原反应方程式第一步:根据元素化合价的升降,判断氧化剂、还原剂、氧化产物、还原产物。
第二步:按“氧化剂+还原剂=还原产物+氧化产物”写出方程式,根据得失电子守恒配平上述四种物质。
注意:不属于“氧化剂、还原剂、氧化产物、还原产物”的物质这一步不写在方程式中。
第三步:根据电荷守恒或反应物的酸碱性,在方程式左边或右边补充H +、OH -或H 2O 等。
第四步:根据质量守恒配平反应方程式。
2.常见还原剂的氧化产物(1)还原性单质的氧化产物①Fe 遇弱氧化剂(如H +、S 等)一般氧化为Fe 2+;Fe 遇强氧化剂(如Cl 2、Br 2、过量HNO 3等)一般氧化为Fe 3+。
②单质I 2可以被Cl 2氧化为IO 3-。
(2)还原性物质的氧化产物在溶液中,Cu 2O 、FeO 、SO 2的氧化产物一般分别为Cu 2+、Fe 3+、SO 42-,它们与稀HNO 3(还原产物为NO )反应的离子方程式依次为:3Cu 2O+2NO 3-+14H +=6Cu 2++2NO↑+7H 2O ; 3FeO+NO 3-+10H +=3Fe 3++NO↑+5H 2O ; 3SO 2+2NO 3-+ 2H 2O =3SO 42-+2NO↑+ 4H +。
(3)还原性酸的氧化产物: 在溶液中,H 2S 的氧化产物通常是S 或SO 42-。
(4)NH 3的氧化产物: NH 3的氧化产物一般为无污染的N 2。
①如NH 3被Cl 2、灼热CuO 氧化为N 2,反应的方程式有: 2NH 3+3Cl 2=N 2+6HCl (常温接触就发生反应,NH 3少量); 8NH 3+3Cl 2=N 2+6NH 4Cl (NH 3过量,观察到有白烟产生); 2NH 3+3CuO N 2+3Cu+3H 2O 。
②NH 3在纯氧中燃烧,其氧化产物也为N 2:4NH 3+3O 2(纯)=2N 2+6H 2O 。
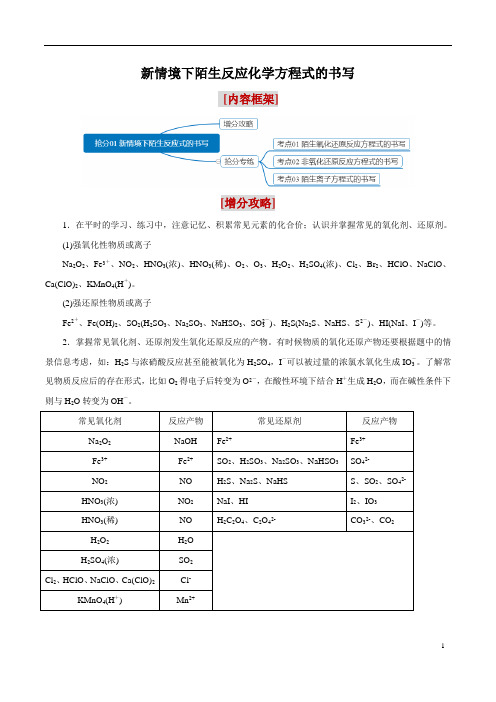
新情境下陌生反应化学方程式的书写[内容框架][增分攻略]1.在平时的学习、练习中,注意记忆、积累常见元素的化合价;认识并掌握常见的氧化剂、还原剂。
(1)强氧化性物质或离子Na2O2、Fe3+、NO2、HNO3(浓)、HNO3(稀)、O2、O3、H2O2、H2SO4(浓)、Cl2、Br2、HClO、NaClO、Ca(ClO)2、KMnO4(H+)。
(2)强还原性物质或离子Fe2+、Fe(OH)2、SO2(H2SO3、Na2SO3、NaHSO3、SO2-3)、H2S(Na2S、NaHS、S2-)、HI(NaI、I-)等。
2.掌握常见氧化剂、还原剂发生氧化还原反应的产物。
有时候物质的氧化还原产物还要根据题中的情景信息考虑,如:H2S与浓硝酸反应甚至能被氧化为H2SO4,I-可以被过量的浓氯水氧化生成IO-3。
了解常见物质反应后的存在形式,比如O2得电子后转变为O2-,在酸性环境下结合H+生成H2O,而在碱性条件下则与H2O转变为OH-。
常见氧化剂反应产物常见还原剂反应产物Na2O2NaOH Fe2+Fe3+Fe3+Fe2+SO2、H2SO3、Na2SO3、NaHSO3SO42-NO2NO H2S、Na2S、NaHS S、SO2、SO42-HNO3(浓) NO2NaI、HI I2、IO3HNO3(稀) NO H2C2O4、C2O42-CO32-、CO2H2O2H2OH2SO4(浓) SO2Cl2、HClO、NaClO、Ca(ClO)2Cl-KMnO4(H+) Mn2+3.书写信息型氧化还原反应方程式的步骤(1)找出发生氧化还原反应的物质或离子。
(2)依据掌握的氧化还原反应规律合理地预测产物(这里要重视题目中的信息提示,或给出的生成物)。
(3)根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应计量数。
(4)根据原子守恒和溶液的酸碱性,通过在反应方程式的两端添加H+、OH-或H2O的形式使方程式的两端的电荷守恒。
陌生情境中氧化还原反应方程式的书写1.给定化学方程式的书写典例1.做实验时不小心沾在皮肤上的高锰酸钾会形成黑斑,很久才能消除,若用乙二酸的稀溶液擦洗黑斑,黑斑可以迅速褪去,其反应的离子方程式为:MnO -4+H 2C 2O 4+H +―→CO 2↑+Mn 2++ ;下列有关此反应的叙述正确的是( )A .乙二酸中C 显+2价B .反应的离子方程式右侧方框内的产物是OH -C .氧化剂和还原剂的化学计量数之比是5∶2D .若有6mol H +参加反应,则转移电子10mol 2.信息型化学方程式的书写典例2.硫化氢具有还原性,可以和许多氧化剂反应。
在酸性条件下,H 2S 和KMnO 4反应生成S 、MnSO 4、K 2SO 4和H 2O ,写出该反应的化学方程式:____________________________ _________________。
1.有Fe 3+、Fe 2+、NO -3、NH +4、H +和H 2O 六种微粒,分别属于一个氧化还原反应中的反应物和生成物,下列叙述中,不正确的是( )A .还原产物为NH +4B .氧化剂与还原剂的物质的量之比为1∶8C .若有0.5mol NO -3参加还原反应,则转移电子8molD .若把该反应设计为电解池,则阳极反应为Fe 2+-e -===Fe 3+2.工业上,通过如下转化可制得KClO 3晶体:NaCl 溶液――——————→80℃,通电ⅠNaClO 3溶液――————→室温,KClⅡKClO 3晶体①完成Ⅰ中反应的总化学方程式:NaCl+ H 2O= NaClO 3+__________。
②Ⅱ中转化的基本反应类型是________,该反应过程能析出KClO 3晶体而无其他晶体析出的原因是__________________________________________________________________。
二.对点增分集训一.陌生情境中氧化还原反应方程式的书写3.取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:①滴加适量H2O2,紫红色褪去,并有气泡产生;②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;③最后通入足量的SO2气体。
陌生情景中化学方程式的书写1、铜屑放入稀硫酸中不发生反应,若在稀硫酸中加入H2O2中加入,铜屑可以逐渐溶解,该反应的离子方程式:。
2、①将20mL 0.5mol·L-1 K2SO3溶液逐滴加入到20 mL 0.2mol·L-1 KMnO4溶液(硫酸酸化)中,溶液恰好褪为无色。
写出反应的离子方程式:。
②将SO2通入酸性KMnO4溶液,溶液逐渐褪色,则该反应的离子方程式是:。
3、①在氢氧化钠的环境中,氯气与碘化钠反应,每1mol碘化钠完全反应转移6mol电子,反应化学方程式为:。
②某洗气瓶中装有5.0 mL 1.0×10-3 mol/L的碘水,当通入足量Cl2完全反应后,转移了5.0×10-5mol电子,该反应的化学方程式为。
4、氮气的实验室制法是用氯化铵(NH4Cl)与亚硝酸钠(NaNO2)反应,同时生成氯化钠和水。
写出该反应的化学方程式:。
5、S2Cl2与水反应,有无色刺激性气味气体产生,并有黄色沉淀生成,该反应的化学方程式是:。
6、石灰乳中通入Cl2,得到Ca(ClO3)2与CaCl2物质的量之比为1∶5的溶液,反应的化学方程式是。
7、CaCl2溶液中通入NH3和CO2两种气体后,生成超细CaCO3的化学方程式是。
8、已知Na2S2O3溶液与Cl2反应时,1mol Na2S2O3转移8 mol电子。
该反应的离子方程式是:。
9、SO2气体通入足量Ba(NO3)2硝酸的混合溶液中,生成白色沉淀和无色气体,反应的离子方程式是:。
10、硫粉、炭粉与硝酸钾混合,可以得到黑火药。
黑火药爆炸的产物与其组成有关。
一般黑火药组成为一硫二硝三碳,爆炸产物为K2S、N2、CO2。
写出黑火药爆炸反应的化学方程式:11、①高铁酸钾(K2FeO4)为高效绿色净水剂,可通过Fe(OH)3与KOH和Cl2反应制得。
该反应的化学方程式是。
②Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸盐和KNO2等产物,该反应的化学方程式是。
高考陌生情景中化学方程式的书写技巧与真题训练陌生情景中的化学方程式书写,首先要根据材料中的信息写出反应物和生成物的化学式,然后再配平即可。
配平要遵循质量守恒定律(原子守恒、元素守恒、物料守恒),对于氧化还原反应还要遵循得失电子数相等即得失电子守恒规律,对于离子反应还要遵循电荷守恒规律。
【解题技巧】关键结合题目信息、流程图信息并熟记常见的氧化产物和还原产物判断生成物。
1. 熟记常见的氧化剂及对应的还原产物、还原剂及对应的氧化产物2.掌握书写信息型氧化还原反应的步骤(3步法)第1步:根据氧化还原顺序规律确定氧化性最强的为氧化剂,还原性最强的为还原剂;根据化合价规律及题给信息和已知元素化合物性质确定相应的还原产物、氧化产物;根据氧化还原反应的守恒规律确定氧化剂、还原剂、还原产物、氧化产物的相应化学计量数。
第2步:根据溶液的酸碱性,通过在反应方程式的两端添加H+或OH-的形式使方程式的两端的电荷守恒。
第3步:根据原子守恒,通过在反应方程式两端添加H2O(或其他小分子)使方程式两端的原子守恒。
3.氧化还原反应方程式的配平:步骤:①标出化合价变化了的元素的化合价。
②列变化:分别标出化合价升高数和化合价降低数③根据化合价升降总数相等确定发生氧化还原反应的物质的化学计量数。
④利用元素守恒,观察配平其他物质4.“补缺”的技巧(1)可能出现的情况:H+→H2O(酸性)、OH-→H2O(碱性)、H2O→H+(中性或酸性)、H2O→OH-(中性或碱性)(2)绝不可能出现的情况:H+→OH- 或者OH-→H+题型1 氧化还原反应型的化学方程式和离子方程式的书写1、氧化锌为白色粉末,可用于湿疹、癣等皮肤病的治疗。
纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钾的还原产物是MnO2。
反应②中除掉的杂质离子是__________,发生反应的离子方程式为_________________。
面对陌生的化学反应,怎样书写化学方程式呢?下面我来回答一下,面对陌生的化学反应,怎样书写化学方程式?你的问题是当今中招或者高考是最热门的一个题型。
我作为一个从教化学20多年的老师为你解答,希望能够对你有所帮助。
首先面对一个陌生的化学反应,应该从题中去了解知道化学反应的反应物是什么?生成物是什么?反应条件是什么?一定要会写反应物和生成物的化学式。
这是一个最基本的要求。
第二会写生成物和反应的化学式,把反应物写在左边,生成物写在右边。
中间用短线连接。
第三根据质量守恒定律,对方程式进行配平。
这一点是最难的。
配平方程式的方法很多,有最小公倍数法,有奇数配偶发,电子转移法,化合价升降法,还有待定系数法。
关于方程式的配平,你要重点去查找方程式配平的方法和解题思路,在这里我就不一一多说了,因为方程式的配平不是一句话两句话说出来所能完成的,所以我建议你平时要多做质量守恒定律的配平。
如果所有的方法都试过,还配不平,我建议你用最后一种方法:待定系数法,这也是一个最保守的方法,所谓待定系数法就是把化学式的系数全部用未知的字母设出来,根据质量守恒定律,列出方程组,把方程的系数写出来。
第四方程式配平之后,我们要从题干中找到该反应的条件是加热还是点燃,是否有催化剂,一定要把反应条件写到短线的上方。
第五方程式配平之后,往往一部分学生往往会忽略一个问题,那就是没有把短线改为等号,有气体生成的,没有写气体上升的符号,如果有沉淀生成的,没有写沉淀的符号。
最后一定要认真的把每一种元素的原子个数检验一下,看是否守恒,如果所有的元素质量都守恒了那么这个方程式就配平了。
总之要想写出一个陌生的化学反应方程式,在平时我们需要多练习,多训练,多做方程式配平的习题,熟能生巧,做多了,到时自然而然的就会写出方程式了。
如果你觉得我的方法有实用价值,我不希望你为我点赞,评论说点什么,只想希望你把此方法转发给所需要的人,为那些不会书写陌生的化学方程式而发愁的人。
高三化学专题复习——陌生情景无机方程式书写
类型一:氧化还原型方程式
▲题型一、信息型(给出部分反应物和生成物)
【例1】某酸性废水中含有Cr2O72-,处理时可用焦亚硫酸钠(Na2S2O5)将Cr2O72-转化为毒性较低的Cr3+后再除去,写出反应的离子方程式为_______ 。
【例2】实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:软锰矿与过量固体KOH和KClO3在高温下反应,生成锰酸钾(K2MnO4)和KCl:用水溶解,滤去残渣,滤液酸化后,K2MnO4转变为MnO2和KMnO4;滤去MnO2沉淀,浓缩溶液,结晶得到深紫色的针状KMnO4晶体。
请回答:软锰矿制备K2MnO4的化学方程式是______【方法指导】
【针对训练】
1、FeCl3可用于金属蚀刻、污水处理等。
工业生产中FeCl3可由NaClO3氧化酸性FeCl2废液(含有的溶质为FeCl
2、FeCl
3、HCl)制备。
①写出Na ClO3氧化酸性FeCl2废液的离子方程式:。
2、草酸钴是制作氧化钴和金属钴的原料。
一种利用含钴废料(主要成分为Co2O3,含少量Fe2O
3、Al2O3、CaO、MgO、碳及有机物等)制取CoC2O4的工艺流程如下::
(3)“钴浸出”过程中Co3+转化为Co2+,反应的离子方程式为
____________________________;
3、将Cu2Al2O4溶解在稀硝酸中的离子方式。
▲题型二、工艺流程型(寻找反应物和生成物)
【例3】【2017新课标1卷】Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁
浸出
锌渣
废酸 过滤 渣
一次净化
过滤 A
二次净化
过滤 B
蒸发
1、加入KClO 3、FeCl 3
2、加入ZnO 锌粉 产品
盐酸
矿(主要成分为FeTiO 3,还含有少量MgO 、SiO 2等杂质)来制备,工艺流程如下: (6)写出“高温煅烧②”中由FePO 4制备LiFePO 4的化学方程式 。
【例4】【2016全国I 卷】NaClO 2是一种重要的杀菌消毒剂,也常用来漂白织物等,其一种生产工艺如下:
(2)写出“反应”步骤中生成ClO 2的化学方程式 。
(4)“尾气吸收”是吸收“电解”过程排出的少量ClO 2。
写出反应方程式: 。
【方法指导】 【针对训练】
4、(2016广一模)以某冶炼厂排放的废酸(主要成分为盐酸,含Fe 2+、Pb 2+、Cu 2+、H 3AsO 3等杂质)和锌渣(含ZnO 、Zn 及其他酸不溶物)为原料制备电池级ZnCl 2溶液的工艺流程如下:
回答下列问题:
(3)“一次净化”的目的是除Fe、As,加入KClO3、FeCl3发生反应的化学方程式为
①②③FeCl3+H3AsO4电炉4↓+3HCl
5、新型锂电池正极材料锰酸锂(LiMn2O4)有望取代广泛使用的LiCoO2。
工业上用某软锰矿(主要成分为MnO2,同时含有少量铁、铝及硅等的氧化物)为原料制备锰酸锂的流程如下:
(5)写出高温煅烧生成锰酸锂的化学方程式
▲题型三、电化学电极反应式书写
【例5】用如图所示装置处理含CN-废水时,控制溶液pH为9~10并
加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物
质而除去。
铁电极为__________(填“阴极” 或“阳极”),阳极产生ClO-
的电极反应为__________________________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________________________。
【方法指导】
【针对训练】
6、(2014全国)PbO2可由PbO与次氯酸钠溶液反应制得,反应的离子方程式为;PbO2也可以通过石墨为电极,Pb(NO3)2与Cu(NO3)2的混合溶液为电解液电解制取,阳极发生的电极反应式为。
7、(2015全国)酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是有碳粉,二氧化锰,氯化锌和氯化铵等组成的填充物,该电池在放电过程产生MnOOH,回收处理该废电池可以得到多种化工原料。
(1)该电池的正极反应式为:。
【方法指导一】
类型二:非氧化还原型方程式
▲题型一、复分解型
碳酸钠 铬铁矿
焙
烧
浸
出
O 2
CO 2
中
和
酸
化
废液处理
H 2O
醋酸
醋酸 KCl
pH <5
pH =7~8
固体a
固体b
K 2Cr 2O 7晶体
操作 I 操作 II 操作 III
(完全沉淀离子的pH 值:SiO 32-为8,WO 42-
为5)
(1)CaWO 4与纯碱发生的化学反应方程式是_______________________________。
▲ 题型二 、溶解度随温度变化差异型
【例7】铬铁矿的主要成分可表示为FeO·Cr 2O 3,还含有MgO 、Al 2O 3、Fe 2O 3等杂质,下图所示是以铬铁矿为原料制备重铬酸钾(K 2Cr 2O 7)的工艺流程。
已知1:物质的溶解度(g/100g 水) 已知2:
①焙烧时有Na 2CrO 4、 Fe 2O 3 、NaAlO 2 等生成。
②Cr 2O 72-
+ H 2O
2CrO 42- + 2H +
;
Cr 2O 72-具有很强的氧化性
操作
III
发生反应的化学方程式
是。
物质 0℃ 40℃ 80℃
KCl 28.0 40.1 51.3
NaCl 35.7 36.4 38.0
K 2Cr 2O 7 4.7
26.3
73.0
Na 2Cr 2O 7
163.0 215.0 376.0
调节pH 过滤
CO 2
H 2 高温 煅烧 盐酸
钨酸 WO 3 纯W
母液 纯碱 800o C 白钨矿
水洗 过滤
滤液 滤渣A
混合物
滤渣B
▲题型三、水解型、其他型
【例8】(2014广东高考)石墨在材料领域有重要应用,某初级石墨中含SiO2(7.8%)、Al2O3
(5.1%)、Fe2O3(3.1%)和MgO(0.5%)等杂质,设计的提纯与综合利用工艺如下:
(注:SiCl4的沸点为57.6℃,金属氯化物的沸点均高于150℃)
(2)高温反应后,石墨中氧化物杂质均转变为相应的氯化物,由气体II中某物质得到水玻璃的化学反应方程式为。
(4)由溶液IV生成沉淀V的总反应的离子方程式为___________________ 。
【方法指导二】
【针对训练】
8、氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。
CuCl难溶于醇和水,在潮湿空
]-。
工业上用低品
气中易水解氧化,且在氯离子浓度较大的体系中存在CuCl+Cl-CuCl
铜矿(主要含CuS、Cu2S、FeO等)制备CuCl的一种工艺流程如下:
(2)滤渣II的成分主要为MnCO3,写出除Mn2+的离于方程式。
9、钛酸钡是一种强介电化合物材料,具有高介电常数和低介电损耗,是电子陶瓷中使用最广泛的材料之一,被誉为“电子陶瓷工业的支柱”,工业制取方法如下,先获得不溶性草酸氧
钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧后可获得钛酸钡粉体。
(3)加入H2C2O4溶液时,发生反应的化学方程式为;【自我检测】
1、80℃时LiCoO2用硫酸酸浸时钴元素被双氧水还原为+2价,写出化学方程式
2、(2018广一模)高氯酸铵(NH
4ClO
4
)可用作火箭推进剂等。
制备NH
4
ClO
4
的工艺流
程如下:
(1)电解NaClO
3溶液时,ClO
3
-在极发生反应,其电极反应式为。
3、【2016全国III卷】以硅藻土为载体的五氧化二钒(V2O5)是接触法生成硫酸的催化剂。
从废钒催化剂中回收V2O5既避免污染环境又有利于资源综合利用。
以下是一种废钒催化剂回收工艺路
线:
(6)“沉钒”得到偏钒酸铵(NH4VO3)沉淀,写出“煅烧”中发生反应的化学方程式__________ _。
4、CoSO4与NH4HCO3发生“沉钴”过程中发生反应的化学方程式。