江西省师大附中高三理综(化学部分)上学期期末考试试题
- 格式:doc
- 大小:660.50 KB
- 文档页数:5

江西师大附中2019届高三年级上学期末理科综合试卷命题人:物理: 化学: 生物:审题人:物理: 化学: 生物:可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 Si:28S:32 Cl:35.5 Mo:96 Ba:137一、选择题:本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列与骨架相关概念说法错误的是( )A.通过脱氧核糖和磷酸交替连接构成DNA分子基本骨架B.生物大分子都以碳链为骨架C.真核细胞的细胞骨架与细胞分裂有关,和细胞分化、能量的转换等无关D.生物膜的基本支架不是静止的,具有流动性2.在夏季晴朗白天,南昌某蔬菜基地测定了某大棚蔬菜在不同条件下的净光合作用强度,结果见下图(假设塑料大棚外环境条件相同;植株大小一致、生长正常,栽培管理条件相同)。
下列相关叙述错误的是()A.在曲线a中,11时和13时分别摘取植株上部成熟叶片用碘蒸气处理,13时所取叶片显色较深B.光照强度、环境温度、空气中CO2含量是曲线b的峰值低于曲线a的主要因素C.曲线c高于曲线b,原因是补充光照能使叶绿体产生更多的ATP、NADPH用于C3还原D.6—9时和16—18时,曲线b高于曲线a,主要原因是此时段棚内温度较高3.下列实验中关于酒精和盐酸的使用表述正确的是( )A.在“脂肪的鉴定”和“观察DNA和RNA在细胞中的分布”实验中,制片后都要滴加50%的酒精冲洗B.“观察DNA和RNA在细胞中的分布”实验中,使用质量分数8%的盐酸进行水解C.酒精在“低温诱导染色体数目加倍实验”和“观察DNA、RNA在细胞中的分布实验”中的作用相同D.在探究“影响酶活性的条件”和“生物体维持pH稳定的机制”中,使用盐酸作用不都是提供酸性环境4.图示表示HIV感染人体后的变化情况,请在下列与艾滋病有关的描述中选出错误的选项()A.由曲线整体来看,T细胞的多少与HIV浓度之间成反比例关系B.当T细胞的浓度降至极低的水平时,人体免疫防线中的第三道防线几乎丧失C.艾滋病人通常会罹患多器官的恶性肿瘤最终导致死亡,这一结果体现了免疫系统具有的监控和清除功能D.不可以通过抗原抗体杂交技术检测是否感染HIV5.下列关于达尔文提出的自然选择学说的叙述正确的是()A.认为进化的基本单位的种群B.它揭示了生命现象的统一性和生物的多样性、适应性的原因C.达尔文否定了拉马克的关于器官用进废退和获得性遗传的观点D.强调物种的形成是渐变的结果,同时能解释物种大爆发现象6.某植物高茎(A)对矮茎(a)为显性,花的颜色红色(B)对黄色(b)为显性。

江西师大附中2019届高三年级上学期末理科综合试卷命题人:物理: 化学: 生物:审题人:物理: 化学: 生物:可能用到的相对原子质量:H:1 C:12 N:14 O:16 Na:23 Al:27 Si:28S:32 Cl:35.5 Mo:96 Ba:137一、选择题:本题共13小题,每小题6分,共78分。
在每小题给出的四个选项中,只有一项是符合题目要求的。
1.下列与骨架相关概念说法错误的是( )A.通过脱氧核糖和磷酸交替连接构成DNA分子基本骨架B.生物大分子都以碳链为骨架C.真核细胞的细胞骨架与细胞分裂有关,和细胞分化、能量的转换等无关D.生物膜的基本支架不是静止的,具有流动性2.在夏季晴朗白天,南昌某蔬菜基地测定了某大棚蔬菜在不同条件下的净光合作用强度,结果见下图(假设塑料大棚外环境条件相同;植株大小一致、生长正常,栽培管理条件相同)。
下列相关叙述错误的是()A.在曲线a中,11时和13时分别摘取植株上部成熟叶片用碘蒸气处理,13时所取叶片显色较深B.光照强度、环境温度、空气中CO2含量是曲线b的峰值低于曲线a的主要因素C.曲线c高于曲线b,原因是补充光照能使叶绿体产生更多的ATP、NADPH用于C3还原D.6—9时和16—18时,曲线b高于曲线a,主要原因是此时段棚内温度较高3.下列实验中关于酒精和盐酸的使用表述正确的是( )A.在“脂肪的鉴定”和“观察DNA和RNA在细胞中的分布”实验中,制片后都要滴加50%的酒精冲洗B.“观察DNA和RNA在细胞中的分布”实验中,使用质量分数8%的盐酸进行水解C.酒精在“低温诱导染色体数目加倍实验”和“观察DNA、RNA在细胞中的分布实验”中的作用相同D.在探究“影响酶活性的条件”和“生物体维持pH稳定的机制”中,使用盐酸作用不都是提供酸性环境4.图示表示HIV感染人体后的变化情况,请在下列与艾滋病有关的描述中选出错误的选项()A.由曲线整体来看,T细胞的多少与HIV浓度之间成反比例关系B.当T细胞的浓度降至极低的水平时,人体免疫防线中的第三道防线几乎丧失C.艾滋病人通常会罹患多器官的恶性肿瘤最终导致死亡,这一结果体现了免疫系统具有的监控和清除功能D.不可以通过抗原抗体杂交技术检测是否感染HIV5.下列关于达尔文提出的自然选择学说的叙述正确的是()A.认为进化的基本单位的种群B.它揭示了生命现象的统一性和生物的多样性、适应性的原因C.达尔文否定了拉马克的关于器官用进废退和获得性遗传的观点D.强调物种的形成是渐变的结果,同时能解释物种大爆发现象6.某植物高茎(A)对矮茎(a)为显性,花的颜色红色(B)对黄色(b)为显性。

江西师大附属中学2025届高三化学第一学期期末调研试题注意事项1.考试结束后,请将本试卷和答题卡一并交回.2.答题前,请务必将自己的姓名、准考证号用0.5毫米黑色墨水的签字笔填写在试卷及答题卡的规定位置.3.请认真核对监考员在答题卡上所粘贴的条形码上的姓名、准考证号与本人是否相符.4.作答选择题,必须用2B铅笔将答题卡上对应选项的方框涂满、涂黑;如需改动,请用橡皮擦干净后,再选涂其他答案.作答非选择题,必须用05毫米黑色墨水的签字笔在答题卡上的指定位置作答,在其他位置作答一律无效.5.如需作图,须用2B铅笔绘、写清楚,线条、符号等须加黑、加粗.一、选择题(共包括22个小题。
每小题均只有一个符合题意的选项)1、下列电子排布式表示的基态原子中,第一电离能最小的是A.ns2np3B.ns2np5C.ns2np4D.ns2np62、工业上用酸性KMnO4溶液与乙苯()反应生产苯甲酸(),下列有关说法正确的是A.乙苯是苯的同系物B.乙苯的所有原子均共平面C.生产苯甲酸时发生的是取代反应D.乙苯不能与H2发生反应3、化学与生产、生活息息相关。
下列说法正确的是()A.可用钢瓶储存液氯或浓硫酸B.二氧化碳气体可用作镁燃烧的灭火剂C.鸡蛋清溶液中加入CuSO4溶液,有沉淀析出,该性质可用于蛋白质的分离与提纯D.炒菜时加碘食盐要在菜准备出锅时添加,是为了防止食盐中的碘受热升华4、过氧化钙(CaO2)微溶于水,溶于酸,可作分析试剂、医用防腐剂、消毒剂。
实验室常用CaCO3为原料制备过氧化钙,流程如下:CaCO3滤液白色结晶(CaO2)。
下列说法不正确的是( )A.逐滴加入稀盐酸后,将溶液煮沸的作用是除去溶液中多余的HClB.加入氨水和双氧水后的反应为:CaCl2+2NH3·H2O+H2O2===CaO2↓+2NH4Cl+2H2OC.生成CaO2的反应需要在冰浴下进行的原因是温度过高时过氧化氢分解D.过滤得到的白色结晶用蒸馏水洗涤后应再用乙醇洗涤以去除结晶表面水分5、设N A为阿伏加德罗常数的值。

江西师大附中 高三年级期末考试理综化学试题第I 卷(126分)一、选择题:此题共13小题,每题6分。
在每题给出的四个选项中,只有一项符合题目要求。
7.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极为重要的作用。
以下实验中所选用的仪器合理的是( ) ①用50 mL 量筒量取 mL 稀硫酸②用分液漏斗分离苯和四氯化碳的混合物 ③用托盘天平称量11.7g 氯化钠晶体 ④用碱式滴定管取 mL 溴水 ⑤用瓷坩埚灼烧各类钠化合物⑥用250 mL 容量瓶配制250 mL mol/L 的NaOH 溶液A .①②④ B.②③④⑥ C.③⑥ D.③⑤⑥ 8.以下表达正确的选项是( )A .Na 在足量O 2中燃烧,消耗l mol O 2时转移的电子数是4××1023B .盐酸和醋酸的混合溶液pH=1,该溶液中c (H +) = mol/L C .1 L mol/L NH 4Cl 溶液中的NH +4数是××1023D .标准状况下2.24 L Cl 2中含有 mol 共价键 9. mol·L-1的稀盐酸与 mol·L-1醋酸钠溶液等体积完全反映后,测得反映后的溶液中c(CH 3COO -)>c(Cl -),那么以下判定中错误的选项是( ) A .温度为298 K 时,pH<7B .c(CH 3COOH)+c(CH 3COO -)= mol·L -1C .c(CH 3COOH) < c(CH 3COO -) D .c(CH 3COO -)+c(OH -)=c(Na +)+c(H +)10.铁和氧化铁的混合物共a mol ,加盐酸后固体全数溶解,共搜集到b mol 氢气,且向反映后的溶液中加入KSCN 溶液不显红色,那么原混合物中单质铁的物质的量为 A .)(21b a +mol B .)(b a -mol C .)(21b a -mol D . )(b a +mol11. .利用如下图原电池可测量空气中Cl 2含量,其中电解质是Ag +能够自由移动的固体物质。

江西省上饶市师范附属中学2021-2022学年高三化学上学期期末试卷含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. 化学与科学、技术、社会、环境密切相关。
下列有关说法中不正确的是A.服用铬含量超标的药用胶囊会对人体健康造成危害B.煤经过气化和液化等物理变化,可变为清洁能C.竹炭具有超强的吸附能力,能吸附新装修房屋内的有害气体D.采用催化转换技术将汽车尾气中的NOx和CO转化为无毒气体参考答案:B解析:铬的重金属,对人体有害,A正确;煤的气化是煤与水蒸气反应,是化学变化,液化是得到甲醇等液态物质,是化学变化,B错误;竹炭表面疏松多孔,具有超强的吸附能力,能吸附新装修房屋内的有害气体,C正确;D正确。
2. 向10mL 0.1mol·L-1 NH4Al(SO4)2溶液中,滴加等浓度Ba(OH)2溶液x mL,下列叙述正确的是()A.x=10时,溶液中有NH4+、Al3+、SO42—,且c(NH4+)>c(Al3+)B.x=10时,溶液中有NH4+、AlO2—、SO42—,且c(NH4+)>c(SO42—)C.x=30时,溶液中有Ba2+、AlO2—、OH—,且c(OH—)<c(AlO2—)D.x=30时,溶液中有Ba2+、Al3+、OH—,且c(OH—)=c(Ba2+)参考答案:A略3. 下列化学实验事实及解释都正确的是A.向Na2SO3溶液中加入硝酸酸化的BaCl2溶液,有白色沉淀出现,说明Na2SO3溶液已经变质B.向皂化反应后的混合物中加入食盐可分离出高级脂肪酸钠,说明高级脂肪酸钠在此时容易析出C.等体积、pH都为3的酸HA和HB分别与足量的锌反应,HA放出的氢气多,说明酸性:HA>HBD.向浓度均为0.1 mol/L的MgCl2、CuCl2混合溶液中逐滴加入少量氨水,先生成Cu(OH)2沉淀,说明K SP[Cu(OH)2]>K SP[Mg(OH)2]参考答案:B略4. 化学与科学、技术、社会、环境密切相关。
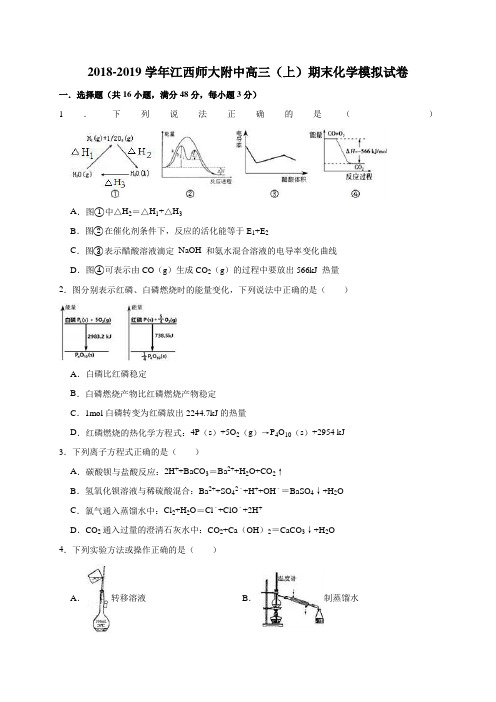
2018-2019学年江西师大附中高三(上)期末化学模拟试卷一.选择题(共16小题,满分48分,每小题3分)1.下列说法正确的是()A.图①中△H2=△H1+△H3B.图②在催化剂条件下,反应的活化能等于E1+E2C.图③表示醋酸溶液滴定NaOH 和氨水混合溶液的电导率变化曲线D.图④可表示由CO(g)生成CO2(g)的过程中要放出566kJ 热量2.图分别表示红磷、白磷燃烧时的能量变化,下列说法中正确的是()A.白磷比红磷稳定B.白磷燃烧产物比红磷燃烧产物稳定C.1mol白磷转变为红磷放出2244.7kJ的热量D.红磷燃烧的热化学方程式:4P(s)+5O2(g)→P4O10(s)+2954 kJ3.下列离子方程式正确的是()A.碳酸钡与盐酸反应:2H++BaCO3=Ba2++H2O+CO2↑B.氢氧化钡溶液与稀硫酸混合:Ba2++SO42﹣+H++OH﹣=BaSO4↓+H2OC.氯气通入蒸馏水中:Cl2+H2O=Cl﹣+ClO﹣+2H+D.CO2通入过量的澄清石灰水中:CO2+Ca(OH)2=CaCO3↓+H2O4.下列实验方法或操作正确的是()A.转移溶液B.制蒸馏水C.分离水和酒精D.稀释浓硫酸5.已知氢化锂(LiH)属于离子化合物,LiH跟水反应可以放出氢气.下列叙述中正确的是()A.LiH跟水反应后的溶液显中性B.LiH在化学反应中是一种强氧化剂C.LiH中氢离子可以被还原成氢气D.LiH中氢离子半径比锂离子半径大6.下列各表述与示意图一致的是()A.图①表示10 mL 0.01 mol•L﹣1 KMnO4酸性溶液与过量的0.1 mol•L﹣1 H2C2O4溶液混合时,n(Mn2+)随时间的变化B.图②中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化C.图③表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化D.图④表示0.1000mol•L﹣1NaOH溶液滴定20.00mL0.1000mol•L﹣1CH3COOH溶液所得到的滴定曲线7.中国在2009年推出了国产燃料电池概念汽车,该车装有“绿色心脏”﹣﹣质子交换膜燃料电池.如图是某科技杂志登载的该电池原理示意图.下列叙述正确的是()A.工作时“X极”周围溶液的酸性增强B.氢气在电极上发生还原反应C.图中标出的“Y极”实际是原电池的负极D.工作过程中,质子(H+)从“Y极”一边透过质子交换膜移动到“X极”一边与OH﹣反应生成水8.用铂作电极电解一定浓度的下列物质的水溶液,电解结束后,向剩余电解液中加适量水,能使溶液和电解前相同的是()A.CuSO4B.H2SO4C.CuCl2D.NaCl9.工业废气H2S经资源利用后可回收能量并得到单质硫.反应原理如图所示.下列说法不正确的是()A.电极a为电池的负极B.电极b上发生的电极反应为O2+4H++4e﹣═2H2OC.若电路中通过2mol电子,则电池内部释放632kJ热量D.若有17gH2S参与反应,则会有1molH+经质子膜进入正极区10.用石墨作电极,电解1mol•L﹣1下列物质的溶液,则电解前后溶液的pH保持不变的是()A.H2SO4B.NaOH C.Na2SO4D.NaCl11.某小组为研究电化学原理,设计如图装置.下列叙述不正确的是()A.a和b不连接时,铁片上会有金属铜析出B.a和b用导线连接时,铁片上发生的反应为:Fe﹣2e﹣=Fe2+C.a和b用导线连接时电子从Cu片流向铁片D.a和b用导线连接时,Cu2+向铜电极移动12.如图所示,烧杯内盛有浓HNO3,在烧杯中放入用铜线相连的铁、铅两个电极,已知原电池停止工作时,Fe、Pb都有剩余。
2018-2019学年度上学期期末考试卷高三化学相对原子质量:H-1 C-12 B-10.8 N-14 O-16 S-32 Na-23 K-39 Fe-56 Cu-64第Ⅰ卷选择题一、(共48分,每小题只有1个选项符合题意)1.下列表述错误的是()A. CS2的结构式为:S=C=SB. 6CO2+6H2O C6H12O6+6O2,该变化中光能直接转变为化学能C. CO2(g)+C(s)2CO(g)△H>0,△S>0,该反应常温下能自发进行D. NH3水溶液呈碱性的原因是NH3+H2O NH3·H2O NH4++OH-【答案】C【解析】【详解】A、CS2的结构与CO2相似,为直线型结构,含有两条C=S键,结构式为S=C=S,所以A正确;B、绿色植物的光合作用将光能转化为化学能,所以B正确;C、△H-T△S<0时可自发进行,因CO2(g)+C(s)2CO(g)△H>0,△S>0此在高温时可自发进行,故C错误;D、氨气溶于水形成氨水,一水合氨存在电离平衡, NH3+H2O NH3·H2O NH4++OH-,因此溶液呈碱性,所以D正确;答案:C。
2.已知:①H2O(g)===H2O(l) ΔH=-Q1kJ·mol-1 ②C2H5OH(g)===C2H5OH(l) ΔH=-Q2kJ·mol -1③CH5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3kJ·mol-1 ;下列判断正确是()2A. 酒精的燃烧热ΔH=-Q3kJ·mol-1B. 由③可知1 mol C2H5OH(g)的能量高于2 mol CO2(g)和3 mol H2O(g)的总能量C. H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应D. 23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放热量为(0.5Q3-0.5Q2+1.5Q1)kJ【答案】D【解析】试题分析:A、C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应中生成的水是气体,不是稳定氧化物,故燃烧热不是Q3kJ,故A错误;B、③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应是放热反应,1mol C2H5OH(g)和3molO2的总能量高于2CO2(g)和3H2O(g)的总能量,故B错误;C、H2O(g)→H2O(l)是物理变化,故C错误;D、已知:①H2O(g)═H2O(l)△H=-Q1kJ•mol-1,②C2H5OH(g)═C2H5OH(l)△H=-Q2kJ•mol-1,③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ•mol-1,据盖斯定律:③-②+①×3得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-Q3+Q2-3Q1)KJ/mol,23g是0.5molC2H5OH,所以释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ,故D正确;故选D。
高中化学学习材料唐玲出品江西师大附中高三上学期期末考试化学试卷相对原子质量:H:1 C:12 N:14 O:16 Al:27 K: 39: Br:80 Cl:35.5I卷(共48分)一、选择题(每小题只有一个正确答案,每小题3分)1. 化学与环境、材料、信息、能源关系密切,下列说法错误..的是()A.将“地沟油”制成肥皂,可以提高资源的利用率B.金属钠、金属镁等活泼金属着火时,可以使用泡沫灭火器来灭火C.我国首艘航母“辽宁舰”上用于舰载机降落的拦阻索是特种钢缆,属于金属材料D.推广以植物秸秆为原料的综合利用技术,避免焚烧秸秆造成空气污染2.下列离子方程式正确的是()A. NaHS溶液水解的方程式为:HS-+H 2O S2-+H3O+B. 向H218O中投入Na2O2固体: 2H218O + 2Na2O2 === 4Na++ 4OH-+ 18O2↑C.在100 mL 2 mol/L FeI2溶液中通入4.48 L氯气(标况下),充分反应:2I-+ Cl2=== I2+2Cl-D.用惰性电极电解饱和氯化钠溶液:2Cl-+2H+H2↑+Cl2↑3.下图是模拟“侯氏制碱法”制取NaHCO3的部分装置。
下列操作正确的是( )A.a通入CO2,然后b通入NH3,c中放碱石灰B.a通入NH3,然后b入CO2,c中放蘸稀硫酸的脱脂棉C.b通入NH3,然后a通入CO2,c中放碱石灰D.b通入CO2,然后a通入NH3,c中放蘸稀硫酸的脱脂棉4. .下列关于铝及其化合物的叙述正确的是( )A.铝罐可久盛食醋 B.铝与Fe2O3发生铝热反应,反应后固体物质增重C.氢氧化铝可作胃酸的中和剂 D.明矾用作净水剂不涉及化学变化5.密闭容器中盛有一定量的CH4与O2混合气体及足量的Na2O2固体,电火花点燃充分反应后,恢复至室温,发现容器为真空,则原混合气中CH4与O2的体积比为()A 2:1B 1:2C 1:1D 任意比6.25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。
高三上学期期末考试卷化学相对原子质量:H-1 C-12 B-10.8 N-14 O-16 S-32 Na-23 K-39 Fe-56 Cu-64第Ⅰ卷选择题一、(共48分,每小题只有1个选项符合题意)1.下列表述错误的是()A. CS2的结构式为:S=C=SB. 6CO2+6H2O C6H12O6+6O2,该变化中光能直接转变为化学能C. CO2(g)+C(s)2CO(g)△H>0,△S>0,该反应常温下能自发进行D. NH3水溶液呈碱性的原因是NH3+H2O NH3·H2O NH4++OH-【答案】C【解析】【详解】A、CS2的结构与CO2相似,为直线型结构,含有两条C=S键,结构式为S=C=S,所以A正确;B、绿色植物的光合作用将光能转化为化学能,所以B正确;C、△H-T△S<0时可自发进行,因CO2(g)+C(s)2CO(g)△H>0,△S>0此在高温时可自发进行,故C错误;D、氨气溶于水形成氨水,一水合氨存在电离平衡, NH3+H2O NH3·H2O NH4++OH-,因此溶液呈碱性,所以D正确;答案:C。
2.已知:①H2O(g)===H2O(l) ΔH=-Q1kJ·mol-1 ②C2H5OH(g)===C2H5OH(l) ΔH=-Q2kJ·mol -1③CH5OH(g)+3O2(g)===2CO2(g)+3H2O(g) ΔH=-Q3kJ·mol-1 ;下列判断正确是()2A. 酒精的燃烧热ΔH=-Q3kJ·mol-1B. 由③可知1 mol C2H5OH(g)的能量高于2 mol CO2(g)和3 mol H2O(g)的总能量C. H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应D. 23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放热量为(0.5Q3-0.5Q2+1.5Q1)kJ【答案】D【解析】试题分析:A、C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应中生成的水是气体,不是稳定氧化物,故燃烧热不是Q3kJ,故A错误;B、③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g);△H=-Q3kJ/mol.反应是放热反应,1mol C2H5OH(g)和3molO2的总能量高于2CO2(g)和3H2O(g)的总能量,故B错误;C、H2O(g)→H2O(l)是物理变化,故C错误;D、已知:①H2O(g)═H2O(l)△H=-Q1kJ•mol-1,②C2H5OH(g)═C2H5OH(l)△H=-Q2kJ•mol-1,③C2H5OH(g)+3O2(g)═2CO2(g)+3H2O(g)△H=-Q3kJ•mol-1,据盖斯定律:③-②+①×3得:C2H5OH(l)+3O2(g)═2CO2(g)+3H2O(l)△H=(-Q3+Q2-3Q1)KJ/mol,23g是0.5molC2H5OH,所以释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ,故D正确;故选D。
江西省赣州市江西师范大学美术学院附属中学高三化学上学期期末试题含解析一、单选题(本大题共15个小题,每小题4分。
在每小题给出的四个选项中,只有一项符合题目要求,共60分。
)1. .A、B、C和D都是周期表中前20号元素,已知A的阳离子和C的阴离子具有相同的核外电子排布,且能形成组成为AC的化合物;C和D属同族元素,其中C中核外电子数是D 中核内质子数的2倍。
B和D同周期且B的同素异形体之一是原子晶体。
下列说法中正确的是()A.D元素处于元素周期表中第2周期第Ⅵ族B.AD2中可能既有离子键又有共价键C.四种元素的原子半径A>C>D>BD.BCD分子一定是直线型非极性分子参考答案:B略2. 在CH3COOH CH3COO- + H+的电离平衡中,要使电离平衡右移,且氢离子浓度增大,应采取的措施是()A.加NaOH(s) B.加浓盐酸 C.加水 D.加热参考答案:答案:D3. Mg﹣AgCl电池是一种用海水激活的一次电池,在军事上用作电动鱼雷的电源.电池的总反应可表示为:Mg+2AgCl═MgCl2+2Ag下列关于该电池的说法错误的是()A.该电池工作时,正极反应为:2AgCl+2e﹣═2C1﹣+2AgB.该电池的负极材料可以用金属铝代替C.有24gMg被氧化时,可还原得到108gAg D.装备该电池的鱼雷在水中行进时,海水作为电解质溶液参考答案:C解:该原电池中Mg易失电子作负极、AgCl是正极,负极反应式为Mg﹣2e﹣=Mg2+,正极反应式为2AgCl+2e﹣═2C1﹣+2Ag,A.通过以上分析知,正极反应式为2AgCl+2e﹣═2C1﹣+2Ag,故A正确;B.Al的活泼性大于Ag,所以铝和氯化银、海水也能构成原电池,则该电池的负极材料可以用金属铝代替,故B正确;C.有24gMg被氧化时,被氧化Mg的物质的量是1mol,转移电子的物质的量是2mol,当转移2mol电子时可还原得到216gAg,故C错误;D.Mg﹣AgCl能用海水激活,所以能构成原电池,则海水作为电解质溶液,故D正确;故选C.4. 把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为()A. B.C. D.参考答案:D设五等份中 NH4HCO3和Na2CO3的混合溶液中NH4HCO3和Na2CO3的量为 x、y mol,可列出方程式组2 x=a,x+ 2y= b 则可解出n(Na+)=b- a/2 ,从而可求出该混合溶液中c(Na+)为,D项正确。
江西师大附中2015届高三年级期末考试理综化学试题第I 卷(126分)一、选择题:本题共13小题,每小题6分。
在每小题给出的四个选项中,只有一项符合题目要求。
7.化学是一门以实验为基础的自然科学,化学实验在化学学习中具有极其重要的作用。
下列实验中所选用的仪器合理的是( ) ①用50 mL 量筒量取5.2 mL 稀硫酸 ②用分液漏斗分离苯和四氯化碳的混合物 ③用托盘天平称量11.7g 氯化钠晶体 ④用碱式滴定管取23.10 mL 溴水 ⑤用瓷坩埚灼烧各种钠化合物⑥用250 mL 容量瓶配制250 mL 0.2 mol/L 的NaOH 溶液A .①②④ B.②③④⑥ C.③⑥ D.③⑤⑥ 8.下列叙述正确的是( )A .Na 在足量O 2中燃烧,消耗l mol O 2时转移的电子数是4×6.02×1023B .盐酸和醋酸的混合溶液pH=1,该溶液中c (H +) = 0.1 mol/L C .1 L 0.1 mol/L NH 4Cl 溶液中的NH +4数是0.1×6.02×1023D .标准状况下2.24 L Cl 2中含有0.2 mol 共价键9.0.1 mol·L -1的稀盐酸与0.2 mol·L -1醋酸钠溶液等体积完全反应后,测得反应后的溶液中c(CH 3COO -)>c(Cl -),则下列判断中错误的是( ) A .温度为298 K 时,pH<7B .c(CH 3COOH)+c(CH 3COO -)=0.1 mol·L -1C .c(CH 3COOH) < c(CH 3COO -) D .c(CH 3COO -)+c(OH -)=c(Na +)+c(H +)10.铁和氧化铁的混合物共a mol ,加盐酸后固体全部溶解,共收集到b mol 氢气,且向反应后的溶液中加入KSCN 溶液不显红色,则原混合物中单质铁的物质的量为 A .)(21b a +mol B .)(b a -mol C .)(21b a -mol D . )(b a +mol11. .利用如图所示原电池可测量空气中Cl 2含量,其中电解质是Ag +可以自由移动的固体物质。
下列分析不.正确的是( ) A .电子经外电路流向Pt 电极 B .电池工作时,电解质中Ag +数目减少 C .正极反应:C12+2e —+2Ag'+ = 2AgCl D 空气中c(C12)越大,Ag 极消耗速率越快 12. 双环己烷 C 12H 22,它的二氯代物,且氯原子不在同一个环上的同分异构体的个数是( )A .13B .12C .11D .1013. 物质中杂质(括号内为杂质)的检验、除杂的试剂或方法都正确的是( )物质及其杂质检验除杂A Cl2(HCl)湿润的淀粉KI试纸饱和食盐水B NO(NO2)观察颜色或湿润的淀粉KI试纸水C CO2(HCl)AgNO3溶液(含稀硝酸)饱和Na2CO3溶液D NaHCO3溶液(Na2CO3)Ca(OH)2溶液过量CO2第II卷(非选择题,共174分)三、非选择题(包括必考题和选考题两部分.第22题~第32题为必考题,每个试题考生都必须做答.第33题~第40题为选考题,考生根据要求做答)(一)必考题(22题~第32题)26. X、Y、Z、M、Q、R是6种短周期元素,其原子半径及主要化合价如下:元素代号X Y Z M Q R原子半径/nm 0.160 0.143 0.102 0.089 0.074 0.037主要化合价+2 +3 +6,-2 +2 -2 +1(在元素周期表中的位置是。
(2)X、Y、Q各自形成简单离子,其中离子半径最大的是(填离子符号)。
(3)周期表中有些处于对角(左上→右下)位置的元素,它们的单质及其化合物的性质存在“对角线相似”的现象,则M的氧化物与强碱溶液反应的离子方程式是。
(4)Q和R按原子个数比1:1组成的化合物甲,是一种“绿色”氧化剂。
①化合物甲的电子式为。
②空气阴极法电解制备甲的装置如右图所示。
在碱性溶液中,利用空气中的氧气还原得到甲和稀碱的溶液。
图中直流电源的a是极,阴极的电极反应式是27.氨气是化工生产的主要原料之一,氨气的用途非常广泛。
在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,发生如下反应: N2(g)+3H2(g)2NH3(g)(ΔH<0)。
(1)该反应平衡常数表达式(2)、下列描述中能说明上述反应已达平衡的是A.3V正(H2)=2V逆(NH3) B.容器中气体的平均分子量不随时间而变化C.容器中气体的密度不随时间而变化 D.容器中气体的分子总数不随时间而变化(3)、上述反应若第5分钟时达到平衡,测得NH3的物质的量为0.2mol 计算从反应开始到平衡时,平均反应速率v(N2)为______________。
(4)、在另一容积可变的容器内加入0.2 mol的N2和0.6 mol的H2,在相同条件下发生上述反应,则产生的NH3的物质的量比原平衡产生的NH3______(填“多”或“少”或”“一样”)。
(5)、工厂生产的氨水稀释后可作肥料。
稀释氨水时,随着水的增加溶液中减少的是A、c(NH4+)/c(NH3•H2O) b、c(NH3•H2O)/c(OH-) C、c(H+)/c(NH4+) d、c(OH-)/c(H+)(6)、液氨和水类似,也能电离:2NH3NH4++ NH2-,某温度时,其离子积K=2×l0-30。
该温度下:①将少量NH4Cl固体加入液氨中,K 2×10-30(填“<”、“>”或“=”);②将少量金属钠投入液氨中,有氢气放出,请写出反应方程式:28.乙二酸俗称草酸,草酸和草酸盐在化学实验中有比较重要的应用。
(1)已知,草酸氢钠溶液呈酸性,请做出合理解释(结合离子方程式)(2)已知,草酸的Ka2>碳酸的ka1,则相同浓度的Na2C2O4和碳酸钠溶液中,水的电离更强的是(3). 20.00 mL 0.100 mol·L-1 VO2+离子恰好将20.00 mL 0.050 mol·L-1 H2C2O4完全氧化成CO2,VO2+被还原为VO n+离子,则VO n+中的n值为(4). 草酸晶体的组成可表示为H2C2O4·xH2O,为测定x值,进行下列实验:①称取Wg草酸晶体配成100.0 mL水溶液;②取25.0 mL所配草酸溶液置于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol·L-1的KMnO4溶液滴定,滴定时,所发生的反应为:____KMnO4+_____H2C2O4+_____H2SO4—_____K2SO4+_____CO2↑+_____MnSO4+_____H2O试回答下列问题:①配平上述化学方程式。
②该实验滴定时,指示剂应该(填“加”或“不加”)。
③若滴定时,反应前后的两次读数分别为a mL和b mL,则实验测得的所配草酸溶液的物质的量浓度为;由此计算出草酸晶体的x值是。
(二)选考题:共45分,请考生从给出的3道物理题、3道化学题、2道生物题中每科任选一题作答,并用2B铅笔在答题卡上把所选题目的题号涂黑。
注意所做题目的题号必须与所涂题目的题号一致,并在答题卡选答区域指定位置答题。
如果多做,则每学科按所做的第一题计分。
36. 【化学—选修2:化学与技术】(略)37. [化学——物质结构与性质](略)38.【化学—选修5有机化学基础】(15分)石油化工的重要原料C x H y可以合成很多有机化合物,以下是C x H y合成物质E和J的流程图:已知:Ⅰ.下列反应中R、R′代表烃基Ⅱ.J的分子式为C4H4O4 ,是一种环状化合物。
(1)在C x H y的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是____ 。
(2)H的分子式是。
(3)下列说法正确的是。
a.C x H y和苯都能使溴水褪色,原理相同 b.反应②和反应④的反应类型均为加成反应c.C能与Na、NaOH、NaHCO3反应 d.E是一种水溶性很好的高分子化合物e.J在酸性或碱性环境中均能水解(4)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出两种符合条件K的结构简式__ __。
(5)写出反应⑤的化学方程式______ ________。
(6)D有多种同分异构体,与D具有相同官能团的还有种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是化学参考答案:7.C 8.B 9.D 10.C 11.B 12.A 13.B26. 每空两分,共12分(1)第3周期ⅥA族(2)O2-(3)BeO+2OH-=BeO-22+H2O(4)①②正极 O2 + 2e-+ 2H2O = H2O2 + 2OH-27.每空两分,共14分(1)23322C(NH)C(N)C(H) K=⋅(2) BD (1对1错不给分,只答一个且对1分)(3) 0.01 mol/(L·min) 2分(数字1分单位1分)(4) 多 2分(5) bd 2分(6) ① = 2分②3222Na+2NH=2NaNH+H↑28.(1)-+2-2424HC O H+C O(2)Na2CO3(3)1(4)①_2_KMnO4+_5_H2C2O4+_3_H2SO4—_____K2SO4+_10_CO2↑+_2_MnSO4+_8_H2O②不加③(b a)c10-⋅50W59c(b a)--36.(1)该反应是可逆反应,反应不完全。
(1分)(2)C+H2O CO+H2 CH4+H2O CO+3H2(4分,各2分)(3)冷却塔(或冷凝器)(1分) n(1分)高温气体由冷却塔上端进入,冷却水从下端进入,逆向冷却效果好(2分)(4)将液氨与未反应的原料气分离(2分)(5)在电磁场的作用下氮氮三建更容易断裂,降低了合成反应所需的能量,反应更容易进行(2分) 节能减排,降低了设备要求(2分)37 (1)晶体(2)1 1s 22s 22p 43s 23p 63d 2深蓝色(3)5N A 异硫氰酸分子间形成氢键,而硫氰酸不能 (4)4 (5)32338910A N a -⋅⋅38.共16分(1) 2,3-二甲基-2-丁烯 (2分) (2) C 2H 3O 2Br (2分)(3)b e (2分)(每对1个得1分,全对得2分,错1个不得分) (4)CH 2=C(COOH)2 HOOCCH=CHCOOH (2分)(5)2CH 2OHCOOH +2H 2O (3分)(6)5 (3分) (2分)。