核酸探针与羧基微球偶联的实验方案
- 格式:docx
- 大小:21.57 KB
- 文档页数:3

羧基抗体偶联文献羧基抗体偶联是一种常用的实验技术,可以用于检测和定位特定的蛋白质。
本文将从研究背景、实验步骤、实验结果和应用前景等方面,详细介绍羧基抗体偶联的原理和方法。
1. 研究背景蛋白质是生物体内最基本的分子组成部分,它们在细胞的生理过程中起着重要的作用。
为了研究蛋白质的功能和定位,科研人员开发了许多方法和技术。
其中,羧基抗体偶联技术因其简单、快速且高效,成为研究蛋白质的有力工具。
2. 实验步骤羧基抗体偶联的实验步骤主要包括以下几个方面:(1)抗原处理:将待检测的蛋白质进行处理,如提取、纯化等。
(2)抗体偶联:将具有特异性的抗体与羧基化试剂进行偶联反应,使抗体表面引入羧基官能团。
(3)偶联反应:将经过羧基化的抗体与待检测的抗原进行反应,形成稳定的抗原-抗体复合物。
(4)检测与定位:利用特定的检测方法,如免疫荧光、酶标等,对抗原-抗体复合物进行检测和定位。
3. 实验结果羧基抗体偶联的实验结果主要通过可视化的方式呈现,如荧光显微镜下的荧光信号或酶标反应后的色素沉积。
这些结果可以直观地显示出待检测蛋白质的分布情况和定位位置。
4. 应用前景羧基抗体偶联技术在生物医学研究中有着广泛的应用前景。
它可以用于研究蛋白质的功能、定位和相互作用等方面。
此外,羧基抗体偶联技术还可以应用于药物开发和临床诊断领域,为疾病的早期诊断和治疗提供重要支持。
羧基抗体偶联技术是一种简单、快速且高效的实验方法,可以用于检测和定位特定蛋白质。
它在生物医学研究中有着广泛的应用前景,为我们深入了解蛋白质的功能和机制提供了有力工具。
随着技术的不断发展和完善,相信羧基抗体偶联技术将在未来发挥更大的作用,为科学研究和医学进步做出更大贡献。

羧基磁珠偶联抗体及应用羧基磁珠偶联抗体是一种用于免疫学研究的常用实验工具,其利用磁性珠子表面的羧基官能团结合特定的抗体分子实现目标蛋白或分子的富集和纯化。
本文将对羧基磁珠偶联抗体的原理、制备方法和应用进行探讨。
一、羧基磁珠偶联抗体的原理羧基磁珠偶联抗体技术是一种利用磁性珠子上表面的羧基官能团结合特定抗体分子实现目标蛋白或分子富集和纯化的技术。
其原理是通过将抗体与磁珠表面的羧基官能团进行偶联,例如采用羧基-胺化学反应(EDC-NHS反应)等交联技术,从而实现抗体的高效结合。
此后,将该偶联物加入样品体系中,目标分子会高效结合到磁性珠子表面,而非特异性大量结合于背景物质上,从而实现目标蛋白或分子的快速富集和纯化。
二、羧基磁珠偶联抗体的制备方法(1)磁性珠子的悬浮液制备首先,根据实验需求选择合适的磁性珠子(如聚合物磁珠或硅胶磁珠),将其取出并在磁性力场下沉淀。
接着,使用磁性珠子表面稳定剂(例如Tween20)和其他化学试剂对其进行表面修饰和活化,制备羧基化珠子悬浮液。
(2)抗体偶联将目标抗体按照体积比加入悬浮液中,并搅动反应一段时间。
加入羧基活化交联试剂,如EDC和NHS,进行交联反应。
通过洗涤和离心,去除剩余的试剂,得到羧基磁珠偶联抗体。
(3)应用制得的羧基磁珠偶联抗体,可以用于生物分子的富集和纯化,如蛋白质、核酸、糖类等。
其应用包括但不限于:分析检测、免疫印迹、免疫染色、酶标记、患者体内药物动态监测,等等。
三、羧基磁珠偶联抗体的应用(1)生物分析检测磁珠偶联抗体技术在药物研发和分析中被广泛应用,其技术的独立性和准确性得到了广泛认可。
磁珠偶联法不仅可以对高丰度的蛋白质进行分离,同时还能够快速、稳定地分离寡肽、肽类、多肽、基因、DNA等生物分子物质。
其应用领域主要包括生医、食品安全检测、化妆品等。
(2)临床医学磁珠偶联法能够在病人的外周血液中寻找和规律分析少量的肿瘤细胞和循环肿瘤DNA (ctDNA)。

核酸分子杂交实施方案核酸分子杂交是一种重要的实验技术,广泛应用于生物学、医学和生物化学领域。
它通过核酸序列的互补配对来检测、定量和分析特定的核酸分子,因此在基因克隆、基因表达调控、病毒检测等方面有着重要的应用价值。
下面将介绍核酸分子杂交的实施方案,包括实验材料准备、实验步骤和结果分析等内容。
实验材料准备。
1. 核酸探针,根据实验需要设计合适的核酸探针,通常选择20-30个碱基长度的寡核苷酸序列作为探针。
2. 核酸标记物,可以选择放射性同位素标记、酶标记或荧光标记的核酸标记物。
3. 核酸杂交缓冲液,包括盐类、缓冲剂、表面活性剂等成分,用于维持核酸的稳定性和杂交反应的进行。
4. 核酸杂交膜,选择适合的膜材料,如硝酸纤维素膜、尼龙膜等,用于固定核酸样品和进行杂交反应。
5. 核酸杂交仪器,包括恒温振荡器、放射自显影仪等设备,用于控制反应条件和检测结果。
实验步骤。
1. 核酸样品制备,从细胞、组织或体液中提取核酸样品,并进行纯化和定量处理。
2. 核酸标记,将核酸样品与核酸标记物进行反应,标记核酸样品,使其具有检测信号。
3. 核酸杂交,将标记的核酸样品与核酸探针共同加入核酸杂交缓冲液中,进行恒温振荡反应,使其发生互补配对杂交。
4. 杂交膜固定,将杂交反应产物通过滤纸吸附或紫外交联的方式固定在核酸杂交膜上。
5. 杂交膜检测,利用放射自显影仪或荧光成像系统对固定的核酸杂交膜进行检测,观察杂交信号强度和位置。
结果分析。
根据核酸杂交膜的检测结果,可以分析样品中特定核酸序列的存在与否、数量的多少以及位置的分布等信息。
通过比对标准曲线或对照样品,可以定量分析目标核酸的含量,并进行统计学处理和结果解释。
总结。
核酸分子杂交是一种重要的实验技术,通过合理的实施方案和严格的实验操作,可以获得准确、可靠的实验结果。
在实验中需要注意核酸样品的处理和标记、杂交条件的控制、杂交反应产物的固定和检测等关键步骤,以确保实验的成功进行和结果的可靠性。

Bio-Plex核酸偶联操作手册Bio-Plex核酸偶联操作手册1,原理介绍Bio-plex液相悬浮芯片系统提供了多达100种的羧基微球,用户可以自己偶联探针或蛋白,用于检测目标核酸或蛋白。
本手册介绍的是核酸偶联的操作步骤。
核酸的偶联需要首先合成2种寡聚核苷酸片断,分别是1,捕获探针:一段带有5’氨基修饰的C6或C12手臂的寡核苷酸。
这段序列需要与待检测的序列反向互补。
Note:关于究竟用C12 还是用C6作为手臂,有人认为C12 会提供更好的结果,但是也有人认为两者之间并没有什么差异;但是没有人认为C12 会得到不好的结果,所以用C12做手臂是一种比较安全的选择。
2,验证探针:一段带有5’生物素标记的片断,序列与捕获探针反向互补。
这段序列用于验证偶联的效率。
如下图所示,列出了捕获探针和验证片断的例子:表1,捕获探针和验证探针示意(序列按照5’-3’的方向)下图是整个偶联过程的示意图:2.0材料2.1寡核苷酸,如Biosearch T echnologies或者Integrated DNA Technologies;2.2 微球偶联所需试剂√试剂供应商/货号数量1.5ml离心管USA Scientific 1415-2500 多个EDC(1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐)Pierce 77149 2X10mg (一次偶联所需)血球计数器VWR 15170-172 1MES (2-吗啉乙磺酸)Sigma M2933 25g5N NaOH Fischer SS256-500 500mlTween 20 Sigma P9416 50mlSDS,10% 溶液Sigma L4522 100mlTE buffer,pH8.0,100X Sigma T9285 100ml2.3 杂交检测所需试剂√试剂供应商/货号数量Sarkosyl(N-月桂酰肌氨酸)Sigma L9150 50g5M TMAC(四甲基氯化铵)Sigma T3411 500ml链霉亲和素-藻红素(SA-PE),1mg/ml Prozyme PJ31S 1mg3.0 微球偶联以下是微球偶联过程中所需的试剂,按照下表列出的数量,然后加分子生物学级的水至250ml的体积。

羧基磁珠生物配体共价偶联
在生物医学领域,磁珠技术因其独特的物理性质和化学特性而备受关注。
其中,羧基磁珠与生物配体的共价偶联,更是广泛应用于各种生物实验和医学检测中。
羧基磁珠表面带有的羧基官能团,使其能够与各种生物配体进行共价偶联。
这种偶联方式不仅具有高度的特异性和稳定性,而且能够有效地增加生物配体在磁珠表面的负载量。
通过与不同生物配体的偶联,羧基磁珠能够在多种生物反应中发挥关键作用,如免疫分离、核酸提取、蛋白质分离等。
在进行羧基磁珠与生物配体的共价偶联时,需要选择适当的偶联条件,如pH值、温度、反应时间等。
这些条件的选择直接影响到偶联效果,包括偶联率、偶联产物的稳定性等。
通过对这些条件的优化,可以进一步提高羧基磁珠的偶联效率,从而更好地满足实验或检测需求。
此外,为了确保羧基磁珠与生物配体的共价偶联能够顺利进行,还需要对磁珠进行适当的预处理。
例如,通过调整磁珠的浓度、粒径大小以及使用适当的缓冲液等,可以有效地提高磁珠的分散性和稳定性,从而更好地促进偶联反应的进行。
总之,羧基磁珠与生物配体的共价偶联是一种高效、稳定的生物技术方法。
通过优化偶联条件和磁珠预处理方法,可以进一步提高偶联效率,为各种生物实验和医学检测提供更加可靠的解决方案。
随着生物技术的不断发展,羧基磁珠与生物配体的共价偶联将在更多领域发挥重要作用,为人类健康和生活质量的提高做出更大的贡献。

核酸探针技术的原理和应用引言核酸探针技术是一种重要的分子生物学工具,通过利用特异性的核酸序列与待测样品中的目标序列进行特异性配对,从而实现对目标序列的检测和定量分析。
本文将介绍核酸探针技术的原理以及其在生物学研究、医学诊断和药物开发等领域的应用。
一、核酸探针技术的原理核酸探针技术利用两条互补的核酸分子之间的碱基配对原理,通过标记的核酸序列与待测样品中的特定目标序列进行靶向配对。
该技术的原理主要包括以下几个方面:1.互补配对:核酸分子由四种碱基(腺嘌呤,胸腺嘧啶,鸟嘌呤和胞嘧啶)组成,它们之间可以通过碱基配对形成双链结构。
腺嘌呤与胸腺嘧啶之间形成两个氢键,鸟嘌呤与胞嘧啶之间形成三个氢键。
根据这种碱基配对原理,核酸探针可以与目标序列中的特定碱基序列进行互补配对。
2.标记物:核酸探针常常需要进行标记以便于检测。
常用的标记物包括荧光染料、放射性同位素、酶和磁珠等。
标记物的选择取决于具体的实验需求和检测方法。
3.检测方法:核酸探针技术可以通过不同的检测方法进行信号的读取和分析。
常见的检测方法包括荧光检测、放射性测量、酶促反应和磁性检测等。
这些方法可以实现对标记物信号的定量分析和可视化显示。
二、核酸探针技术的应用核酸探针技术具有高灵敏度、高特异性和高选择性的优势,被广泛应用于各个领域。
以下是核酸探针技术在生物学研究、医学诊断和药物开发等领域的应用:1.基因表达分析:核酸探针技术可用于研究基因的表达模式、调控机制和功能。
通过对目标基因的探针设计和合成,可以检测该基因在不同组织、细胞或条件下的表达水平。
2.病毒检测:核酸探针技术在病毒检测中具有重要意义。
例如,针对新型冠状病毒(COVID-19)的核酸探针被广泛应用于病毒的快速检测和筛查。
3.癌症诊断:核酸探针技术可用于癌症诊断和预后评估。
通过检测肿瘤标志物的核酸序列,可以快速、准确地判断患者是否患有癌症,以及癌症的类型和分级。
4.药物研发:核酸探针技术在新药研发中发挥重要作用。
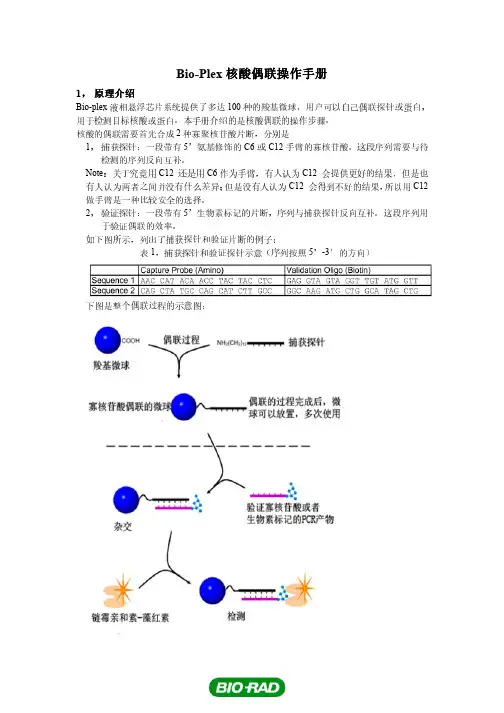
Bio-Plex核酸偶联操作手册1,原理介绍Bio-plex液相悬浮芯片系统提供了多达100种的羧基微球,用户可以自己偶联探针或蛋白,用于检测目标核酸或蛋白。
本手册介绍的是核酸偶联的操作步骤。
核酸的偶联需要首先合成2种寡聚核苷酸片断,分别是1,捕获探针:一段带有5’氨基修饰的C6或C12手臂的寡核苷酸。
这段序列需要与待检测的序列反向互补。
Note:关于究竟用C12 还是用C6作为手臂,有人认为C12 会提供更好的结果,但是也有人认为两者之间并没有什么差异;但是没有人认为C12 会得到不好的结果,所以用C12做手臂是一种比较安全的选择。
2,验证探针:一段带有5’生物素标记的片断,序列与捕获探针反向互补。
这段序列用于验证偶联的效率。
如下图所示,列出了捕获探针和验证片断的例子:表1,捕获探针和验证探针示意(序列按照5’-3’的方向)下图是整个偶联过程的示意图:2.0材料2.1寡核苷酸,如Biosearch Technologies或者Integrated DNA Technologies;2.2 微球偶联所需试剂√试剂供应商/货号数量1.5ml离心管USA Scientific 1415-2500 多个EDC(1-乙基-(3-二甲基氨基丙基)碳化二亚胺盐酸盐)Pierce 77149 2X10mg (一次偶联所需)血球计数器VWR 15170-172 1MES (2-吗啉乙磺酸)Sigma M2933 25g5N NaOH Fischer SS256-500 500mlTween 20 Sigma P9416 50mlSDS,10% 溶液Sigma L4522 100mlTE buffer,pH8.0,100X Sigma T9285 100ml2.3 杂交检测所需试剂√试剂供应商/货号数量Sarkosyl(N-月桂酰肌氨酸)Sigma L9150 50g5M TMAC(四甲基氯化铵)Sigma T3411 500ml链霉亲和素-藻红素(SA-PE),1mg/ml Prozyme PJ31S 1mg3.0 微球偶联以下是微球偶联过程中所需的试剂,按照下表列出的数量,然后加分子生物学级的水至250ml的体积。

Biotin偶联实验方案目标本实验的目标是通过偶联反应将biotin分子与目标分子(如蛋白质或核酸)结合,以便于后续的检测、纯化或定位等操作。
具体来说,我们希望实现以下几个目标:1. 成功合成biotin-偶联试剂(biotinylating reagent); 2. 将biotinylating reagent与目标分子进行偶联反应; 3. 确认偶联反应的成功程度,并评估其对目标分子功能的影响。
实施步骤1. 合成biotinylating reagent合成biotinylating reagent是本实验的第一步,该试剂将用于后续的偶联反应。
以下是一个可能的合成方案:材料:•Biotin-NHS酯(N-hydroxysuccinimide ester)•活化剂(如dicyclohexylcarbodiimide,简称DCC)•溶剂(如二甲基亚砜)步骤:1.称取适量的Biotin-NHS酯并溶解于溶剂中,制备出一定浓度的Biotin-NHS酯溶液。
2.在低温下加入适量的活化剂,并充分搅拌混合。
3.将反应混合物保持在低温下,反应一定时间(如2小时),以确保biotin-NHS酯与活化剂发生偶联反应。
4.过滤反应混合物以去除未反应的杂质。
5.使用适当的纯化方法(如柱层析、溶液浓缩等)纯化得到biotinylatingreagent。
2. 偶联反应在合成得到biotinylating reagent之后,我们将其与目标分子进行偶联反应。
以下是一个可能的偶联反应方案:材料:•Biotinylating reagent•目标分子(如蛋白质或核酸)•缓冲液(如PBS)步骤:1.准备一定浓度的biotinylating reagent溶液。
2.将目标分子溶解于缓冲液中,调整pH值至适当范围。
3.向目标分子溶液中加入适量的biotinylating reagent,并充分混合。
4.在适当温度下(如室温或低温)静置一定时间,使偶联反应发生。


羧基乳胶微球偶联方法
羧基乳胶微球的偶联方法一般包括以下步骤:
1. 将羧基乳胶微球与含化学修饰剂的活化缓冲液混合,以对羧基乳胶微球进行活化。
2. 经重悬、分散后,将待偶联的蛋白与活化后的羧基乳胶微球混合,进行偶联反应。
3. 偶联反应后,进行封闭、保存。
在偶联过程中,常用的化学修饰剂为edc 和 sulfo-nhs 或 nhs 的混合物,edc 与sulfo-nhs 或 nhs 的混合摩尔比为1∶2-4,edc 与羧基乳胶微球的羧基量的摩尔比为5-30∶1。
实际操作中,偶联条件可能需要根据具体情况进行调整。
如果你想了解更多关于羧基乳胶微球偶联方法的信息,请补充相关细节继续向我提问。

一种羧基乳胶微球与抗体的偶联方法引言:羧基乳胶微球是一种常用的载体材料,在生物技术、生物医学研究等领域有着广泛的应用。
将羧基乳胶微球与抗体偶联可以实现抗体的定向、高效地与靶分子结合,从而用于生物分析、诊断和治疗等应用。
本文将介绍一种羧基乳胶微球与抗体的偶联方法,以及该方法的优势和应用前景。
方法:1.材料准备:- 羧基乳胶微球:可通过合适的乳化聚合方法制备,其粒径一般控制在100-1000 nm之间。
-交联剂:羧基乳胶微球一般表面具有丰富的羧基官能团,可通过与交联剂反应实现微球的交联,增强抗体的稳定性。
-免疫活性分子:选择与目标抗体匹配的免疫活性分子,如胺基酸、蛋白质等。
2.羧基乳胶微球表面修饰:使用化学方法将胺基酸、蛋白质等与羧基乳胶微球反应,实现羧基乳胶微球表面的修饰和激活,增加偶联反应的效率和稳定性。
3.抗体偶联:将修饰后的羧基乳胶微球与目标抗体进行偶联,可采用传统的化学偶联方法,如活化的EDC/NHS法、硫酸亚铁/亚砜法等。
将抗体与羧基乳胶微球充分混合,在适当的反应条件下(pH、温度等),进行偶联反应。
4.反应后的处理:偶联反应后,通过洗涤等方法去除未偶联的抗体和副产物,得到羧基乳胶微球与抗体稳定结合的产物。
优势和应用前景:-选择合适的乳化聚合方法和交联剂,可控制羧基乳胶微球的粒径和形貌,使其具有较大比表面积和较好的稳定性。
-通过表面修饰,增加羧基乳胶微球与抗体之间的亲和力和稳定性,提高偶联效率。
-该方法操作简单、成本较低,适用于大规模生产。
-偶联的羧基乳胶微球具有良好的生物相容性和稳定性,可用于体内外生物学研究、诊断和治疗等领域。
-偶联的羧基乳胶微球可用于靶向传递药物、检测靶分子、研究生物分子交互作用等应用。
总结:本文介绍了一种羧基乳胶微球与抗体的偶联方法,该方法可以实现抗体的定向、高效地与靶分子结合。
该方法具有操作简单、成本低、适用性广等优点,并在生物学研究、诊断和治疗等领域具有广阔的应用前景。
初二生物核酸探针设计策略自从瑞典科学家卡里·穆拉纳和科兹·科赫从DNA双螺旋结构中发现RNA的重要性以来,核酸科学领域取得了巨大的发展。
在生物科学中,核酸探针作为一种重要的研究工具,被广泛应用于DNA和RNA的定位、检测和分析。
本文将介绍初二生物学中核酸探针的设计策略。
1. 全互补性探针全互补性探针是最简单常用的核酸探针设计策略。
全互补性探针的序列与目标DNA或RNA靶标互补,通过键合作用与目标分子结合。
全互补性探针具有灵敏度高、准确度高的优点,但其应用范围受到序列特异性的限制。
2. 缺失互补性探针缺失互补性探针是一种在互补性序列中故意引入缺失,使探针与靶标序列不完全互补的设计策略。
通过引入缺失,可以提高探针与杂交靶标的选择性,避免非特异性结合的干扰。
缺失互补性探针的独特性能使其在特定应用中具有更好的特异性。
3. 引物探针引物探针是一种结合了引物和探针功能的串联核酸分子。
引物的功能是引导聚合酶沿DNA链合成互补链,而探针则同时起到检测的作用。
引物探针的设计策略可以允许在PCR扩增过程中同时进行目标检测,提高实验效率。
4. 指示器探针指示器探针是一种使用荧光染料或其他标记物来标记目标核酸的探针。
当与目标结合时,指示器探针会发生构象变化,导致荧光发射谱的变化。
指示器探针的设计策略可以使其在检测目标核酸时具有高度灵敏度和特异性。
5. 能量转移探针能量转移探针是一种通过共振能量转移来实现信号输出的探针。
能量转移可由多种机制实现,如荧光共振能量转移和非辐射能量转移等。
能量转移探针的设计策略可以根据不同的能量转移机制进行调整,以实现准确和特异的信号输出。
总结:初二生物学中核酸探针设计策略是一个重要的研究课题,不同的设计策略适用于不同的实验需求。
全互补性探针适用于序列特异性较高的应用,而引物探针和指示器探针则适合在PCR扩增和荧光检测中使用。
缺失互补性探针和能量转移探针则在特异性和信号输出方面具有优势。
核酸探针与羧基微球偶联
根据Bio-Plex公司的羧基微球偶联探针方案,选取适当编号的羧基微球,用EDC将合成的氨基修饰探针分别偶联到不同标号的羧基微球上制备核酸探针微球,偶联方法如下:
1.将选定编号的梭基微球及2瓶未开封EDC粉末(10mg/瓶)置室温平衡60min。
2.将待偶联的带C12连接臂的氨基修饰核酸探针提前用灭菌ddH2O溶解,至
终浓度为0.1 nmol/μl,高速震荡混匀。
3.羧基微球用涡旋震荡仪高速震荡30秒,然后置超声仪中超声震荡2次,每
次各15秒。
4.用移液器移取100μl微球(Bio-PlexTM 羧基微球)加入1.5ml Eppendorf管中。
5.14000xg离心4min使微球沉淀。
6.小心移除上清液,在每管中加入加入8.5μl 0.1M MES (pH4.5),涡旋震荡混
匀。
7.每种核酸探针各取1μl(0.1 nmol/μl)加入到对应编号的羧基微球管中。
8.在10 mg/瓶的EDC粉末瓶中加入1 ml 灭菌ddH2O,充分溶解EDC粉末,
新鲜制备浓度为10 mg/ml 的EDC溶液,向每种羧基微球管中加入0.5μl EDC 溶液,立即涡旋震荡混匀。
9.各羧基微球管用铝箔包盖避光,置试管震荡器上缓和震荡(约500rpm )室温孵
育30min。
10.向每管中重复加入0.5μl新鲜制备的10mg/ml浓度的EDC溶液,避光缓和震
荡孵育30min 。
11.向每管中加入1 ml 0.02% Tween 20涡旋震荡混匀。
12.14000xg离心4min。
13.小心移除上清液,再向每管中加入l ml 0.1% SDS,涡旋震荡混匀。
14.16000xg离心4min。
15.小心移除上清液,加入20TE (pH8.0)涡旋震荡混匀。
16.微球计数:用血球计数仪对完成偶联的微球悬液进行计数,每μl微球数不少
于4×104个为宜。
17.偶联完成的微球悬液避光储存于2~10℃,备与验证序列杂交确认偶联反应的
质量。
杂交验证
偶联完成的微球,需通过与验证序列杂交来鉴定偶联反应的质量。
1准备工作微球混合液
对偶联完成的核酸探针微球进行杂交验证时需准备约30个反应孔的工作微球混合液。
1.1选择合适的核酸探针偶联微球组,将每种核酸探针偶联微球混合物在涡旋震荡仪上高速震荡混匀40秒,然后按照下述步骤准备工作微球混合液:
在1.5ml离心管中加入660μl 1.5x TMAC杂交缓冲液(微球稀释液)。
b.对每种核酸探针偶联微球各取150000个微球加入到混合液离心管中。
按V=150000/B (B=微球浓度,V=需加入每种微球混和物的体积)的计算公式计算每种微球混和物所需加入的体积。
1.2用双蒸水稀释至终体积为990μl。
1.3置冰上暂存。
(勿冷冻)
2准备验证序列混合液
准备一份新鲜的验证序列稀释液,每种验证序列稀释至终浓度为10fmol/
操作步骤如下:
2.1从1 nmol/μl (1mM)的贮存液开始,在996μl TE (pH8.0)溶液中加入验证序列(1:250稀释),彻底混和均匀。
得到每种验证序列的浓度为4pmol/μl溶液。
2.2取2.5μl上述稀释液加入到997μl TE (pH8.0)中(1:400稀释),彻底混和均匀。
得到每种验证序列的浓度为10fmol/μl的溶液。
2.3储存在冰中待用。
3杂交
3.1震荡30秒混匀工作微球混合液。
3.2在一块标准PCR板中每孔加入33μl 工作微球混合液待用。
3.3按照下列表格所示在每排的3个孔中加入验证序列混合液和TE:
A.17μl TE 0
B.0.5μl Oligo Mix and 16.5μl TE.......(5 fmol)
C.1μl Oligo Mix and 16μl TE............(10 fmol)
D.2μl Oligo Mix and 15μl T
E............(20 fmol)
E.5μl Oligo Mix and 12μl TE............(50 fmol)
F.10μl Oligo Mix and 7μl TE.............(100 fmol)
G 20μl Oligo Mix..............................(200 fmol)
3.4轻轻上下吹打几次混匀反应孔。
3.5用胶盖盖上反应板以防蒸发,在95-100℃下孵育5分钟。
3.6置于摇床孵育箱中以适当的杂交温度下孵育15分钟。
3.7在3 ml 1 x TMAC溶液中加入9μl streptavidin-R-phycoerythrin (SA-PE) (1 mg/ml)新鲜制备终浓度为3μg /ml SA-PE的报告混合,漩涡混合均匀。
3.8在恒温箱中将过滤板预热至退火温度
3.9将样品转移到已预热的过滤板。
在1-2 inches Hg(25-50毫米汞柱)真空下快速移去杂交缓冲液。
3.10从真空泵上移出并在每孔中加入100μl报告混合液。
轻轻上下吹打混匀(或密封板后轻轻摇动)。
3.11室温下孵育反应板5分钟。
3.12取50μl在Bio-Plex 200悬液芯片检测系统按相应操作步骤进行检测分析。
参考文献
[1] 陈沁. 一种基于悬液芯片的呼吸道病毒多重检测方法[D]. 复旦大学, 2013.。