2018年上半年四川省医疗器械飞行检查结果统计表
- 格式:doc
- 大小:97.50 KB
- 文档页数:6
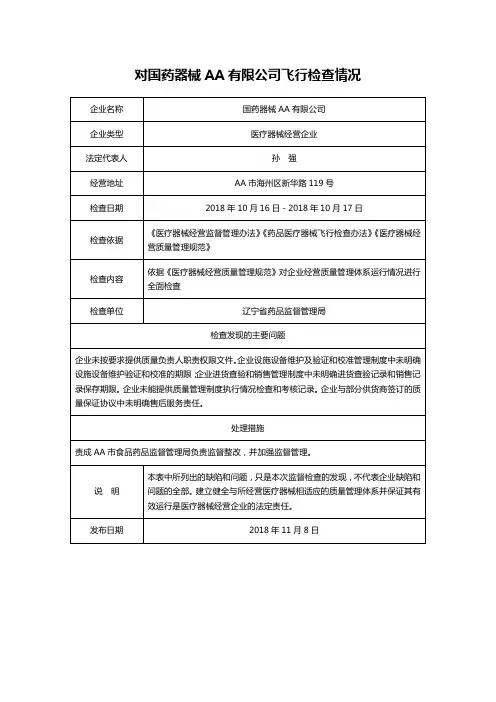
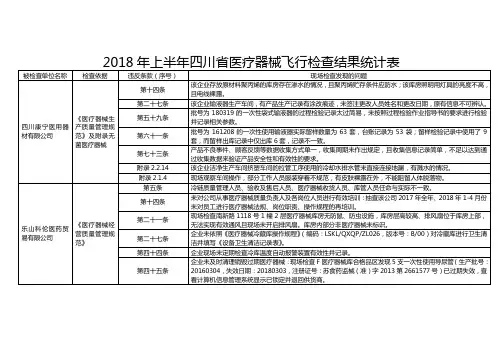


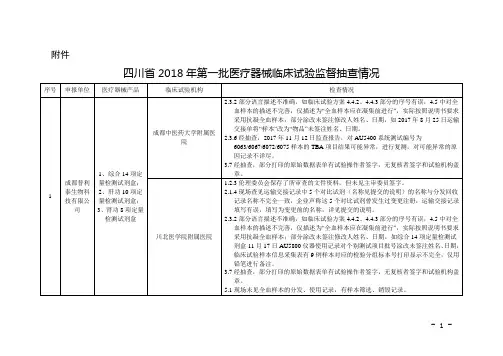
附件被检查单位2018 年上半年四川省医疗器械飞行检查结果统计表检查依据违反条款(序号)名称第十四条第十五条现场检查发现的问题原材料及成品库的现场及温湿度记录表上均未标明允许的温湿度范围。
输液器厂房搬入了新的大型生产设备,搬入后恢复生产前的验证资料不全。
《医疗器械第十七条成品库未标明合格区,成品库设置的待检区空置,实际放在解析区。
在输液器生产现场看到“穿刺器护套检验记录03”记录中时,间为 4.25,实际生产时间为 4.24 18:00成都市新津事丰医疗器械有限公司查特生物医疗(成都)有限公司生产质量管理规范》及附录无菌医疗器械《医疗器械生产质量管理规范》第五十条第五十一条第五十七条第六十一条第十二条第二十五条第五十五条第六十三条开始,未按实际生产时间进行记录。
一次性使用注射器“料粒使用记录” ,实施人员记录为“粉料工” ,未记录实施人员的姓名。
在输液器生产车间现场发现一件批号为180326 的输液管软管货位卡上的信息(有规格)与货箱上的信息(无规格)不完全一致。
检验中心的天平(编号JLA-080-P)放置在平滑的硬质台面上,随着开门容易移动,可能导致称量结果不稳定;高压蒸汽灭菌器与高温干燥器同放一室,可能影响干燥结果。
现场抽查的“ 一次性使用输液器” (批号为070311)留样记录的台账信息与留样盒上标示信息不完全一致。
D 生产车间制氧机生产线与办公场所未有效隔离。
未按照《文件控制程序》(GP/QP-01)的规定对文件进行管理。
现场检查发现 E 车间漏电测试岗位无绝缘地垫。
公司对制氧机经营企业“广州润之健医疗科技有限公司”资质未按规定进行审核:广州润之健医疗科技有限公司有第二类医疗器械经营备案凭证,但工商营业执照经营范围无医疗器械。
-1-四川省广元市《医疗器械生产质量管第十七条第二十七条仓储区未按照待验、合格、不合格、退货或召回等进行有序、分区存放各类材料和产品,以便于检查和监控。
在灭菌环节的原始记录中,使用热敏纸作为原始数据载体,不符合法规要求的“记录保存期限至少相当于生产企业规定的医疗器械的寿命期”的要求。

医疗器械飞行检查法规文件及检查类别与结果梳理朱立武《药品医疗器械飞行检查办法》(国家食品药品监督管理总局令第14号)于2015年6月29日公布,自2015年9月1日起施行。
飞行检查是食品药品监管部门针对行政相对人开展的不预先告知的监督检查,具有突击性、独立性、高效性等特点。
2006年,国家食品药品监管局发布了《药品GMP飞行检查暂行规定》,2012年发布《医疗器械生产企业飞行检查工作程序(试行)》,在调查问题、管控风险、震慑违法行为等方面发挥了重要作用。
2016年2月5日发布总局关于第三类医疗器械生产企业实施医疗器械生产质量管理规范有关事宜的通告(2016年第19号),根据《关于医疗器械生产质量管理规范执行有关事宜的通告》(国家食品药品监督管理总局通告2014年第15号),自2016年1月1日起,所有第三类医疗器械生产企业应当符合《医疗器械生产质量管理规范》(国家食品药品监督管理总局公告2014年第64号)的要求。
其中,无菌、植入性医疗器械和体外诊断试剂生产企业的质量管理体系还应当分别符合无菌、植入性医疗器械和体外诊断试剂附录(国家食品药品监督管理总局公告2015年第101号、第102号、第103号)的要求。
同日(2016年2月5日发布)总局办公厅关于切实做好第三类医疗器械生产企业实施医疗器械生产质量管理规范有关工作的通知食药监办械监〔2016〕12号,各省级食品药品监督管理部门要充分认识贯彻实施医疗器械生产质量管理规范的重要性,摸清行政区域内第三类医疗器械生产企业质量管理体系运行现状及问题,统筹规划安排,制定具体的检查方案和对企业的宣传培训工作方案,推进工作有序开展,确保贯彻实施工作落到实处。
各地食品药品监管部门要加强对行政区域内第三类医疗器械生产企业的监督检查。
2016年要按照医疗器械生产质量管理规范的要求,完成对行政区域内所有第三类医疗器械生产企业质量管理体系的全面检查。
在检查中,发现关键项目不符合的,或不符合项可能对产品质量产生直接影响的,应当要求企业停产整改;仅发现一般项目不符合要求,且不对产品质量产生直接影响的,应当要求企业限期整改。


四川省卫生和计划生育委员会关于印发2018年卫生计生监督抽检计划的通知文章属性•【制定机关】四川省卫生和计划生育委员会•【公布日期】2018.03.21•【字号】川卫办发〔2018〕10号•【施行日期】2018.03.21•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】卫生医药、计划生育综合规定正文关于印发2018年卫生计生监督抽检计划的通知川卫办发〔2018〕10号各市(州)卫生计生委、科学城卫生计生委,省卫生计生监督执法总队,省疾病预防控制中心:为加强事中事后监管,做好监督抽检工作,按照《国家卫生计生委办公厅关于印发2018年卫生计生监督抽检计划的通知》(国卫办监督函〔2018〕139号)要求,结合我省实际,我委组织制定了2018年公共卫生、传染病防治和消毒产品、医疗卫生、计划生育监督抽检计划。
现印发你们,请按照要求组织实施。
具体要求如下:一、做好组织实施(一)制定实施方案。
各地要根据我委下发计划制订本地实施方案,并组织实施。
要根据实际情况实时更新执法检查对象名录库和执法检查人员名录库,确保本底清楚。
县(区)级监督机构执法检查人员名录库中参与一线监督执法的监督员原则上不低于本机构人员总数的70%。
(二)保障顺利开展。
各地要积极争取各级财政资金支持,加大全省重点监督随机抽查工作保障力度;加强业务培训,提高执法检查人员发现问题的能力;加强对下级的指导督促和检查,确保全省监督抽检工作顺利开展。
二、任务抽取与结果报送(一)任务抽取。
2018年国家监督抽检任务由卫生监督中心分别于3月和6月分两批抽取;标记为“(省)”的抽检任务由省卫生计生监督执法总队抽取。
所有监督抽检任务均通过省级卫生计生监督信息平台下达,各地监督机构系统管理员接收任务后,送同级卫生计生行政部门组织实施。
(二)结果上报。
各地要按要求及时报送相关信息,具体要求见附件各专业监督抽检计划。
2018年6月10日前完成上半年监督抽检信息报送工作;2018年8月15日前完成游泳场所监督抽检信息报送工作;2018年10月20日前完成下半年监督抽检信息报送工作。
市场监管总局发布2018年度检验检测服务业统计结果uperuise Bearing 监管动态整理/本刊记者李颖市场监管总局于2019年3月在 全国范围内组织开展了 2018年度 检验检测服务业统计工作。
统计结 果表明,我国检验检测产业规模不断扩大、产业结构持续优化、科 研创新能力不断增强,但“小、散、弱”的基本面貌仍未改变。
检验检测产业规模不断扩大截至2018年底,我国共有检验 检测机构39472家,较2017年增长 8.66%,全年实现营业收入2810.5 亿元,较2017年增长18.21%。
从业人员117.43万人,较上年增长4.91%,共拥有各类仪器设备633.77万台套,较上年增长10.1%; 仪器设备资产原值3195.54亿元,较上年增长11.29%。
2018年共出 具检验检测报告4.28亿份,同比增 长13.83%,平均每天对社会出具各类报告117.26万份。
检验检测机 构数量及检验检测市场规模保持同步增长。
此外,从户均产值、人 均产值、户均出具检验检测报告数量等数据来看,2018年我国检 验检测行业整体发展形势良好,较 2017年有明显提升。
二、检验检测产业结构持续优化(一)事业单位制检验检测机构占机构总量的比重首次下降到30%以下。
2018年,我国企业制的检验检测机构26000家,占机构总量的65.87%;事业单位制10924家,占机构总量的27.68%,事业单位制检验检测机构占机构总量的比重首次下降到30%以下。
近5年,我国事业单位制检验检测机构的比重分别为40.6%、38.1%、34.54%、31.30%和27.68%,呈现明显的逐年下降趋势。
但是,事业单位制检验检测机构的绝对数量并无明显下降,仍然维持在1.1万家左右,表明检验检测领域的事业单位改革进展缓慢。
(二)检验检测机构集约化发展势头显著,规模以上机构数量稳步增长。
2018年,全国检验检测服务业中,规模以上(年收入丨〇〇〇万元以上)检验检测机构数量达到5051家,营业收入达到2148.8亿元。
四川省药品监督管理局关于2018年度监测工作考核情况的通报文章属性•【制定机关】四川省药品监督管理局•【公布日期】2019.01.03•【字号】•【施行日期】2019.01.03•【效力等级】地方规范性文件•【时效性】现行有效•【主题分类】行政法总类其他规定正文四川省药品监督管理局关于2018年度监测工作考核情况的通报各市(州)食品药品监督管理局:根据《2018年市(州)监测工作考核标准的通知》(川药监测〔2018〕31号)和《2018年市(州)监测机构药物滥用监测工作考核标准的通知》(川药监测〔2018〕42号)要求,对全省21个市(州)药品、医疗器械及化妆品不良反应(事件)及药物滥用监测工作进行了考核。
现将监测工作考核情况及考核成绩突出的单位和个人(见附件)通报如下。
一、各项监测工作考核情况(一)药品不良反应监测工作2018年药品不良反应监测工作考核得分90分以上的市为:成都、南充、德阳、乐山、巴中、攀枝花、泸州、资阳、内江,考核得分60分以下的市(州)为:阿坝、广安、甘孜,泸州、资阳、内江3个市进步较大。
详见表1。
表1:各市(州)2018年药品不良反应监测工作考核结果(二)医疗器械不良事件监测工作2018年医疗器械不良事件监测工作考核得分90分以上的市为:南充、德阳、资阳、成都、泸州,考核得分60分以下的市(州)为:阿坝、巴中、达州、甘孜、广安,泸州、宜宾2个市进步较大。
详见表2。
表2:各市(州)2018年医疗器械不良事件监测工作考核结果(三)化妆品不良反应监测工作2018年化妆品不良反应监测工作考核得分90分以上的市为:南充、泸州、宜宾、德阳、成都,考核得分60分以下的市(州)为:阿坝、达州、遂宁、广安、甘孜,成都、资阳2个市进步较大。
详见表3。
表3:各市(州)2018年化妆品不良反应监测工作考核结果(四)药物滥用监测工作情况2018年药物滥用监测工作考核得分90分以上的市(州)为:凉山、成都、德阳、南充、眉山、攀枝花、巴中、乐山,考核得分60分以下的市(州)为:阿坝。