第二章有机化合物的化学键
- 格式:ppt
- 大小:1011.00 KB
- 文档页数:57

(汪小兰)有机化学第四版课后答案完全版《有机化学第四版》是一本权威的化学教材,深入浅出地介绍了有机化学的基本原理与应用。
课后习题是帮助学生巩固知识、提高运用能力的重要辅助材料。
下面是《有机化学第四版》课后答案的完全版,共3000字。
第一章:有机化学与有机化合物1. 有机化学是研究碳元素的化合物的科学。
有机化合物中的碳原子通常与氢、氧、氮、卤素等元素形成合键。
有机化学主要关注有机化合物的结构、性质和反应。
有机化学在石油炼制、药物合成、材料科学等领域具有重要的应用价值。
2. 有机化合物的命名通常采用结构命名法、系统命名法和常用命名法。
结构命名法是指根据有机化合物的结构式来命名。
系统命名法是根据化合物中含有的官能团来命名。
常用命名法是根据化合物的常用名称来命名。
3. 有机物的结构可分为线性、分支、环状和立体异构体。
线性结构是指分子中的原子按照直线排列。
分支结构是指分子中的原子按照支链的方式排列。
环状结构是指分子中的原子形成环状结构。
立体异构体是指化合物的空间结构不同。
4. 有机化合物的活性主要取决于其官能团。
常见的官能团包括醇、醛、酮、酸、酯、酰氯、酰胺等。
每种官能团都有其特定的性质和反应。
5. 有机化合物的性质与其分子结构有关。
分子中的原子的电性和键的键能决定了化合物的物理性质。
分子的极性和分子量也对物理性质有一定影响。
6. 有机化合物的化学反应主要包括取代反应、加成反应、消除反应和重排反应。
取代反应是指一个官能团被另一个官能团取代。
加成反应是指两个或多个分子结合形成一个新的分子。
消除反应是指一个分子中的原子或基团被移除,形成一个双键或三键。
重排反应是指分子中的原子或基团的位置发生变化。
7. 有机化学是一个广泛应用于生物化学、药物化学、材料科学等领域的学科。
通过有机化学的研究,人们可以合成新的药物、开发新的材料,提高生产效率,改善生活质量。
第二章:有机化合物的化学键与分子构象1. 有机化合物的化学键主要有共价键、极性键和离子键。







第二章有机化合物的结构理论从有机化合物的分类方法中,可以看出同分异构现象在有机化学中占有相当重要的地位。
同分异构体有相同数目相同种类的原子,但原子间连接的次序和空间取向不同,即结构上的不同使分子式一样的化合物包含着不同的化合物组成。
因此,有机化学的学习研究必须从结构上着手才能抓住本质而不致误入歧途。
结构问题如得不到正确认识和解决,那就像Wohler在1835年所说的:“有机化学是充满最特殊事物的热带丛林,却又是一个恐怖的无边际的丛林,无人敢进去,因为相像的找不到出路。
”不解决结构问题,就不可能学习研究有机化学和有机化合物本身。
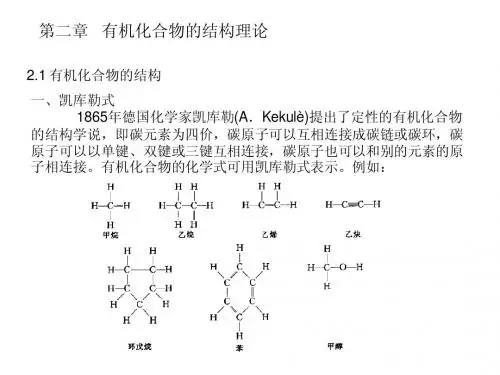
1857年,Kekule指出每一种原子都有一定的化合力,这种化合力就是价,碳原子的价为四价。
可以说有机化学的结构学说就是在此基础是发展起来的。
1913年,Bohr提出的原子结构理论,产生了原子价的电子学说,标志着经典的结构理论已经过渡到结构的电子理论了。
形成分子的驱动力是因为分子比原子稳定,原子形成分子后能量得到释放。
分子中化学键的形成使体系能量降低,而化学键的断裂总是需要吸收能量。
但是,原子又是如何结合起来才形成分子的呢?要正确回答这个问题就比较困难了。
1917年Kossel和Lewis分别提出,化学键由电子组成,可分为离子键和共价键两大类。
反应时,原子将失去或得到电子,使结构接近惰性气体的结构。
化学变化仅仅涉及核外的电子即价电子的反应,表示键的短线即是一对成对电子,这些观点已经成为现代价键理论的基础。
1926年,Schrodinger等提出了说明原子结构中的电子运动的量子力学理论,而绝大多数化学家都运用了Schrodinger的波动方程理论,使我们对有机化合物结构问题的探索和了解也具有了现代量子理论基础。
2.1 原子轨道描述原子中单个电子运动状态的波函数叫做原子轨道(atomic orbital)。
例如氢原子,若将原子核定为坐标原点,则单个电子在空间运动状态可由正坐标系x,y,z或球极坐标系r,θ,φ来确定。
第二章分子结构与性质第一节共价键基础讲解(第一课时)学习过程[引入]NaCl、HCl的形成过程前面学习了电子云和轨道理论,对于HCl中H、Cl原子形成共价键时,电子云如何重叠?例:H2的形成结论1、共价键是常见化学键之一,它是指其本质是成键原子相互接近时,——————发生重叠,————方向相反的————电子形成共用电子对,两原子核间的电子云密度增加,体系能量降低2形成条件⑴——————————————————⑵————————————————⑶————————————————3成键原因:4类型;㈠根据电子云重叠情况分类1、δ键:(以“”重叠形式)a、特征:b、种类:S-S δ键、 S-P δ键、 P-Pδ键P电子和P电子除能形成δ键外,还能形成π键2、π键[讲解]a.特征:每个π键的电子云有两块组成,分别位于有两原子核构成平面的两侧,如果以它们之间包含原子核的平面镜面,它们互为镜像,这种特征称为镜像对称。
3、δ键和π键比较①重叠方式:δ键:;π键:②δ键比π键的强度较大成键电子:δ键s-s、、π键δ键成键π键成键或键4、判断δ键和π键的一般规律是:共价单键是键;而共价双键中有个δ键,共价三键中有个δ键,其余为π键。
㈡根据电子云是否偏移分类5.共价键的特征:性、性6 共价键的存在7 共价化合物[小结]【案例练习】1、下列各组物质中,所有化学键都是共价键的是()A.H2S和Na2O2 B.H2O2和CaF2 C.NH3和N2 D.HNO3和NaCl2.对δ键的认识不正确的是()A.δ键不属于共价键,是另一种化学键B.S-Sδ键与S-Pδ键的对称性相同C.分子中含有共价键,则至少含有一个δ键D.含有π键的化合物与只含δ键的化合物的化学性质不同3、乙烯分子中C-C之间有个σ键,个π键。
乙烯易发生加成反应是因为分子中C-C之间的一个键易断裂。
【课后作业】1、下列分子中存在π键的是()A.H2 B.Cl2 C.N2 D.HCl2、下列说法中,正确的是A.在N2分子中,两个原子的总键能是单个键能的三倍B.N2分子中有一个σ键、两个π键C.N2分子中有两个个σ键、一个π键D.N2分子中存在一个σ键、一个π键3、下列分子中,含有非极性键的化合物的是A.H2 B.CO2 C.H2O D.C2H44、在HCl分子中,由H原子的一个轨道与Cl原子的一个轨道形成一个键;在Cl2分子中两个Cl原子以轨道形成一个键。