新教材高中化学第二章化学键化学反应规律第一节化学键与物质构成学案鲁科版必修第二册5065
- 格式:doc
- 大小:451.00 KB
- 文档页数:14

必修二第二章第一节化学键与化学反应一、复习思考:1.在化学反应中,不仅有变化,还伴随着变化。
2. 叫化学键。
化学反应中物质变化的实质是。
3.共价键的定义是。
4.离子键的定义是。
5.完成课本的表格。
6. 叫离子化合物。
如。
7. 叫共价化合物。
如。
二、共价键离子键对比共价键的成键原因:成键方式:成键微粒:成键元素:离子键的成键原因:成键方式:成键微粒:成键元素:共价键、离子键、共价化合物、离子化合物之间的关系。
21世纪教育网【典题解悟】例1.下列关于化学键的叙述正确的是()A. 化学键既存在于相邻原子之间,又存在与相邻分子之间B. 两个原子之间的相互作用叫化学键C. 化学键通常指的是相邻的两个或多个原子之间的强相互作用D. 阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小例2. 下列化合物分子内只有共价键的是()A. BaCl2B. NaOHC. (NH4)2SO4D. H2SO4三、化学反应中的能量变化1.从化学键的角度分析,一个化学反应满足什么条件时吸收能量(释放能量)?2. 化学反应中的能量变化通常主要表现为。
常见放热反应有哪些类型?常见吸热反应有哪些类型?试举例说明。
3.化学反应中(填“一定”或“不一定”,下同)有新物质生成,有能量的变化,有化学键的变化。
释放能量的反应不需要外界条件,吸收能量的反应需要外界条件。
化学反应中生成物“储存”的能量比反应物“储存”的能量高。
离子键在形成过程中有电子的得失,共价键在形成过程中发生共用电子对的偏移,共价化合物中不含离子键,离子化合物中不含共价键。
4.多角度认识化学反应过程(1)从原子与分子角度:。
(2)从化学键的角度:化学反应是(3)从能量变化的角度:化学反应总是伴随着例1. 下列说法中正确的是()A. 物质发生化学反应都伴随着能量变化B. 伴有能量变化的物质变化都是化学变化C. 在一个确定的化学反应关系中,反应物的总能量与生成物的总能量一定不同D. 一个确定的化学反应关系中,反应物的总能量总是高于生成物的总能量例2. 下列反应中属于吸热反应的是()①液态水汽化②将明矾加热变为白色粉末③浓硫酸稀释④氯酸钾分解制氧气⑤生石灰跟水反应生成熟石灰A. ①④B. ②③C. ①④⑤D. ②④【当堂检测】1.下列物质中,含有共价键的化合物是()A.碘化氢B.烧碱C.液溴D.氯化钠2.下列变化过程中,共价键被破坏的是()A.冰变成水B.氯化氢气体溶于水C.乙醇溶于水D.溴蒸气被木炭吸附3.下列分子中,所有原子都外层8电子结构的是()A.H2B.H2OC.CO2D.CH44. 下列各组物质中,两种物质所含化学键类型不同的是()。

第1节⎪⎪化学键与化学反应 第1课时化学键与化学反应中的物质变化[课标要求]1.了解化学键的含义,认识离子键、共价键的形成过程与形成条件。
2.了解化学键类型与物质构成的关系,以某一化学反应为背景,学习化学键,从而更好地认识物质构成和化学反应的本质。
3.使学生初步学会从分子、原子的微观角度认识化学变化的实质,培养学生善于思考、勤学好问、勇于探索的优秀品质。
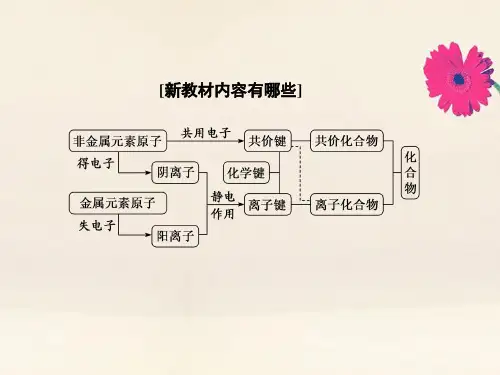
1.相邻原子间的强相互作用称为化学键。
2.原子间通过共用电子形成的化学键叫做共价键。
3.阴、阳离子之间通过静电作用形成的化学键叫做离子键。
4.只含共价键的化合物叫共价化合物。
5.含有离子键的化合物叫离子化合物,其中可能含有共价键。
6.化学反应的实质是旧化学键断裂和新化学键形成的过程。
化学键与物质变化 共价键和离子键1.化学键与物质变化(1)化学键:相邻原子间的强相互作用。
(2)化学反应的实质:化学反应的过程,就是旧化学键的断裂和新化学键的形成。
(3)实例化学反应 断裂的键 形成的键 2H 2+O 2=====点燃2H 2OH —H 、O===OH —OH 2+Cl 2=====点燃2HCl H —H 、Cl —Cl H —Cl N 2+3H 2高温、高压催化剂2NH 3N ≡N 、H —HN —H[特别提醒]①化学键中的相互作用是“吸引〞和“排斥〞相平衡的一种结果,不能理解为相互吸引。
②相互作用达到一定强度才能看作化学键。
2.共价键和离子键 (1)电子式 ①定义:由元素符号和用于表示该元素原子最外层电子的“·〞或“×〞组成的式子叫电子式。
例如:氢原子 氯原子 氧原子 钠原子 镁原子 ②化合物电子式的表示方法:③用电子式表示共价型分子的形成过程:(2)共价键①定义:原子间通过共用电子形成的化学键。
②形成过程③共价键实例:在H2分子中存在氢氢键;在Cl2分子中存在氯氯键;在CO2分子中存在碳氧键。
(3)离子键①定义:阴、阳离子之间通过静电作用形成的化学键。

第1节化学键与物质构成夯实基础轻松达标1.下列物质中含有离子键且阴离子与阳离子数目比为1∶2的是()A。
CaO B。
Na2O2C。
KF D.NaHCO3中含有离子键,阴离子与阳离子数目比为1∶1,A项错误;Na2O2含有离子键,由钠离子与过氧根离子构成,阴离子与阳离子数目比为1∶2,B项正确;KF含有离子键,阴离子与阳离子数目比为1∶1,C项错误;NaHCO3含有离子键,阴离子与阳离子数目比为1∶1,D项错误。
2。
下列有关KOH的说法错误的是()A。
是离子化合物B。
含有共价键C.溶于水后离子键会断裂D.OH-的电子数、质子数均为10是强碱,属于离子化合物,故A正确;KOH中含有氢氧根离子,其中含有共价键,故B正确;KOH溶于水发生电离生成钾离子和氢氧根离子,离子键发生断裂,故C正确;OH-的电子数为10,质子数为9,故D错误.3。
下列表达方式正确的是()A。
×Mg×+2·Mg2+[]—[]-B。
质子数为17、中子数为20的氯原子ClC.Na2O的电子式:Na+[]2—Na+D.NH4Cl的电子式:[HH]+Cl—解析F-的电子式应分布在Mg2+两边,用电子式表示MgF2的形成过程为,故A错误;根据原子表示形式,左下角为质子数,左上角为质量数,即该氯原子为Cl,故B错误;Na2O为离子化合物,电子式为Na+[]2-Na+,故C正确;没有表示出Cl—最外层电子,正确的电子式为[HH]+[]—,故D错误。
4。
下列物质中含有共价键的离子化合物是()①MgF2②Na2O2③NaOH④NH4Cl⑤CO2⑥H2O2⑦Mg3N2A.①③④⑦B。
②③④C.①②③④⑦D.③④⑥MgF2为离子化合物,只含有离子键;②Na2O2为离子化合物,中氧原子间以共价键结合;③NaOH为离子化合物,OH-中氧原子和氢原子以共价键结合;④NH4Cl为离子化合物,N中氮原子和氢原子间以共价键结合;⑤CO2为共价化合物;⑥H2O2为共价化合物;⑦Mg3N2为离子化合物,只含有离子键.综上所述,B正确。



第二章《化学键化学反应与能量》第1节《化学键与化学反应》学习目标:1.了解化学键的定义。
2.了解离子键、共价键的形成。
3.了解化学反应中能量转化的原因,能说出常见的能量转化形式。
一.化学键与化学反应中的物质变化1.化学键与物质变化化学键的定义:。
注意:①是直接相邻的原子②是强烈的相互作用练习:完成下列表格化学反应断裂的键形成的键2H2 +O2 ==2H2OH2+Cl2==2HClN2+3H2==2NH3从化学键的角度,化学反应的实质是。
2.化学键的类型氢气和氯气在形成氯化氢的过程中,都有达到稳定结构的趋势,氢稳定的核外电子排布是最外层个电子,氯的稳定结构是最外层个电子。
氯和氢通过的形式都达到稳定结构,氢和氯原子通过形成化学键。
共价键:通过形成的化学键。
钠和氯气在形成氯化钠的过程中,都有达到稳定结构的趋势,钠稳定的核外电子排布是最外层个电子,氯的稳定结构是最外层电子,钠原子失去1个电子变为,达到8电子稳定结构,氯原子得到1个电子变为,达到8电子稳定结构,钠离子和氯离子通过形成化学键。
离子键:之间通过形成的化学键。
离子键共价键概念成键粒子成键实质形成条件举例比较:离子键和共价键的区别和联系练习1:指出构成下列物质的微粒和化学键类型物质形成化学键的微粒化学键类型Cl2NH3NaClMgCl2C a OCO2氢氧化钠氯化铵练习2:(1)在水的三态变化中,H2O 中H—O是否有变化?(2)将氯化钠晶体研成粉末,离子键有什么变化?(3)将HCl、NaCl分别溶于水,化学键有什么变化?3.离子化合物和共价化合物离子化合物:。
如:等;共价化合物:。
如:等。
例题:KOH、NH4Cl 中所含有键,它们分别属于化合物。
总结:(1)当一种化合物中存在时,该化合物是离子化合物;(2)当化合物中只.存在时,该化合物才称为共价化合物。
练习:指出下列化合物属于离子化合物还是共价化合物。
化合物化合物类型硫酸钡二氧化硅NaOH氧化钠C2H5OHH2SO4硫酸钠硝酸铵三氧化硫化学键与物质的性质的关系:氯化钠的熔点较高,是因为。


第1课时化学键与化学反应中的物质变化[学习目标] 1.了解化学键的定义,了解化学反应变化的实质,学会从微观角度认识化学反应。
2.了解共价键和离子键的定义及形成过程,会用电子式表示共价键和离子键的形成过程。
3.明确化学键类型与物质类别之间的关系,学会判断物质中的化学键。
一、化学键与物质变化共价键和离子键[自主学习]1.化学键与物质变化02强相互作用称为化学键。
(1)化学键的概念:□01相邻原子间的□(2)化学反应中物质变化的实质:□03旧化学键断裂和□04新化学键形成。
05共价键、□06离子键等。
(3)化学键的分类:化学键包括□08最外层电子的“·”或“×”组成的式子叫(4)由□07元素符号和用于表示该元素原子□电子式。
2.共价键(以HCl为例)(1)形成过程示意图(2)用电子式表示形成过程:。
(3)概念:□10原子间通过□11共用电子形成的化学键。
(4)构成微粒:□12原子。
(5)成键元素:一般情况下,□13非金属元素原子间形成共价键。
3.离子键(以NaCl为例)(1)形成过程示意图(2)用电子式表示形成过程:□14。
(3)概念:阴、阳离子之间通过□15静电作用形成的化学键。
(4)构成微粒:□16阴离子、阳离子。
(5)成键元素:一般情况下,□17活泼金属元素原子与□18活泼非金属元素原子间易形成离子键。
4.微粒间的相互作用(1)强相互作用⎩⎪⎨⎪⎧离子键共价键金属键配位键(2)弱相互作用:分子间作用力。
1.任何物质内部都存在化学键吗?提示:不一定。
如稀有气体元素的原子都具有稳定的电子层结构,所以稀有气体元素的原子间不存在化学键。
2.有化学键的断裂或形成就一定是化学反应吗?举例说明。
提示:不一定。
化学反应物质变化的实质是旧化学键的断裂和新化学键的形成。
只有化学键的断裂,没有化学键的形成不是化学变化;只有化学键的形成,没有化学键的断裂也不是化学变化。
如NaCl溶于水发生电离:NaCl===Na++Cl-,NaCl中的离子键发生断裂,但没有新化学键的形成,因此不属于化学变化。

《鲁科版化学必修2》第2章化学反应与能量【教材分析】通过初中化学的学习,学生已经知道原子可结合成分子、原子失去或得到电子后可以变成离子、离子可结合成物质、但不知道原子是怎样结合成分子的,离子是怎样结合成物质的;已知道化学反应过程中会发生物质的变化,但不知道变化的实质。
已知燃烧是化学变化,物质燃烧要释放能量,但不知道化学反应中为什么会伴随能量变化。
化学键概念的建立为学生从原子、分子水平认识物质的构成和化学反应打开了一扇窗,而深入研究和利用化学反应又是认识化学反应实质的基础。
本节教材以“化学键”为桥梁,引导学生从物质变化和能量变化两个角度认识化学反应,为后面研究化学反应的利用奠定基础。
【课时计划】3课时第1课时:化学键与化学反应中的物质变化第2课时:化学键与物质结构第3课时:化学键与化学反应中的能量变化【知识框架】【教学目标】1.知识技能目标:①了解化学键的含义,认识离子键、共价键的形成过程与形成条件;②了解化学键类型与物质构成的关系,以某一化学反应为背景,学习化学键,从而更好的认识物质构成和化学反应的本质;③通过了解化学反应中物质变化和能量变化的实质,使学生初步学会如何从微观的角度认识化学反应。
2 .能力方法目标:结合对化学键、离子键、共价键的教学,用讨论、猜想、对比的方法理解化学键类型、化学键与物质构成及能量关系,从而培养学生的获取和处理信息的能力,分析比较、归纳推理能力以及想象能力。
3 .情感态度与价值观:通过本节学习,使学生初步学会从分子、原子的微观角度认识化学变化的实质,培养学生善于思考,勤学好问,勇于探索的优秀品质。
通过生产生活中的实例,了解化学能与热能的相互转化,认识提高燃料的燃烧效率,开发高能清洁能源的重要性,培养学生节约能源及保护环境的意识,【教学方法】讨论法、猜想法、探究法、分析推理法、对比归纳等方法【教学重点、难点】化学键、离子键、共价键的含义和对化学反应的理解。
【教学媒介】多媒体教学课件(含图片资料)【教学程序】第1课时:化学键与化学反应中的物质变化第2课时:化学键与物质结构第3课时:化学键与化学反应中的能量变化练一练:1、下列反应中,属于属于吸热反应的是()A.实验室制H2的反应B.实验室制CO2的反应C.水的分解反应D.石灰石分解的反应2、下列说法不正确的是()A.化学反应除了生成新物质外,还伴随着能量的变化B.物质燃烧和中和反应均放出热量C.分解反应肯定是吸热反应D.化学反应是吸热还是放热决定于生成物具有的总能量和反应物具有的总能量3.金刚石和石墨都是碳的单质,石墨在一定条件下可以转化为金刚石。
章末整合提升一、化学键与物质构成1.离子键、共价键的存在(1)一般来说,活泼的金属元素和活泼的非金属元素之间形成的是离子键,非金属元素原子之间形成的是共价键。
(2)AlCl3虽然是由金属元素和非金属元素组成的,但存在的是共价键而不是离子键。
(3)两种非金属元素原子之间不能形成离子键,三种及以上可以形成离子键。
(4)NH4Cl、NH4NO3等铵盐中不含金属元素,但存在离子键。
2.离子化合物、共价化合物的区别(1)离子化合物中一定含有离子键,可能含有共价键。
(2)共价化合物中只有共价键,没有离子键。
(3)可通过检验熔融的化合物能否导电检验物质是离子化合物还是共价化合物,离子化合物在熔融时能导电,共价化合物则不能。
【针对训练】1.下表中的物质与其所含化学键类型、所属化合物类型完全对应的一组是( )2价键,是共价化合物。
D项,NaOH是离子化合物。
2.下列物质中只含有共价键的一组是( )A.NaCl、HCl、H2O、NaOHB.Cl2、Na2S、HCl、SO2C.HBr、CO2、H2O、CS2D.Na2O2、H2O2、H2O、O3解析:选C。
A项,NaCl中只含有离子键,HCl、H2O中只含有共价键,NaOH中既有离子键又有共价键;B项,Cl2、HCl、SO2中只含有共价键,而Na2S中只含有离子键;D项,Na2O2中既含有离子键又含有共价键,H2O2、H2O、O3中只含有共价键。
二、一般电极反应式的书写思路【针对训练】3.(·上饶第二中学高一期中)原电池是将化学能转化为电能的装置。
下列关于如图所示原电池的说法正确的是( )A.Cu为负极,Zn为正极B.电子由铜片通过导线流向锌片C.正极反应式为Zn-2e-===Zn2+D.该原电池工作一段时间后,溶液的酸性减弱解析:选D。
原电池中活泼金属做负极,不活泼金属或导电非金属做正极,则Cu为正极,Zn为负极,A错误;原电池中电子由负极流向正极,所以由锌片通过导线流向铜片,B错误;在正极的铜表面上H+得到电子生成H2,C错误;在正极铜表面H+得到电子生成H2,使溶液中c(H+)减小,溶液的酸性减弱,D正确。
第1节化学键与物质构成课程标准核心素养1.认识构成物质的微粒之间存在相互作用,结合典型事例认识离子键和共价键的形成,建立化学键的概念。
2.认识旧化学键断裂和新化学键形成是化学反应的实质。
3.能判断简单离子化合物和共价化合物中的化学键类型。
1.宏观辨识能运用模型、符号等多种方式对物质的结构及其变化进行综合表征。
2.变化观念能运用宏观、微观、符号等方式描述、说明物质转化的本质和规律。
化学键离子键和共价键1.化学键(1)化学键:相邻原子间的强相互作用。
(2)化学反应的实质是旧化学键断裂和新化学键形成。
化学键的断裂与形成伴随着能量的变化,旧化学键断裂需要吸收能量,新化学键形成会释放能量。
2.离子键和共价键(1)离子键①定义:阴、阳离子之间通过静电作用形成的化学键。
②成键微粒:阴、阳离子。
③作用实质:静电作用。
④形成过程(以NaCl的形成为例)⑤实例:在KCl晶体中,K+与Cl-之间存在离子键;在MgCl2晶体中,Mg2+与Cl-之间存在离子键;在CaO晶体中,Ca2+与O2-之间存在离子键。
(2)共价键①定义:原子之间通过共用电子形成的化学键。
②成键微粒:原子。
③作用实质:共用电子。
④形成过程(以HCl的形成为例)⑤实例:在H2分子中存在氢氢键;在Cl2分子中存在氯氯键;在CH4分子中存在碳氢键;在CO2分子中存在碳氧键。
3.电子式(1)定义:一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
如H:·H;Na:·Na;Cl-。
(2)用电子式表示物质的形成过程1.离子键与共价键的比较离子键共价键成键实质阴、阳离子之间的静电作用原子之间通过共用电子形成成键元素一般是活泼金属元素和活泼非金属元素一般是非金属元素成键微粒阴、阳离子原子成键条件活泼金属与活泼非金属化合时,易发生电子的得失形成离子键非金属元素的原子最外层电子未达到饱和状态,相互间通过共用电子形成共价键影响因素离子半径越小,离子所带电荷数越多,离子键越强原子半径越小,共用电子数越多,共价键越强形成过程举例(用电子式表示)Na2O:外电子与核外电子的相互排斥。
第1节化学键与物质构成课程标准核心素养1.认识构成物质的微粒之间存在相互作用,结合典型事例认识离子键和共价键的形成,建立化学键的概念。
2.认识旧化学键断裂和新化学键形成是化学反应的实质。
3.能判断简单离子化合物和共价化合物中的化学键类型。
1.宏观辨识能运用模型、符号等多种方式对物质的结构及其变化进行综合表征。
2.变化观念能运用宏观、微观、符号等方式描述、说明物质转化的本质和规律。
化学键离子键和共价键1.化学键(1)化学键:相邻原子间的强相互作用。
(2)化学反应的实质是旧化学键断裂和新化学键形成。
化学键的断裂与形成伴随着能量的变化,旧化学键断裂需要吸收能量,新化学键形成会释放能量。
2.离子键和共价键(1)离子键①定义:阴、阳离子之间通过静电作用形成的化学键。
②成键微粒:阴、阳离子。
③作用实质:静电作用。
④形成过程(以NaCl的形成为例)⑤实例:在KCl晶体中,K+与Cl-之间存在离子键;在MgCl2晶体中,Mg2+与Cl-之间存在离子键;在CaO晶体中,Ca2+与O2-之间存在离子键。
(2)共价键①定义:原子之间通过共用电子形成的化学键。
②成键微粒:原子。
③作用实质:共用电子。
④形成过程(以HCl的形成为例)⑤实例:在H2分子中存在氢氢键;在Cl2分子中存在氯氯键;在CH4分子中存在碳氢键;在CO2分子中存在碳氧键。
3.电子式(1)定义:一种由元素符号和用于表示该元素原子最外层电子的“·”或“×”组成的式子。
如H:·H;Na:·Na;Cl-。
(2)用电子式表示物质的形成过程1.离子键与共价键的比较离子键共价键成键实质阴、阳离子之间的静电作用原子之间通过共用电子形成成键元素一般是活泼金属元素和活泼非金属元素一般是非金属元素成键微粒阴、阳离子原子成键条件活泼金属与活泼非金属化合时,易发生电子的得失形成离子键非金属元素的原子最外层电子未达到饱和状态,相互间通过共用电子形成共价键影响因素离子半径越小,离子所带电荷数越多,离子键越强原子半径越小,共用电子数越多,共价键越强形成过程举例(用电子式表示)Na2O:外电子与核外电子的相互排斥。
(2)只由非金属元素也可以形成离子键,如NH 4Cl;金属元素与非金属元素间也可以形成共价键,如AlCl3。
(3)稀有气体单质中不存在化学键。
2.电子式的书写(1)原子的电子式:常把最外层电子用“·”或“×”来表示。
以第3周期元素的原子为例:(2)简单阳离子的电子式:即阳离子符号,如Na+、Ba2+等。
(3)简单阴离子的电子式:原子得到电子后形成电子排布与稀有气体元素相同的稳定结构,这时不但要画出最外层电子,而且还应用中括号“[ ]”括起来,并在右上角标出“n-”字样,如。
(4)原子团的电子式:不仅要画出各原子最外层电子,而且还应用中括号“[ ]”括起来,并在右上角标出“n+”或“n-”字样,如铵根离子:;氢氧根离子:。
(5)含有离子键的化合物的电子式:由阴、阳离子的电子式组合而成,但相同的离子不能合并,如1.判断正误(1)任何化合物中都存在化学键。
( )(2)氯化氢中存在共价键。
( )(3)化学键一定存在于化合物中。
( )(4)金属元素与非金属元素原子间一定形成离子键。
( )(5)Na2O2的电子式为。
( )答案:(1)√(2)√(3)×(4)×(5)×2.下列物质中,既含有离子键又含有共价键的是( )A.CO2B.KOHC.MgCl2D.Na2O解析:选B。
CO2中只含有共价键,A错误;KOH中含有离子键和共价键,B正确;MgCl2中只含有离子键,C错误;Na2O中只含有离子键,D错误。
3.根据你对化学反应中物质变化的实质的理解,你认为下列变化属于化学变化的是( )A.氯化氢气体溶于水B.白磷在一定条件下转化为红磷C.碘在加热条件下升华D.氯化钠熔化解析:选B。
抓住“旧键断、新键成”是化学反应中物质变化的实质这一信息分析,A、D 项均无“新键成”,C项既无“旧键断”,也无“新键成”,所以只有B项符合题意。
4.(1)写出下列物质的电子式。
H2:____________________;CO2:__________________;CCl4:________________;Na2O2:________________;KOH:________________;H2O2:__________________。
(2)用电子式表示下列物质的形成过程。
①N2:_________________________________________________________;②CaBr2:______________________________________________________;③KF:___________________________________________________________。
答案:5.下列物质中:①N2、②H2O、③Na2O2、④CaCl2、⑤KHS、⑥NaF、⑦NaOH、⑧SiO2、⑨He、⑩CO2,其中只含有共价键的物质是________;只含有离子键的物质是________;既含有离子键,又含有共价键的物质是________;不存在化学键的物质是________。
答案:①②⑧⑩④⑥③⑤⑦⑨离子化合物与共价化合物1.离子化合物(1)定义:由阳离子与阴离子构成的化合物。
(2)物质类别:一般包括活泼金属氧化物、强碱及绝大多数盐等。
2.共价化合物(1)定义:由原子通过共价键构成的化合物。
(2)物质类别:一般包括非金属氧化物、非金属氢化物、酸、大多数有机化合物等。
3.化学键与物质性质(1)化学键与熔、沸点之间的关系①有些物质熔化时,需要破坏化学键,消耗较多的能量,所以它们的熔、沸点较高,如氯化钠、金刚石、二氧化硅等。
②有些物质熔化时,不需要破坏化学键,消耗较少的能量,所以它们的熔、沸点较低,如氧气、氮气、一氧化碳等。
(2)化学键与物质的稳定性的关系有些物质中的化学键很强,很难被破坏,化学性质很稳定,如氮气等。
(3)极性键与非极性键不同元素的两个原子形成共价键时,它们吸引共用电子的能力不同,共用电子将偏向吸引电子能力较强的一方,所形成的共价键是极性共价键,简称极性键。
同种元素的两个原子形成共价键时,它们吸引共用电子的能力相同,所形成的共价键是非极性共价键,简称非极性键。
1.化学键与物质类别物质⎩⎪⎨⎪⎧单质⎩⎨⎧单原子稀有气体分子——无化学键⎭⎪⎬⎪⎫双原子非金属单质分子多原子非金属单质分子共价键化合物⎩⎪⎨⎪⎧离子化合物——一定含有离子键,可能含有共价键共价化合物——只含有共价键2.离子化合物和共价化合物的比较类型 离子化合物 共价化合物 构成 微粒 阴、阳离子原子化学键 类型一定含有离子键,可能含有共价键只含有共价键 与物质 类别的 关系①强碱 ②绝大多数盐 ③活泼金属氧化物①所有的酸②弱碱 ③气态氢化物 ④非金属氧化物 ⑤大多数有机物主要物 理性质①室温下为固体,熔、沸点较高,硬度较大②固态不导电,熔融态和溶于水后导电①多数在室温下是气体或液体,少数是固体,熔、沸点和硬度差异较大 ②熔融态不导电,某些溶于水后导电1.下列说法正确的是( )A .金刚石、H 2、O 2等物质中均存在共价键,它们均是共价化合物B .含有离子键的化合物是离子化合物C .含有共价键的化合物是共价化合物D.只含有共价键的物质一定是共价化合物解析:选B。
A项中物质均是单质,A错;NaOH中含有共价键,但它是离子化合物,C错;多数非金属单质中只含有共价键,但它们不是化合物,D错。
2.下列各组元素只能形成共价化合物的是( )A.C、H、O B.K、Mg、ClC.N、Cl、H D.Na、S、Ba解析:选A。
根据元素类别和形成化学键的条件分析,A项中只能形成共价化合物;B项中为ⅠA族、ⅡA族的金属元素和ⅦA族的非金属元素,只能形成离子化合物;C项中既可形成共价化合物,如HCl、NH3,又可形成离子化合物,如NH4Cl;D项中只能形成离子化合物。
3.依据物质的下列性质能确定该物质为离子化合物的是( )A.水溶液能导电的化合物B.由金属元素和非金属元素组成的化合物C.在熔融状态下能导电的化合物D.熔点高的物质解析:选C。
A项,共价化合物在水溶液中也可能导电,如HCl;B项,一般由活泼金属元素和活泼非金属元素组成的化合物为离子化合物,而某些金属性较弱的金属元素与非金属元素形成的化合物可能为共价化合物,如AlCl3;C项,共价键在熔融状态下不断裂,在熔融状态下能导电的化合物一定是离子化合物;D项,熔点高的物质可能不是化合物,如石墨,也可能是共价化合物,如SiO2。
4.根据定义判断以下物质的类别:NaNO3、HNO3、CaO、SO2、H2S、Ca(OH)2。
(1)属于离子化合物的是____________________________;(2)属于共价化合物的是_______________________________________。
答案:(1)NaNO3、CaO、Ca(OH)2(2)HNO3、SO2、H2S合格考训练1.从化学键变化的观点看,下列变化中化学键被破坏但不属于化学变化的是( ) A.蔗糖溶于水B.金刚石变成石墨C.氯化钠熔化D.五氧化二磷吸水解析:选C。
蔗糖溶于水属于物理变化,既没有旧键的断裂,也没有新键的形成;金刚石变成石墨,实质上是金刚石中的碳碳键发生断裂,又形成了石墨中新的碳碳键,前后的碳碳键并不完全相同,故属于化学变化;氯化钠熔化只有旧键的断裂而没有新键的形成,属于物理变化;五氧化二磷吸水后变为磷酸,既有旧键的断裂又有新键的形成,属于化学变化。
2.下列叙述中正确的是( )A.使阴、阳离子结合成化合物的静电引力叫作离子键B.只有活泼金属与活泼非金属之间才能形成离子键C.氯气与NaOH反应过程中,只有离子键的断裂与形成D.离子所带电荷的符号和数目与原子成键时得失电子有关解析:选D。
离子键是一种静电作用,这种作用包括静电引力,同时也包括原子核间及电子间的斥力,选项A错误;构成离子键必须有阴、阳离子,但阴、阳离子不一定只是活泼非金属与活泼金属,也可以是带电的原子团(如NH4Cl),选项B错误;Cl2与NaOH反应的化学方程式为2NaOH+Cl2===NaCl+NaClO+H2O,反应过程中既有离子键的断裂与形成,又有共价键的断裂与形成,选项C错误;离子的形成是得失电子的结果,离子所带电荷的多少与得失电子数目的多少有关,选项D正确。
3.某元素的原子最外层只有一个电子,它与卤素结合时,所形成的化学键( )A.一定是离子键B.一定是共价键C.可能是离子键,也可能是共价键D.以上说法都不正确解析:选C。