PALL 完整性检测讲座
- 格式:ppt
- 大小:960.00 KB
- 文档页数:40

数据完整性检查要点数据完整性数据完整性(data integrity):是指数据的准确性和可靠性,用于描述存储的所有数据值均处于客观真实的状态。
–并不是计算机化系统实施后才出现的–适用于电子数据和手工(纸质)数据–企业应当处于一种基于数据完整性风险的可接受控制状态数据的属性基本原则A(attributable)—可溯源L(legible)—清晰C(contemporaneous)—同步O(original or true copy)—原始或真实复制A(accurate)—准确数据人工观察填写的纸质记录仪器、设备通过复杂的计算机化系统产生的图谱或电子记录。
纸质记录对文件和记录版本(变更)进行控制对原始空白记录进行控制对空白记录的发放进行控制对已填写记录的修改进行控制图谱或电子记录电子方式产生的原始数据采用纸质或PDF格式保存应当显示数据的留存过程,以包括所有原始数据信息、相关审计跟踪和结果文件、每一分析运行过程中软件/系统设置标准一个给定的原始数据系列重建所需的所有数据处理运行情况(包括方法和审计跟踪),经过确认的复本。
一旦打印或转换成静态PDF,图谱记录则失去了其被再处理的能力,不能对基线或隐藏区域进行更详细的审核或检查。
以数据库格式存在的动态电子记录则可以进行追踪、趋势分析和查询、查看隐藏区域,放大基线以将积分情况查看的更清楚。
数据审计跟踪数据审计跟踪(audit trial):是一系列有关计算机操作系统、应用程序及用户操作等事件的记录,用以帮助从原始数据追踪到有关的记录、报告或事件,或从记录、报告、事件追溯到原始数据。
如果计算机系统用于电子捕获、处理、报告或存贮原始数据,系统设计应能保持提供全面审计追踪的保存,能够显示对数据进行的所有更改。
对数据的所有更改,应可以显示做这些更改的人,更改均应有时间记录,并给出理由。
用户不应具备修订或关闭审计追踪的能力。
不需要包括每个系统活动(例如,用户登录/退出,键盘敲击等)。



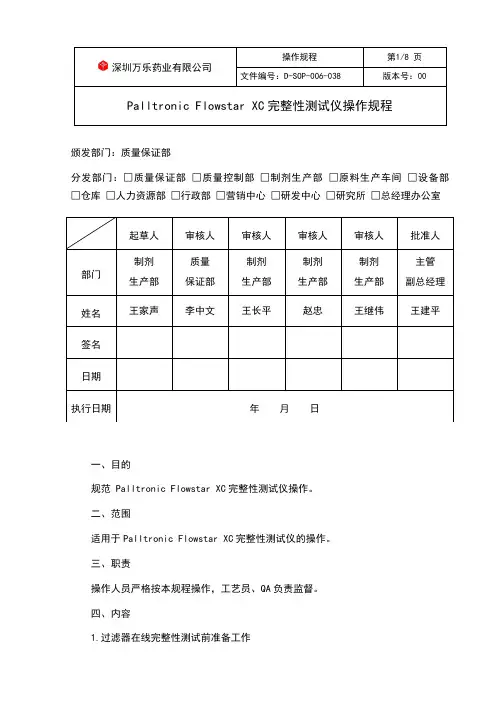
文件编号:D-SOP-006-038版本号:00Palltronic Flowstar XC 完整性测试仪操作规程颁发部门:质量保证部分发部门:□质量保证部 □质量控制部 □制剂生产部 □原料生产车间 □设备部 □仓库 □人力资源部 □行政部 □营销中心 □研发中心 □研究所 □总经理办公室一、目的规范 Palltronic Flowstar XC 完整性测试仪操作。
二、范围适用于Palltronic Flowstar XC 完整性测试仪的操作。
三、职责操作人员严格按本规程操作,工艺员、QA 负责监督。
四、内容1.过滤器在线完整性测试前准备工作起草人 审核人 审核人 审核人 审核人 批准人 部门制剂生产部 质量 保证部 制剂 生产部 制剂 生产部 制剂 生产部 主管 副总经理 姓名 王家声李中文 王长平 赵忠 王继伟王建平 签名 日期执行日期年 月 日文件编号:D-SOP-006-038 版本号:00 Palltronic Flowstar XC完整性测试仪操作规程1.1确认已灭菌的过滤器型号与要求一致,并处于干燥状态。
1.2确认药液配制过滤系统有“已灭菌”状态标识牌并在灭菌有效期内;将已灭菌干燥的过滤器安装到药液过滤系统中相应的位置。
1.3药液过滤器预润湿(具体管道示意图见附件2)1.3.1药液配制过滤系统1中的药液过滤器预浸润(1)确定耐压罐罐底阀(HV22)关闭,打开耐压罐投料口,往耐压罐中加入2升注射用水,关闭投料口。
(2)确定物料输送9(HV26)、物料输送10(HV27)、药液储罐1清洗阀(HV30)关闭。
(3)打开药液储罐1呼吸过滤器阀门(HV31)、药液阀(HV29),使过滤器下游处于与大气压相同的放空状态。
(4)打开物料输送11(HV28)和物料输送8(HV25)使系统处于放空状态。
(5)打开耐压罐压缩空气进气阀(HV20),调节压缩空气流量,当压力表(P07)压力达0.28MPa(2.8bar)时,逐开耐压罐底阀(HV22)让过滤器腔内充满注射用水并使其内部空气由药液过滤器上端呼吸阀排出。





Life Sciences过滤器完整性检测国家食品药品监督管理局颇尔生命科学技术研究中心长沙2009年4月▪过滤器-可靠▪过滤系统-完全▪滤芯-无缺陷完整性定义可以进行完整性检测的滤芯种类▪除菌级过滤器(亲水性、疏水性)▪除病毒过滤器完整性检测通常只用于膜式过滤器完整性检测目的▪确认正确安装▪确认过滤系统达到验证性能▪检测破损不是检测滤膜微孔的“孔径”完整性检测意义4滤芯制造商认证生产质量控制4滤芯用户确认滤芯级别确认滤芯正确安装确认滤芯未受损坏确认滤芯符合制造规格确认此滤芯和经制造商认证的滤芯一样 工艺认证批次记录细菌截留能力可重复从生产流体中去除所有微生物从而得到无菌流体的滤芯可以称之为合适的除菌级滤芯。
这种滤芯孔径一般为0.2um或者更小。
FDA无菌工艺指南2004对于滤芯生产商来说, 0.2µm 除菌级滤芯应符合ASTM (美国试验材料协会)的方法使用浓度至少为107/cm2假单孢菌细菌挑战试验膜过滤器完整性检测类型破坏性检测非破坏性检测颗粒挑战微生物挑战前进流泡点压力保持水侵入微生物拦截测试是最敏感的确认过滤除菌能力的完整性检测方法非破坏性完整性检测是对微生物拦截能力的间接反映非破坏性方法与过滤性能相关联细菌去除效率非破坏性检测关联用户进行完整性检测非破坏性方法与过滤性能相关联破坏性方法非破坏性方法前进流前进流泡点泡点水侵入水侵入压力衰减压力衰减细菌挑战细菌挑战液体过滤器的完整性检测当前法规要求“灭菌后滤芯的完整性在使用前和使用后通过一种适当的方式进行确认。
E.C. GMP Guide液体过滤器的完整性检测当前法规要求“滤器的完整性测试可以在使用前进行,在使用后要求按常规进行. ”FDA “Sterile Drug Products Produced by Aseptic Processing”September, 2004何时进行完整性检测?▪使用后和(或)使用前▪消毒前或消毒后?▪在线或不在线?气体过滤器的完整性检测当前法规要求关键点的空气过滤器和呼吸器的完整性必须使用后进行确认European GMP每次使用后过滤器的测试▪在主要包装材料的气体空间▪冻干装瓶▪无菌分装▪生产过程中的产品保护▪工厂间无菌容器▪在生产和灌装的无菌产品储罐滤芯完整性检测完整性检测亲水性膜疏水性膜前进流√√压力衰减√√泡点√√水侵入√非破坏性完整性检测原理前进流(Forward Flow)压力衰减/保持(Pressure Decay/Hold )泡点检测(Bubble Point)--------均源自相同的机理:检测或观察:从润湿滤膜的一侧向另一侧穿透的气体流量Life Sciences泡点检测原理-润湿的重要性润湿液体通过界面张力的分子引力,被牢牢锁定在微孔间隙中原理-表面张力的作用气压足够大的气体压力下,液体被挤出微孔. . . . . . . 定义为泡点压力“Bubble Point Pressure”原理-气体扩散穿透润湿的滤膜上游下游高压低压润湿的滤膜润湿膜的泡点上游下游加压压力降低滤膜泡点Pressure (bar)234F l o w 1000800400600200原理-泡点压力与孔径d d/2p2p充分润湿的滤膜,泡点压力和开孔孔径成反比. . . 意味着越小的孔径,对应越高的泡点2.10不断增高气压,直至在下游出现“气泡”。
