第三章 多组分系统
- 格式:ppt
- 大小:1.85 MB
- 文档页数:64




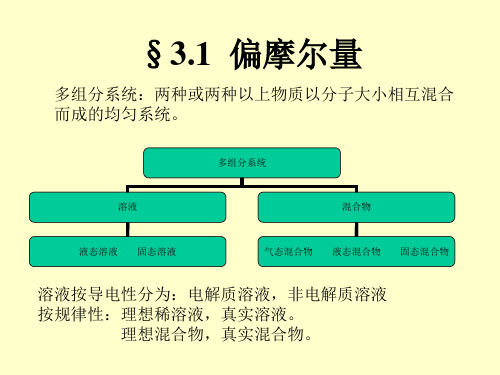
第三章 多组分系统热力学一、基本内容前面讨论的系统一般为纯组分或组成不变的均相封闭系统,只需要两个物理量,如温度和压力,就能确定系统的热力学性质。
而对组成可变的多组分均相系统(如均相化学反应)或多组分多相系统(如二元液态混合物与其气相或固相的平衡),系统的热力学容量性质除与温度和压力有关外,还与系统的组成或物质的量有关。
为此,在讨论多组分系统的热力学、相平衡和化学平衡之前,首先要掌握偏摩尔量、化学势的概念以及由此而引出的一系列定律和公式。
(一) 偏摩尔量1. 定义系统中任一组分B 的偏摩尔量Z B 被定义为CB B T p n Z Z n ⎛⎫∂= ⎪∂⎝⎭,, 其物理意义是等温等压及除B 组分外,其余各组分的量均保持不变的情况下,在无限大量系统中,加入1mol B 组分所引起系统某热力学容量性质Z (V 、U 、H 、S 、A 、G )的改变。
由此可见,Z B 是温度、压力、各组分的物质的量的函数,即 'B B c B (,,,)(,,)Z f T p n n Z f T p C ==或式中C 表示系统的组成。
2. 偏摩尔量的集合公式等温、等压、定浓下,系统的热力学容量性质Z 与各组分的偏摩尔量Z B 之间有加和关系,称为偏摩尔量的集合公式。
即B B B=1kZ n Z =∑(二) 化学势1. 定义任何均相多组分系统的热力学容量性质均可表示为其特征变量与其组成的函数,因此CC1B B 1B B (,,,,)(,,,,)k S V n k S p nU U f S V n n n H H f S p n n n μμ⎛⎫∂=⋅⋅⋅=⎪∂⎝⎭⎛⎫∂=⋅⋅⋅=⎪∂⎝⎭,,,,定义:化学势定义:化学势CC1B B 1B B (,,,,)(,,,,)k T V n k T p nA A f T V n n n G G f T V n n n μμ⎛⎫∂=⋅⋅⋅=⎪∂⎝⎭⎛⎫∂=⋅⋅⋅=⎪∂⎝⎭,,,,定义:化学势定义:化学势用热力学的四个基本方程可以证明C C C CB B B B B S V n S p n T V n T p n U H A G n n n n μ⎛⎫⎛⎫⎛⎫⎛⎫∂∂∂∂====⎪ ⎪ ⎪ ⎪∂∂∂∂⎝⎭⎝⎭⎝⎭⎝⎭,,,,,,,, 由定义式可知组分B 的化学势就是此组分的偏摩尔吉布斯自由能。

第三章 多组分系统热力学一、选择题1.1 mol A 与n mol B 组成的溶液,体积为0.65dm 3,当x B = 0.8时,A 的偏摩尔体积 V A = 0.090dm 3·mol -1,那么B 的偏摩尔V B 为: ( )(A) 0.140 dm 3·mol -1 ; (B) 0.072 dm 3·mol -1 ;(C) 0.028 dm 3·mol -1 ; (D) 0.010 dm 3·mol -1 。
2.注脚“1”代表298K 、p 的O 2,注脚“2”代表298K 、2p 的H 2,那么: ( )(A) 2121,μμμμ≠≠; (B) 因为21μμ≠,1μ与2μ大小无法比较 ;(C) 2121,μμμμ=>;(D) 2121,μμμμ<<。
3.气体B 的化学势表达式:()()B B B ln ln g g x RT p p RT +⎪⎪⎭⎫⎝⎛+=μμ,那么:⑴上式表 明气体B 在混合理想气体中的化学势;⑵()()g g B B μμμ-=∆体现在该条件下做非 体积功的本领;⑶μB (g)是表明做非体积功的本领;⑷μB (g)是气体B 的偏摩尔Gibbs 自由能。
上述四条中正确的是: ( )(A) ⑴⑵⑶ ; (B) ⑵⑶⑷ ; (C) ⑴⑶⑷ ; (D) ⑴⑵⑷ 。
4.373K 、p 时H 2O(g) 的化学势为μ1;373K 、0.5p 时H 2O(g) 的化学势μ2,那么: ①21μμ=;②μ2 - μ1 = RT ln2;③μ2 - μ1 = -RT ln2;④μ2 = μ1 – RT ln0.5。
以上四条中 正确的是: ( )(A) ①② ; (B) ①③ ; (C) ③④ ; (D) ②④5.对于A 、B 两种实际气体处于相同的对比状态,对此理解中,下列何者正确:( )(A) A 、B 两种气体处于相同的状态 ; (B) A 、B 两种气体的压力相等 ;(C) A 、B 两种气体的对比参数π、τ相等 ; (D) A 、B 两种气体的临界压力相等 。