多组分系统
- 格式:ppt
- 大小:1.62 MB
- 文档页数:55


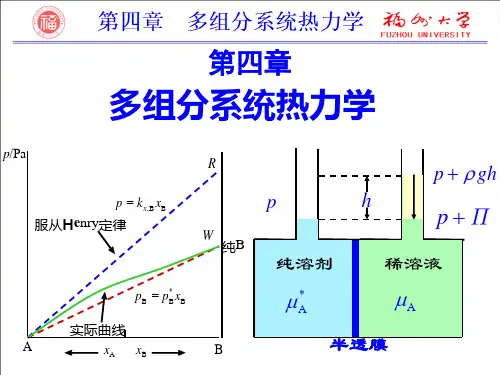


第四章 多组分系统热力学及其在溶液中的应用§4.1 引 言1.基本概念1)多组分系统:由两种或两种以上物质所组成的系统。
(多组分系统可以是单相的也可以是多相的。
)2)混合物:由两种或两种相互均匀混合而构成的系统。
(可以是气相、液相或固相) 3)溶 液(1)定义:由两种或两种以上物质在分子级别呈均匀混合而成的系统。
(2)溶液组分命名:溶质,溶剂。
(3)分类:(1)固态溶液、液态溶液。
(2)电解质溶液、非电解质溶液。
(4)应注意问题:形成溶液后,一般溶质、溶剂受力 情况与纯组分受力情况不同,所以对它们研究方法是不同的。
2.溶液中物质受力情况溶剂-溶剂 f 11 ,溶质-溶质 f 22 ,溶剂-溶质 f 12。
1) 纯态: 溶质 f 22 溶剂 f 11 2) 稀溶液: 溶质 f 22 溶剂 f 11 3) 中等浓度: 溶质 f 22,f 12 溶剂 f 12, f 11 4) 高浓度: 溶质 f 22 溶剂 f 12 3.受力变化同热效应关系1) 放热2) 吸热3) 不吸热不放热§4.2 多组分系统的组成表示法1.组成表示法1)B 的质量浓度:单位体积混合物中所含B 的质量。
1211,22f f f >121122,f f f <121122f f f ==()B B m Vρ=单位 与T 有关2)B 的质量分数:单位质量混合物中所含B 的质量。
单位为1,与T 无关3)B 的浓度:单位体积混合物中所含B 的物质的量。
单位 或 同T 有关。
4)B 的摩尔分数( 或):组分B 的物质的量与混合物中总物质的量的比值。
单位为1,与T 无关液体用 ,气体用5)溶质B 的质量摩尔浓度:每千克溶剂中所含溶质的物质的量。
单位 与T 无关。
6)溶质B 的摩尔比:单位物质的量的溶剂中所含溶质的物质的量。
单位为1,与T 无关。
2.常用的浓度表示法之间的关系 1) 与 的关系:若取1000 g 溶剂对稀溶液 2) 与 关系:-3kg m ⋅B B W w W =B Bn c V =-3mol m ⋅-3mol dm ⋅B x B y B B n x n=B x By ()BB A n m m =⋅-1mol kg BB A n r n =B x B m B BB A B n n x n n n ==+∑AB B A B BB A10001000m x m m M M m M ==++∑∑A B 1000M m <<∑B AB 1000m M x =B x BC A B B BW W c M ρρ=-=-∑∑AB B B B A AB B B B B BB A A c c c M x W c M c M c M c c M M ρρ===--+++∑∑∑∑∑()B AB A B Bc M x c M M ρ=+-∑若溶液很稀则3) 同 的关系: 取 取若溶液很稀则 若 取 对水§4.3 偏摩尔量1.偏摩尔量的定义 1. 问题的引出对简单均相系统 ,要描述其状态,只需要两个状态性质(T 、p )就可以了。






多组分系统热力学
多组分系统热力学是研究多个组分构成的系统的热力学行为的科学。
在多组分系统中,各个组分之间可能会相互作用,从而影响整个系统的热力学性质。
多组分系统热力学的研究内容包括:
1.热力学第一定律:能量守恒定律,即在一个封闭系统中,能量不
能被创造或消除,只能从一种形式转化为另一种形式。
2.热力学第二定律:熵增定律,即在一个封闭系统中,熵(即系统
的混乱程度)只能增加,不能减少。
这意味着,系统总是朝着熵增的方向演化,而不是熵减的方向。
3.相平衡:研究在给定的温度和压力下,不同物质之间是如何平衡
的。
4.化学平衡:研究在给定的温度和压力下,化学反应是如何平衡的。
5.热力学第三定律:绝对零度不能达到原理,即任何物质在绝对零
度下的熵均为零。
这些定律和原理对于理解多组分系统的热力学行为非常重要。
在化学工程、材料科学、生物工程等领域中,多组分系统热力学被广泛应用于研究复杂系统的热力学性质和行为。
5第五章多组分系统多组分系统:两种或两种以上的组分组成的系统,组成(组元):组成系统的化学物质——构成系统的化学物质总数组分,独立组成数(独立组元数)例,O2,CO,CO2气体混合,CO+O2->CO2三者平衡有一定数量关系,三者中仅有两组元为独立组分为二,组成为三多组分系统:包括溶液,混合气体,合金(溶体:多组元均匀系)溶液:液态溶体混合气体:气态溶体合金:金属固态溶体和金:非金属固态溶体广义溶液:多组分的均匀系(不仅是指液体,气体也可以)从纯物质热力学到多组分系统热力学的过渡是以偏摩尔量和化学势为基础的。
5-1内能与化学成分的关系1.内能的试验测定法假设,一均匀系,包含r种不同的化学组分,其中质量分别为:M1,M2,……Mr摩尔数分别为:n1,n2,……nr分子量分别为:μ1,μ2……μr有(以上参量关系式为)MI=μInI(I=1,2,……r)记Ni为可独立变动的摩尔数.以θ,P,n1,n2,…,nr为描写均匀系的平衡态的独立变量.其中,θ为任一温标所定的温度.容积V=V(θ,P,n1,n2,…,nr)任意地变动θ,P,n1,n2,…,nr,都可直接测得V由于内能U---不可直接测得.故应用等压过程P不变,有:Q=△H其中,H=H(θ,P,n1,n2,…,nr)其值可由实验测定∴由U=H-PV可求解内能U.上述焓的确定-----由实验法测得.∵H=H(ni)增加某一组元数量,即将一定数量的化学能物质加入到均匀系,以增加某组元的数量,然后用绝热法或等温法测量物质的吸热量.其中,绝热法指:物系与外界绝热,测量过程中的温度改变.等温法指:对物系供给热量,或取出热量,维持温度不变.以下分别详细介绍绝热法和等文法:1)绝热法:假定:第i组元,数量为n’摩尔加入均匀系,过程中为等压,无化学反应.∴H=cont.初温为θ,终温为θ’第I种化学纯物质的焓为H’.H’与n’成正比即H’=n’h’h’=h’(θ,p)初始的总焓,H(θ,p,n1,n2,…,nr)+H’终态的总焓,H(θ’,p,n1,n2,…,ni+n’,…,nr)∵总焓不变∴两者相等(其中两者指初始的总焓和终态的总焓).若,Cp以(已)在各种情况下求得,则H(θ’,p,n1,n2,..,ni+n’,…,nr)-H(θ,p,n1,…,ni+n’,…,nr)=Cp(,p,n1,n2,...,nin',...,nr)d.'H(θ,p,n1,…,ni+n’,…,nr)=H(θ’,p,n1,n2,…,ni+n’,…,nr)-'Cp(,p,n1,n2,...,nin',...,nr)d即H(θ,p,n1,n2,…,ni+n’,…,nr)=H(θ,p,n1,n2,…,nr)+H’-Cp(,p,n1,n2,...,nin',...,nr)d.'方程确定了H~ni的关系对全部r种组元作一连串实验,可确定H与化学成分的关系.2)等温法:θ保持不变,测量物质放出的热量Q.该热量相当于公式的Cp(,p,n1,n2,...,nin',...,nr)d'∴H(θ,p,n1,n2,…,ni+n’,…,nr)=H(θ,p,n1,n2,…,nr’)+H’-Q2.广延量与偏摩尔物质.广延量与总质量成正比设:有一均匀系,其θ,p不变,ni→ni(i=1,2,…,r)总质量M’=M.(ni’=ni,i=1,2,3,…,r)有:V’=VU’=U∴V’=V(θ,p,n1,n2,…,nr)=V(θ,p,n1,…,nr)U’=U(θ,p,n1,n2,…,nr)=U(θ,p,n1,…,nr)即V’,U’作为θ,p,ni’的函数,与V,U作为θ,p,ni的函数相同,此为广延量的数学性质.------一阶齐次函数.以下给出一阶齐次函数的数学定义:已知:f(某1,某2,…,某r)=m(某1,某2,…,某r)称f为某1,某2,…,某r的m阶齐次函数,举例来说,强度量为零阶齐次函数.若函数中包含广延量与强度量,应将强度量看作参数项.以下给出Euler定理的数学定义:假设:函数f对各变量某1,某2,…,某r有连续的偏微商,则,m阶齐次函数有:136i某if某imf.-----------------Euler定理.Euler定理应用:将此定理用到V,U,ni相当于某i,m=1(一次齐次函数).Vnivni1rU.p.niUni1r.p.Vni.p.vi------------组元i的偏摩尔容积Uni.p.ui------------组元i的偏摩尔内能其它偏摩尔变量:hi=riHni.p.,CPi=Cpnir.p.,CVi=Cvni.p.偏摩尔变量符合ripivHnhCi1pnCC1nCivi1化学成分,用各组元的某i表示.某i=rninn=ni某1i1---------r种摩尔百分比中,仅(r-1)种为独立(组分r-1,.组成r个)平均摩尔内能umUnVn其他平均摩尔能:vm5-2基本方程,hmHn1多组分的热力系函数确定简单可压缩封闭系的热力状态,需要独立热力参数2个,相应于一种做功形式和热量交换.例U=U(,v)定成分,定质量系统,U取决于,v,若有物质加入系统(开口系)U↗∴dU与加入物质dn有关,又与加入物质的种类有关.∴uu(,v,n1,n2,,nr)∴确定变成分,多组分系统的热力状态,需独立热力参数及组分变量(组分多少,浓度多少,——也是独立变量)137组元数量的表示:摩尔数u1,u2——nr,在含r个组分的均相系中,状态由r+2个参数确定。
一种多组分分析仪器系统多组分分析仪器系统是一种广泛应用于工业生产、环境监测和化学研究等领域的仪器系统,它能够同时检测多种物质成分的含量,具有高效、准确、快速的特点。
这种仪器系统通常由多个部件组成,包括样品处理模块、分析模块、检测模块和数据处理模块等。
下面我将介绍一种典型的多组分分析仪器系统。
首先,样品处理模块是多组分分析仪器系统的第一个部件,它主要用于对待测样品进行预处理。
通常包括样品进样系统、样品准备系统和样品处理系统。
样品进样系统用于将待测样品引入仪器系统中,通常可以通过自动进样或手动进样的方式进行。
样品准备系统用于将样品处理成符合分析要求的形式,例如将固体样品溶解、液体样品稀释、气体样品稀释等。
样品处理系统则用于进一步处理样品,例如进行反应、提取、分离等操作。
其次,分析模块是多组分分析仪器系统的核心部件,它主要用于对待测样品中的多种成分进行分析。
通常包括分析仪器、分析方法和分析程序等。
分析仪器可以是不同类型的仪器,如红外光谱仪、质谱仪、色谱仪等,每种仪器都有其适用的分析范围和特点。
分析方法是指根据待测成分的特性设计的分析方案,包括取样、处理、检测等步骤。
分析程序则是通过仪器控制软件实现的程序,用于控制仪器的运行、采集数据、处理数据等。
第三,检测模块是多组分分析仪器系统的另一个重要部件,它主要用于对待测样品中的成分进行检测。
通常包括检测器、信号放大器、数据采集系统等。
检测器是用于检测待测成分的仪器,可以根据不同的检测原理分为光学检测器、电化学检测器、质谱检测器等。
信号放大器则用于放大检测器输出的信号,以便进行下一步处理。
数据采集系统用于采集检测到的信号,并将其转换成数字信号,以便后续的数据处理。
最后,数据处理模块是多组分分析仪器系统的最后一个部件,它主要用于处理检测到的数据,提取出样品中各种成分的含量。
通常包括数据处理软件、数据处理算法和数据展示界面等。
数据处理软件是用于处理检测到的原始数据的软件,可以进行数据校正、数据拟合、数据分析等操作。