(完整版)荧光定量PCR技术与常见问题分析
- 格式:ppt
- 大小:8.44 MB
- 文档页数:111
1.定量PCR仪的开关机顺序是怎样的?按照正确的开关机顺序操作,有助于延长仪器的使用寿命,减少仪器出故障的频率。
开机顺序:先开电脑,待电脑完全启动后再开启定量PCR仪主机,等主机面板上的绿灯亮后即可打开定量PCR的收集软件,进行实验。
关机顺序:确认实验已经结束后,首先关闭信号收集软件,然后关掉定量PCR仪主机的电源,最后关闭电脑。
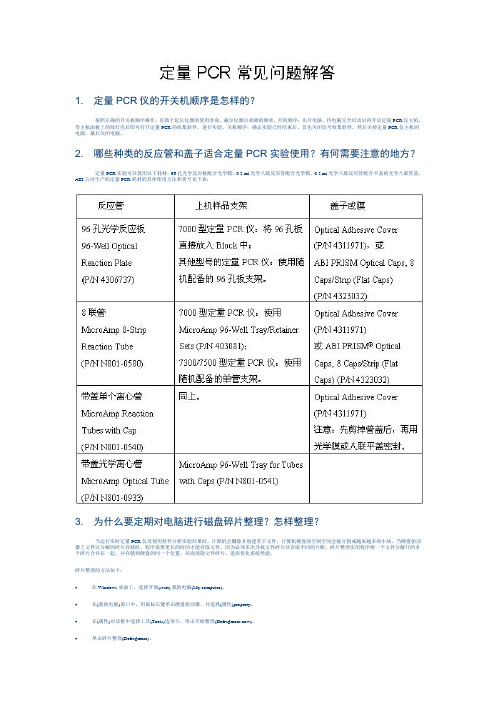
2.哪些种类的反应管和盖子适合定量PCR实验使用?有何需要注意的地方?定量PCR实验可以使用以下耗材:96孔光学反应板配合光学膜,0.2 ml光学八联反应管配合光学膜,0.2 ml光学八联反应管配合平盖的光学八联管盖。
ABI 公司生产的定量PCR耗材的具体使用方法和货号见下表:3.为什么要定期对电脑进行磁盘碎片整理?怎样整理?当运行实时定量PCR仪及使用软件分析实验结果时,计算机会删除并创建若干文件,计算机硬盘的空闲空间会被分割成越来越多的小块。
当硬盘驱动器上文件以分解的碎片存储时,程序需要更长的时间才能存取文件,因为必须多次寻找文件碎片以存取不同的片断。
碎片整理实用程序将一个文件分解开的多个碎片合并在一起,并存储到硬盘的同一个位置,从而清除文件碎片,进而优化系统性能。
碎片整理的方法如下:∙在Windows桌面上,选择开始(start),我的电脑(My computer)。
∙在(我的电脑)窗口中,用鼠标右键单击硬盘驱动器,并选择(属性)property。
∙在(属性)对话框中选择工具(Tools)选项卡,单击开始整理(Defragment now)。
∙单击碎片整理(Defragment)。
∙当显示“碎片整理完毕”对话框时,单击(确定)。
∙在“本地磁盘属性”对话框中,单击(确定)。
为计算机机中剩余的驱动器重复如上步骤。
4.何时执行windows service pack更新?不要执行该操作。
除非美国应用生物系统公司代表通知您更新操作系统,否则请不要更新控制定量PCR 仪的计算机的操作系统。

荧光定量PCR常见问题解析(一)1、普通PCR与荧光定量PCR技术区别?①荧光定量PCR能够实时监测PCR反应的全过程,对每一个循环进行定量或定性分析;而普通PCR只能对反应的终产物进行半定量或定性分析。
②荧光定量PCR的结果分析可以直接通过电脑读出,而普通PCR的结果必须通过下一步的电泳进行条带分析。
2、荧光定量PCR技术的特点①灵敏度高、特异性强。
② PCR实验过程全封闭,仪器自动分析和获取实验结果,无后续实验操作。
③实时监测反应过程,定量更准确。
④定量范围宽,可达到10个数量级。
⑤可以实现一次反应检测多个样本。
3、实时荧光定量PCR实验操作注意事项①应该带一次性乳胶手套并经常更换,在试剂准备室和样本处理室应该配备负压式生物安全柜,以防止对环境或对样品的污染。
②要严格防止气溶胶交叉污染。
采取的措施有:使用一次性带滤芯移液枪吸头;不使用吸头吹打液体进行混匀;在生物安全柜中进行离心操作;尽量减少在生物安全柜以外开启试剂或PCR管;禁止在荧光定量PCR结束后打开PCR管盖。
③实验中牵涉的有毒有害及有污染的样本及试剂应该严格按照生物安全相关规定操作和处理。
④荧光探针应该避光保存,加入反应液后应尽快上机,以防探针粹灭。
⑤在进行RNA相关操作时,必须使用无RNase的实验器具及耗材,并加样后立即上机操作,以防RNA的降解。
⑥所有试剂在开启之前都要瞬时离心;试剂配制完成后要瞬时离心以去除气泡。
⑦不要在荧光定量PCR管上做任何标记,不能用手接触PCR管盖上采光部位。
4、实时荧光定量PCR实验无CT值出现或无扩增信号的问题及解决方案①实验的循环数不够,设计的循环数应该在35以上,可增加至45个循环,但不可高于45个循环。
②通道选择不对,应该仔细阅读产品说明书,根据说明书的要求选择采光通道。
③荧光采集位置设计有误,应该仔细阅读产品说明书,根据说明书的要求设置荧光信号采集位置。
④引物或探针降解,要求厂家重新发货验证。

PCR常见问题分析及对策(无扩增产物、非特异性扩增、拖尾、假阳性)问题1:无扩增产物现象:正对照有条带,而样品则无原因:1.模板:含有抑制物,含量低2.Buffer对样品不合适3.引物设计不当或者发生降解4.反应条件:退火温度太高,延伸时间太短对策:1.纯化模板或者使用试剂盒提取模板DNA或加大模板的用量2.更换Buffer或调整浓度3.重新设计引物(避免链间二聚体和链内二级结构)或者换一管新引物4.降低退火温度、延长延伸时间问题2:非特异性扩增现象:条带与预计的大小不一致或者非特异性扩增带原因:1.引物特异性差2.模板或引物浓度过高3.酶量过多4.Mg2+浓度偏高5.退火温度偏低6.循环次数过多对策:1.重新设计引物或者使用巢式PCR2.适当降低模板或引物浓度3.适当减少酶量4.降低镁离子浓度5.适当提高退火温度或使用二阶段温度法6.减少循环次数问题3:拖尾现象:产物在凝胶上呈Smear状态。
原因:1.模板不纯2.Buffer不合适3.退火温度偏低4.酶量过多5.dNTP、Mg 2+浓度偏高6.循环次数过多对策:1.纯化模板2.更换Buffer3.适当提高退火温度4.适量用酶5.适当降低dNTP和镁离子的浓度6.减少循环次数问题4:假阳性现象:空白对照出现目的扩增产物原因:靶序列或扩增产物的交*污染对策:1.操作时应小心轻柔,防止将靶序列吸入加样枪内或溅出离心管外;2.除酶及不能耐高温的物质外,所有试剂或器材均应高压消毒。
所用离心管及加样枪头等均应一次性使用。
3.各种试剂最好先进行分装,然后低温贮存PCR引物设计的黄金法则(转自tiangen)1.引物最好在模板cDNA的保守区内设计。
DNA序列的保守区是通过物种间相似序列的比较确定的。
在NCBI上搜索不同物种的同一基因,通过序列分析软件(比如DNAman)比对(Alignment),各基因相同的序列就是该基因的保守区2.引物长度一般在15~30碱基之间。

荧光定量PCR检测miRNA中遇到的常见问题
一、反转录引物(RT引物)设计
实时荧光定量PCR检测miRNA的难点在于如何识别只有22nt左右的miRNA并合成第一链,目前常用的方法主要有茎环法和加尾法。
茎环法:引物由可以自身呈茎环状的特异序列+6~8个miRNA3’端反向互补碱基组成。
该RT引物可以与成熟miRNA结合,形成反转录引物/成熟miRNA复合物,并在miRNA的5’末端延伸,这样就得到一个较长的反转录扩增子,为后续的荧光定量PCR提供了符合要求的模板。
原理示意图如下:
加尾法(Oligod(T)特异RT引物法):RNA在反转录前需要进行末端Poly(A)加尾,所有miRNA可以公用一个Oligod(T)的引物(由特异序列+(T)20左右+兼并碱基V或VN组成)。
加尾法特异性稍低,但设计及操作简单。
原理示意图如下:
二、荧光定量PCR引物探针设计
反转录后得到的cDNA为复合片段(miRNA+引物),上游引物为特异性引物,在miRNA上设计,若GC含量太低,可以在上游引物5’端加入GCGC等保护碱基,下游引物为通用引物,与RT引物的某一段相匹配。
荧光定量PCR检测方法主要有SYBR Green染料法和TaqMan探针法。
前者需调整引物浓度,提高引物扩增效率,尽量减少引物二聚体与非特异性扩增;探针法需设计荧光探针,探针设计位置可以有3种:完全与miRNA序列相同、在miRNA与RT引物的交叉位置、完全在RT引物上。
至于探针要设计在哪个位置,可根据自己的实验情况来定。


临床荧光PCR结果分析及常见问题临床荧光PCR结果分析及常见问题中国⼈民解放军三零⼆医院王海滨⼀、荧光 PCR 技术在临床诊、疗中的应⽤PCR 技术是于 1983 年由 Mullis 发明,后来传到我国,但是由于实验污染的问题, 1998 年卫⽣部取缔 PCR 实验⽅法在临床诊断中的应⽤。
荧光 PCR 出现后,污染减少很多,但近⼏年由于磁珠的应⽤,污染⼜再起。
2003 年, PCR 在 SARS 的早期诊断中⾮常有效,当时使⽤的是电泳法。
H1N1 甲型流感( 2009 ):荧光 PCR 技术作为确诊指标( 755 份 / 天)。
疾病易感基因的研究( SNP ): CR1/ 丙型肝炎 IL-28B 。
疾病(肿瘤)易感基因的鉴定。
⼆、影响临床荧光 PCR 检测结果的因素(⼀)影响临床荧光 PCR 检测结果的常见因素1. 检验因素:实验室硬件、仪器、试剂、⼈员素质、技术⽔平、管理⽔平。
2. ⾮检验因素:标本采集、质量、部位、标本保存、条件、时间、标本中的⼲扰物质、样本丢失!(⼆)加强检测前标本的质量管理——避免问题重复发⽣规范标本前处理流程、制度化的重要性,建⽴不合格标本记录和定期总结制度、制定解决措施与可⾏路径(编号和项⽬错误等),查找标本丢失可能的环节。
加强本室新进⼯作⼈员流程培训,经常性进⾏临床医护的交流与培训。
(三)实验室分区分为:试剂配制、核酸提取、 PCR 扩增以及开放产物分析等区域。
分区⽬的:通过物理分割达到标本、试剂或使⽤器具等被沾染或掺⼊污染,标本间的交叉污染等。
分区要求:⾄少要有清洁的试剂配制和核酸制备区三、试剂配制(⼀)试剂配制室的设置与维护以空间内⽆核酸⽓溶胶为准!1 .正压、清洁进风 ( 壁挂式空调 ) 。
试剂冰箱内勿存放病原或核酸相关物品!定期清洁除霜!2 .有效氯消毒液清洁实验室台⾯、地⾯。
3 .移液器:使⽤前的清洁。
4 .离⼼机等:每周定期⽊浆纸⼱擦拭,⽅法。
“⼀次性物品的使⽤ - 从 COBAS 的“浪费”中找到均衡!(⼆)试剂配制注意事项试剂配制实际是简单的问题,但是也是⾮常复杂的环节。
荧光定量PCR常见问题1.定量PCR仪的开关机顺序是怎样的?按照正确的开关机顺序操作,有助于延长仪器的使用寿命,减少仪器出故障的频率。
开机顺序:先开电脑,待电脑完全启动后再开启定量PCR仪主机,等主机面板上的绿灯亮后即可打开定量PCR的收集软件,进行实验。
关机顺序:确认实验已经结束后,首先关闭信号收集软件,然后关掉定量PCR仪主机的电源,最后关闭电脑。
2.哪些种类的反应管和盖子适合定量PCR实验使用?有何需要注意的地方?定量PCR实验可以使用以下耗材:96孔光学反应板配合光学膜,0.2 ml 光学八联反应管配合光学膜,0.2 ml光学八联反应管配合平盖的光学八联管盖。
ABI公司生产的定量PCR耗材的具体使用方法和货号见下表:3.为什么要定期对电脑进行磁盘碎片整理?怎样整理?当运行实时定量PCR仪及使用软件分析实验结果时,计算机会删除并创建若干文件,计算机硬盘的空闲空间会被分割成越来越多的小块。
当硬盘驱动器上文件以分解的碎片存储时,程序需要更长的时间才能存取文件,因为必须多次寻找文件碎片以存取不同的片断。
碎片整理实用程序将一个文件分解开的多个碎片合并在一起,并存储到硬盘的同一个位置,从而清除文件碎片,进而优化系统性能。
碎片整理的方法如下:∙在Windows桌面上,选择开始(start),我的电脑(My computer)。
∙在(我的电脑)窗口中,用鼠标右键单击硬盘驱动器,并选择(属性)property。
∙在(属性)对话框中选择工具(Tools)选项卡,单击开始整理(Defragment now)。
∙单击碎片整理(Defragment)。
∙当显示“碎片整理完毕”对话框时,单击(确定)。
∙在“本地磁盘属性”对话框中,单击(确定)。
为计算机机中剩余的驱动器重复如上步骤。
4.何时执行windows service pack更新?不要执行该操作。
除非美国应用生物系统公司代表通知您更新操作系统,否则请不要更新控制定量PCR 仪的计算机的操作系统。
荧光定量PCR技术的使用中常见问题引言:荧光定量PCR技术作为一种高效、灵敏和准确的基因定量方法,广泛应用于分子生物学、医学诊断、环境监测等领域。
然而,在使用荧光定量PCR技术的过程中,常常会遇到一些问题和挑战。
本文将就荧光定量PCR技术的使用中常见问题进行探讨和解答,旨在帮助读者更好地应对和解决实验中的困惑。
一、引物设计问题1. 引物设计原则荧光定量PCR实验的关键是引物的设计。
引物应具备特异性、高度选择性以及适当的配对特性,以确保PCR反应的准确性和灵敏度。
引物设计建议遵循以下原则:- 引物长度:一般选择长度在18-30个碱基对之间。
- 碱基组成:应尽量避免引物末端含有连续的鸟嘌呤(G)或鸟嘧啶(C)。
- 碱基序列:引物两端应该尽量避免含有重复的碱基序列,以防止不特异扩增。
- 温度计算:引物的Tm(解离温度)应该在50-60摄氏度之间,同时引物间的Tm差异应不大于5摄氏度。
2. 引物设计工具引物设计可以利用一些在线引物设计工具,如Primer3、NCBI Primer-BLAST 等。
这些工具能够根据用户提供的序列信息,自动生成符合上述引物设计原则的引物。
二、荧光探针选择和优化1. 探针选择荧光定量PCR常用的探针有TaqMan探针、Molecular beacon探针等。
选择合适的探针取决于实验需要和目标基因的特点。
TaqMan探针适用于高度特异性检测,而Molecular beacon探针则适用于检测低浓度的目标序列。
2. 探针的优化为了提高PCR反应的灵敏度和特异性,有时需要对探针进行优化。
以下是一些优化探针的建议:- 探针浓度优化:需根据实验条件和目标基因的特性进行探针浓度的优化。
- 探针长度:一般探针的长度限制在15-30个碱基对之间。
三、荧光定量PCR反应体系问题1. 反应体系的组成荧光定量PCR反应体系基本组成包括:模板DNA、引物、荧光探针、聚合酶、缓冲液和核苷酸等。
其中,重要的是要根据实验需要和试剂盒的要求确定各组分的浓度。
荧光定量PCR常见问题及解答更新時間:2010-12-10 10:43:37一、无 Ct 值(信号)出现:1.反应循环数不够:一般都要在 35 个循环以上,可根据实验情况增加循环,但高于45个循环会增加过多的背景信号;2.检测荧光信号的步骤有误:一般采用 72℃延伸时采集荧光,Taqman 方法则一般在退火结束或延伸结束采集信号;3.引物或探针降解:可通过PAGE电泳检测其完整性;4.探针设计不佳:设计探针温度低于引物,造成探针未杂交上而产物已延伸;5.模板量少:对未知浓度的样品应从系列稀释样品的最高浓度做起;6.模板降解:避免样品制备中杂质的引入以及模板反复冻融的情况发生。
二、如何确认模板中是否含有 PCR 反应阻害物质:有时RNA或cDNA模板中存在对反转录和荧光PCR 反应的阻害物质。
为了确认这样的阻害物质的有无,我们可以使用高浓度的模板按 3-4 个梯度稀释,并使用其进行荧光定量 PCR 反应。
如果无阻害物质存在,得到的 Ct 值就会依模板浓度的变化而变化;而如果模板中有阻害物质的存在,实验过程中我们就会发现高浓度的模板有反应性能下降的现象。
三、Ct值出现过晚:1.反应条件不佳:未最佳反应条件,可重新设计引物或探针,适当降低退火温度,增加镁离子浓度等;2.PCR各种反应成分的降解或加样量不够;3.扩增产物片段过长:一般采用 100-200bp 的扩增长度。
四、标准曲线的线性关系不佳:1.加样存在误差,标准品稀释不呈梯度;2.标准品降解:标准品尽量避免反复冻融;3.引物或探针不佳:重新设计;4.模板中存在抑制物,或模板浓度过高。
五、阴性对照液出现明显的扩增:1.荧光 PCR mix 或水被污染;2.引物二聚体的出现:在 35 循环后阴性对照出现扩增属正常情况,可配合溶解曲线进行分析;3.反应过程中探针降解:用PAGE电泳对探针进行检测。
六、溶解曲线不止一个主峰:1.引物设计不佳:避免二聚体和发夹结构的出现;2.引物浓度不佳:适当调整引物浓度;3.退火温度低:提高退火温度;4.镁离子浓度过高:适当降低镁离子浓度;5.模板中有基因组的污染:RNA提取过程中避免基因组 DNA 的污染,或通过引物设计避免非特异扩增。
荧光定量PCR常见问题及解答更新時間:2010/12/10 10:43:37--------------------------------------------------------------------------------一、无Ct 值(信号)出现:1.反应循环数不够:一般都要在35 个循环以上,可根据实验情况增加循环,但高于45个循环会增加过多的背景信号;2.检测荧光信号的步骤有误:一般采用72℃延伸时采集荧光,Taqman 方法则一般在退火结束或延伸结束采集信号;3.引物或探针降解:可通过PAGE电泳检测其完整性;4.探针设计不佳:设计探针温度低于引物,造成探针未杂交上而产物已延伸;5.模板量少:对未知浓度的样品应从系列稀释样品的最高浓度做起;6.模板降解:避免样品制备中杂质的引入以及模板反复冻融的情况发生。
二、如何确认模板中是否含有PCR 反应阻害物质:有时RNA或cDNA模板中存在对反转录和荧光PCR 反应的阻害物质。
为了确认这样的阻害物质的有无,我们可以使用高浓度的模板按3-4 个梯度稀释,并使用其进行荧光定量PCR 反应。
如果无阻害物质存在,得到的Ct 值就会依模板浓度的变化而变化;而如果模板中有阻害物质的存在,实验过程中我们就会发现高浓度的模板有反应性能下降的现象。
三、Ct值出现过晚:1.反应条件不佳:未最佳反应条件,可重新设计引物或探针,适当降低退火温度,增加镁离子浓度等;2.PCR各种反应成分的降解或加样量不够;3.扩增产物片段过长:一般采用100-200bp 的扩增长度。
四、标准曲线的线性关系不佳:1.加样存在误差,标准品稀释不呈梯度;2.标准品降解:标准品尽量避免反复冻融;3.引物或探针不佳:重新设计;4.模板中存在抑制物,或模板浓度过高。
五、阴性对照液出现明显的扩增:1.荧光PCR mix 或水被污染;2.引物二聚体的出现:在35 循环后阴性对照出现扩增属正常情况,可配合溶解曲线进行分析;3.反应过程中探针降解:用PAGE电泳对探针进行检测。