用高效离子交换色谱和脉冲安培检测器测定
- 格式:doc
- 大小:20.00 KB
- 文档页数:2

离子色谱-脉冲安培检测法测定双黄连注射液中葡萄糖、果糖及蔗糖的含量摘要:本文建立了离子色谱法测定双黄连注射液中单糖含量测定的方法。
样品稀释后,使用戴安CarboPac PA20分析柱分离,流动相为氢氧化钠溶液梯度淋洗,流速0.5mL/min,脉冲安培检测。
本方法简便快捷,用于测定双黄连注射液中糖类物质的含量,具有较高的灵敏度。
关键词双黄连注射液糖离子色谱法安培检测器双黄连注射液是中药金银花、黄芩、连翘的提取物制剂,有广谱抗菌、抗病毒的作用,对呼吸道疾病具有疗效确切、使用安全、无耐药性等优点。
【1】但随着应用的增多,也出现了一些过敏反应。
双黄连口服液中,绿原酸、黄芩苷、连翘苷、汉黄芩素是其主要活性成分。
此外,双黄连注射液中还含有多种糖类物质。
对双黄连注射液成分的全面研究,有助于优化工艺,提高疗效,降低不良反应的发生率。
离子色谱法与脉冲安培检测器联用(HPAEC-PAD),是近年来发展起来的检测糖类物质的方法。
该方法具有样品前处理简单,不需衍生,灵敏度高,分离度好等优点,广泛应用于食品、生物样品中糖类物质的检测。
本文建立了离子色谱法测定双黄连注射液中糖类物质含量的方法。
通过样品前处理方法和色谱条件的优化,建立了一种较为完善的分离和检验方法,可检测出注射液中低含量的糖类物质。
1.仪器及色谱条件1.1 仪器Dionex ICS3000型离子色谱仪,Dionex CarboPac PA20分析柱及保护柱。
1.2 样品前处理取双黄连注射液,稀释500倍后,过0.22μm滤膜和Dionex RP柱。
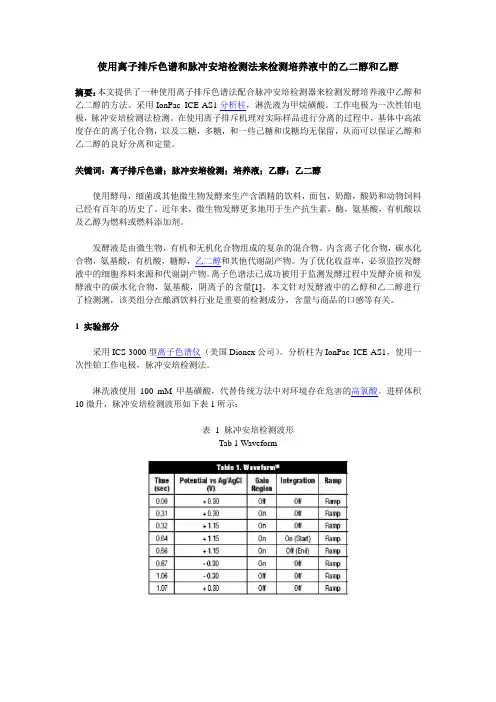
1.3 色谱条件流动相:0-10min,23mM NaOH;10.1-15min,200 mM NaOH;15.1-20min,23 mM NaOH;流速:0.5mL/min;柱温:30℃;检测波形:标准糖四电位波形。
2. 结果与讨论2.1 样品前处理双黄连注射液成分复杂,除含有绿原酸、黄芩苷、连翘苷、汉黄芩素等物质外,还含有大分子物质。



离子色谱-脉冲安培法测定链霉素及杂质摘要:本文采用离子色谱-脉冲安培法测定链霉素以及其杂质的含量。
采用Carbonpac PA1阴离子分析柱分离,以电化学为检测器。
用去离子水提取YPD发酵液的链霉素,以16000r/min 的速度离心后,上清液稀释100倍直接进样分析。
实验结果表明,在一定的色谱条件下,链霉素及其杂质离子具体很好的线性,和重现性,及较低的检出限。
关键词:离子色谱;脉冲安培;链霉素新霉素是水溶性的氨基糖苷类抗生素复合体,一般是从放射菌类链霉素的发酵产物中纯化出来的,主要用于静脉注射以治疗感染。
在临床使用前,链霉素在使用之前必须测定主成分以及标注所有的杂质成分。
氨基糖苷类抗生素及其杂质的结构和糖类似,都没有明显的发色基团,用紫外-可见光检测器的灵敏度达不到要求。
另外在制备和贮藏过程中引入的一些中间体或杂质具有较好的紫外或可见光吸收基团,使用紫外-可见光检测器直接进样分析会有很大的干扰链霉素A及其杂质的定量。
示差折光率检测器与紫外-可见光检测器的局限性类似。
在本文中采用高效阴离子交换色谱(HPAE)分离链霉素A及其杂质[13,17],选用的CarboPac PA1阴离子交换柱对链霉素A及其杂质进行分离,采用EG50淋洗液发生器,采用一次性金(Au)工作电极作为电化学检测器的工作电极。
此方法精确度好、检出限低、线性和方法的重现性好[17,25,26]。
图1.检测链霉素和二氢链霉素的色谱图2. 70和63mM NaOH分析链霉素的对比1.实验部分1.1 仪器及试剂Dionex ICS3000系统,包括D梯度双泵或者SP梯度单泵(带有真空脱气装置和GM-4梯度混合装置),DC检测器模块(带双温控区),20 uL进样环,ECD电化学池配复合pH/Ag/AgCl参比电极,一次性金工作电极;AS自动进样器(带分流阀)以及2ml进样瓶;Chremoleon工作站。
氦气(99.995%);过滤装置,0.2 um尼龙膜过滤装置;真空泵;聚丙烯自动进样器小瓶;离心管(1.5ml)。



高效阴离子交换色谱积分脉冲安培法测定蓝藻细胞培养液中的蔗糖和甘油葡糖苷梁文辉;法芸;王明林【摘要】建立了一种测定蓝藻细胞培养液中蔗糖和甘油葡糖苷的高效阴离子交换色谱积分脉冲安培检测法。
在最佳的分离条件下,蔗糖和甘油葡糖苷的质量浓度在0.1~50.0 mg/L范围内与色谱峰面积线性良好,线性相关系数r2>0.9999。
蔗糖和甘油葡糖苷的最低检测限分别是0.15 mg/L和0.03 mg/L,测定结果的相对标准偏差小于2%(n=8)。
该方法样品处理简单,无基体干扰,测定的准确度,灵敏度高,可应用于蓝藻培养液中蔗糖和甘油葡糖苷的测定。
%A high performance anion-exchange chromatography with pulsed amperometric detection was developed for the determination of sucrose and glucosylglycerol in cyanobacterial cells. Under the optimized conditions,the concentration of sucrose and glucosylglycerol showed good linearity (r2>0.999 9) with the chromatographic peak area in the range of 0.1–50.0 mg/L. The limit of detection(LOD) was 0.15 mg/L for sucrose and 0.03 mg/L for glucosylglycerol. RSDs of the detection results were less than 2% (n=8). The result showed that the method was convenient and accurate for the determination of sucrose and glucosylglycerol in cyanobacterial cells.【期刊名称】《化学分析计量》【年(卷),期】2014(000)0z1【总页数】4页(P9-12)【关键词】高效阴离子交换色谱;积分脉冲安培检测;蓝藻;培养液;蔗糖;甘油葡糖苷【作者】梁文辉;法芸;王明林【作者单位】山东农业大学,食品科学与工程学院,山东泰安 271018; 中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东青岛 266101;中国科学院青岛生物能源与过程研究所,生物燃料重点实验室,山东青岛 266101;山东农业大学,食品科学与工程学院,山东泰安 271018【正文语种】中文【中图分类】O657.7在小分子糖类碳源中,蔗糖可由高等植物通过光合作用直接合成,被认为是自然界最丰富的二糖;同时蔗糖结构简单,很多微生物可以利用,是一种较为理想的碳源。


使用离子排斥色谱和脉冲安培检测法来检测培养液中的乙二醇和乙醇摘要:本文提供了一种使用离子排斥色谱法配合脉冲安培检测器来检测发酵培养液中乙醇和乙二醇的方法。
采用IonPac ICE-AS1分析柱,淋洗液为甲烷磺酸。
工作电极为一次性铂电极,脉冲安培检测法检测。
在使用离子排斥机理对实际样品进行分离的过程中,基体中高浓度存在的离子化合物,以及二糖,多糖,和一些己糖和戊糖均无保留,从而可以保证乙醇和乙二醇的良好分离和定量。
关键词:离子排斥色谱;脉冲安培检测;培养液;乙醇;乙二醇使用酵母,细菌或其他微生物发酵来生产含酒精的饮料,面包,奶酪,酸奶和动物饲料已经有百年的历史了。
近年来,微生物发酵更多地用于生产抗生素,酶,氨基酸,有机酸以及乙醇为燃料或燃料添加剂。
发酵液是由微生物,有机和无机化合物组成的复杂的混合物。
内含离子化合物,碳水化合物,氨基酸,有机酸,糖醇,乙二醇和其他代谢副产物。
为了优化收益率,必须监控发酵液中的细胞养料来源和代谢副产物。
离子色谱法已成功被用于监测发酵过程中发酵介质和发酵液中的碳水化合物,氨基酸,阴离子的含量[1]。
本文针对发酵液中的乙醇和乙二醇进行了检测测,该类组分在酿酒饮料行业是重要的检测成分,含量与商品的口感等有关。
1 实验部分采用ICS-3000型离子色谱仪(美国Dionex公司)。
分析柱为IonPac ICE-AS1,使用一次性铂工作电极,脉冲安培检测法。
淋洗液使用100 mM甲基磺酸,代替传统方法中对环境存在危害的高氯酸。
进样体积10微升,脉冲安培检测波形如下表1所示:表 1 脉冲安培检测波形Tab 1 Waveform2 结果与讨论针对葡萄酒样品前处理,将1毫升葡萄酒样品在14000转/分钟离心机离心10分钟。
取上清液清液使用超纯水进行稀释,过离线净化小柱即可上样。
在处理啤酒样品前,应进行超声脱气,之后步骤与葡萄酒处理方法相同。
图1为乙醇,乙二醇及其它醇类混标分离谱图。
图1 标准物质分离谱图Fig.1 Separation of meso-erythritol, glycerol, propyleneglycol, ethanol, methanol, and isopropanol.笔者分别进行了实际样品的直接检测和加标回收率实验,均得到了满意的结果。

高效阴离子交换色谱-脉冲安培法检测低聚异麦芽糖张晓萍;段钢【摘要】建立了高效阴离子交换色谱-脉冲安培检测法定量分析低聚异麦芽糖的方法。
采用Carbo PakTM PA10色谱柱,配合安培检测器,以NaOH及醋酸钠为洗脱剂。
采用此方法不仅一次性实现了低聚异麦芽糖常规组分中葡萄糖、麦芽糖、麦芽三糖、异麦芽糖、异麦芽三糖,潘糖的有效分离,也实现了异麦芽四糖、异麦芽五糖、异麦芽六糖、异麦芽七糖、海藻糖、麦芽酮糖、曲二糖、黑曲霉糖高聚合度糖及二糖同分异构体间的分离及检测。
以不同浓度的标准糖混合溶液建立了校正曲线,此方法中,各组分在0.032~25.975mg/L间具有良好的线性关系,各物质的检测限和定量限分别在0.008~0.022mg/L和0.027—0.073mg/L,样品加标回收率为82.02%~116.37%。
%A one-step method for quantitatively determination of isomahooligosaccharides (IMO) was developed using high performance anion exchange chromatography coupled with pulsed amperometric detection (HPAEC-PAD). The method was built on a CarboPakTM PAl0 column using NaOH and NaAC as eluents. Using this method, besides conventional components of isomahose, isomaltotriose, panose and some saccharides with higher DP were identified from IMO syrup, other transglycosylation saccharides such as trehalose, kojibiose, nigerose and maltulose were also detected from the syrup. Calibration was carried out by dissolving 15 kinds of standard samples containing glucose, fructose, maltose, maltotriose, isomaltose, isomaltotriose, isomaltotetraose, isomaltopentaose, isomaltohexaose, iso- maltoheptaose, panose, trehalose, maltulose, kojibiose, and nigerose into amixed solution. The standard solution was diluted to a calibration range from 0. 032 to 25. 975 mg/L. The calibration curves showed good linearityof IMO within this range. The detection limits (LODs) and the quatification limits (LQD) were 0. 008 - 0. 022 mg/L and 0. 027 -0. 073 mg/L respectively, and the relative standard deviations were 82.02% - 116.37%. This method was good and sensitive in the quantitative analysisof IMO.【期刊名称】《食品与发酵工业》【年(卷),期】2012(038)007【总页数】4页(P144-147)【关键词】低聚异麦芽糖;同分异构体;分离;高效阴离子交换色谱-脉冲安培法【作者】张晓萍;段钢【作者单位】杰能科(中国)生物工程有限公司,江苏无锡214028;杰能科(中国)生物工程有限公司,江苏无锡214028【正文语种】中文【中图分类】TS245.5低聚异麦芽糖是目前市场上最主要的一种功能性低聚糖,具有难消化性及选择性增殖双歧杆菌及乳酸杆菌从而维持肠道微生态平衡,促进人体健康的功能[1]。
高效离子交换色谱仪基本的两种检测器
高效离子交换色谱仪基本和常用的检测器是电导检测器,其次是安培检测器。
一、电导检测器:
电导检测器是基于极限摩尔电导率应用的检测器,主要用于检测无机阴阳离子、有机酸和有机胺等。
1、双极脉冲检测器:
在流路上设置两个电极,通过施加脉冲电压,在合适的时间读取电流,进行放大和显示。
容易受到电极极化和双电层的影响。
2、四极电导检测器:
在流路上设置四个电极,在电路设计中维持两测量电极间电压恒定,不受负载电阻、电极间电阻和双电层电容变化的影响,具有电子抑制功能(阳离子检测支持直接电导检测模式)。
3、五极电导检测器:
在四极电导检测模式中加一个接地屏蔽电极,极大提高了测量稳定性,在高背景电导下仍能获得极低的噪声,具有电子抑制功能(阳离子检测支持直接电导检测模式)。
二、安培检测器:
安培检测器是基于测量电解电流大小为基础的检测器,主要用于检测具有氧化还原特性的物质。
1、直流安培检测模式:
主要用于抗坏血酸、溴、碘、氰、酚、硫化物、亚硫酸盐、儿茶酚胺、芳香族硝基化合物、芳香胺、尿酸和对二苯酚等物质的检测。
2、脉冲安培检测模式:
主要用于醇类、醛类、糖类、胺类(一二三元胺,包括氨基酸)、有机硫、硫醇、硫醚和硫脲等物质的检测。
不可检测硫的氧化物。
3、积分脉冲安培检测模式:
为脉冲安培检测的升级检测模式,适用于检测脉冲安培检测的物质。
用高效离子交换色谱和脉冲安培检测器测定果汁和糖果中糖醇摘要:本文讨论了糖果和果汁中糖醇的分析,采用戴安公司的Carbopac MA1色谱柱,NaOH 为淋洗液梯度洗脱样品,用脉冲安培检测器分离糖醇。
由于Carbopac MA1色谱柱是分离糖醇的推荐柱子,适合于糖的选择性差异较大的分离,允许淋洗液的浓度有较大的变化。
CarboPac MA1柱分离糖醇具有高的灵敏度和选择性,用PAD检测所以不需要加入柱后衍生试剂。
该方法适合糖醇的分析,具有很好的重复性及灵敏度。
关键词:糖醇;阴离子交换柱;脉冲安培检测器糖醇有甜味而无热量,因此在糖果生产中用糖醇作甜味剂。
食品中(特别是减肥食品中)常用山梨醇(蔗糖甜度的60%)和甘露醇代替蔗糖[1],但因其有轻泻性和利尿性,在食品中它们的用量有一定限制。
糖醇(也称醛醇)是醛糖的还原型。
例如:D-葡萄糖可被还原成葡萄糖醇(山梨糖醇)[2]。
Carbopac MA1对糖醇有独特的选择性。
作为高效高容量的阴离子交换柱,Carbopac MA1 可用高浓度的NaOH为淋洗液分离糖醇。
与金属包覆的柱子不同,MA1柱可以在室温下用高浓度NaOH作为淋洗液,并用脉冲安培检测器检测得到最高的灵敏度;另外,用金属包覆的柱子时,大分子的糖先被淋洗,糖醇洗脱在后,而用MA1时,洗脱顺序取决于pKa值。
高pKa的糖醇先被洗脱,依次为单糖和有低pKa的双糖等。
本文讨论了糖果和果汁中糖醇的分析。
此外,Carbopac MA1柱也可用于体液、活组织和糖共轭物的还原糖(即β-裂解反应产物)的分离。
1 实验部分1.1 仪器与试剂梯度泵、脉冲安培检测器、色谱工作站50%(w/w)低CO32-的NaOH溶液;肌糖(纤维糖)、木糖醇、山梨糖醇、甘露醇、葡萄糖、果糖、蔗糖、己六醇、树脂醛糖甘露糖、木糖和半乳糖。
1.2色谱条件分离柱:Carbopac MA1(4×250mm);压力:800-1100psi进样体积:10μL淋洗液:A: 去离子水B: 1.0M NaOH流速:0.4mL/min;检测:脉冲安培,金工作电极;1.3试剂和标准的配制淋洗液B:1M NaOH,52mL NaOH(50%w/w)稀释至1.0L1.4样品的配制“无糖”硬糖:称3.4g于10mL水中,用水稀释1:1000。
高效阴离子交换色谱-脉冲安培检测法分析啤酒和麦汁中的糖潘媛媛;梁立娜;蔡亚岐;牟世芬【期刊名称】《色谱》【年(卷),期】2008(26)5【摘要】建立了高效阴离子交换色谱-脉冲安培检测(HPAEC-PAD)同时测定单糖、二糖和多种低聚糖的方法.采用水、0.25 mmol/L NaOH溶液和1 mol/L NaAc溶液三元梯度淋洗,在CarboPac PA-100色谱柱上,11种糖在40min内达到良好分离;采用积分脉冲安培检测方法,无需对样品进行复杂的前处理或衍生反应便可直接检测.11种糖的检出限(S/N=3)在13~88 pg范围内.将该方法用于啤酒和麦汁样品中单糖、二糖及低聚糖的分析取得了很好的结果,样品中的加标回收率为81%~107%.【总页数】5页(P626-630)【作者】潘媛媛;梁立娜;蔡亚岐;牟世芬【作者单位】中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京,100085;中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京,100085;中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京,100085;中国科学院生态环境研究中心,环境化学与生态毒理学国家重点实验室,北京,100085【正文语种】中文【中图分类】O658【相关文献】1.无糖和低糖食品中的糖和糖醇同时分析的阴离子交换色谱-脉冲安培检测法研究[J], 唐坤甜;林立;梁立娜;蔡亚岐;牟世芬2.高效阴离子交换色谱脉冲安培检测法测大气颗粒物(PM2.5、PM10)中10种糖醇类物质 [J], 刀谞;王超;吕怡兵;齐炜红3.高效阴离子交换色谱分离-脉冲安培检测法测定烟草料液中的糖、糖醇和醇类化合物 [J], 唐坤甜;梁立娜;蔡亚岐;牟世芬4.高效阴离子交换色谱-脉冲安培检测法同时测定生物转化样品中的海藻糖、葡萄糖和麦芽糖 [J], 徐颖;臧颖;姜婷;郑兆娟;欧阳嘉5.糖的高效阴离子交换色谱-脉冲安培检测法分析 [J], 牟世芬;于泓;蔡亚岐因版权原因,仅展示原文概要,查看原文内容请购买。
高效阴离子色谱一脉冲安培检测法测定
木糖的含量
高效阴离子色谱一脉冲安培检测法是一种用于测定木糖含量的分析方法。
它的基本原理是,将样品中的木糖通过酸化反应生成阴离子,然后使用高效阴离子色谱仪对阴离子进行分析。
具体测定步骤如下:
准备样品:将样品中的木糖通过酸化反应生成阴离子,并将生成的阴离子进行浓缩和提取。
进行阴离子色谱分析:使用高效阴离子色谱仪对阴离子进行分析,在适当的条件下进行一脉冲安培检测。
计算木糖含量:根据测定结果,计算木糖的含量。
通常使用一种叫做标准曲线法的方法来计算木糖含量。
在这种方法中,先准备一组标准样品,并对这些标准样品的木糖含量进行测定。
然后,在一张图上绘制出测定结果和标准样品的木糖含量之间的关系,这张图就是标准曲线。
最后,可以使用标准曲线计算待测样品的木糖含量。
总之,高效阴离子色谱一脉冲安培检测法是一种常用的测定木糖含量的分析方法,它具有较高的灵敏度和精确度。
用高效离子交换色谱和脉冲安培检测器测定果汁和糖果中糖醇
摘要:本文讨论了糖果和果汁中糖醇的分析,采用戴安公司的Carbopac MA1色谱柱,NaOH 为淋洗液梯度洗脱样品,用脉冲安培检测器分离糖醇。
由于Carbopac MA1色谱柱是分离糖醇的推荐柱子,适合于糖的选择性差异较大的分离,允许淋洗液的浓度有较大的变化。
CarboPac MA1柱分离糖醇具有高的灵敏度和选择性,用PAD检测所以不需要加入柱后衍生试剂。
该方法适合糖醇的分析,具有很好的重复性及灵敏度。
关键词:糖醇;阴离子交换柱;脉冲安培检测器
糖醇有甜味而无热量,因此在糖果生产中用糖醇作甜味剂。
食品中(特别是减肥食品中)常用山梨醇(蔗糖甜度的60%)和甘露醇代替蔗糖[1],但因其有轻泻性和利尿性,在食品中它们的用量有一定限制。
糖醇(也称醛醇)是醛糖的还原型。
例如:D-葡萄糖可被还原成葡萄糖醇(山梨糖醇)[2]。
Carbopac MA1对糖醇有独特的选择性。
作为高效高容量的阴离子交换柱,Carbopac MA1 可用高浓度的NaOH为淋洗液分离糖醇。
与金属包覆的柱子不同,MA1柱可以在室温下用高浓度NaOH作为淋洗液,并用脉冲安培检测器检测得到最高的灵敏度;另外,用金属包覆的柱子时,大分子的糖先被淋洗,糖醇洗脱在后,而用MA1时,洗脱顺序取决于pKa值。
高pKa的糖醇先被洗脱,依次为单糖和有低pKa的双糖等。
本文讨论了糖果和果汁中糖醇的分析。
此外,Carbopac MA1柱也可用于体液、活组织和糖共轭物的还原糖(即β-裂解反应产物)的分离。
1 实验部分
1.1 仪器与试剂
梯度泵、脉冲安培检测器、色谱工作站
50%(w/w)低CO32-的NaOH溶液;
肌糖(纤维糖)、木糖醇、山梨糖醇、甘露醇、葡萄糖、果糖、蔗糖、己六醇、树脂醛糖甘露糖、木糖和半乳糖。
1.2色谱条件
分离柱:Carbopac MA1(4×250mm);压力:800-1100psi
进样体积:10μL
淋洗液:A: 去离子水
B: 1.0M NaOH
流速:0.4mL/min;检测:脉冲安培,金工作电极;
1.3试剂和标准的配制
淋洗液B:1M NaOH,52mL NaOH(50%w/w)稀释至1.0L
1.4样品的配制
“无糖”硬糖:称3.4g于10mL水中,用水稀释1:1000。
苹果汁:稀释苹果汁1:1000。
口香糖:取一小片(约2.7g)口香糖放入10mL水中,超声溶解10min,过On-Guard A 预处理柱以除去阴离子,再通过0.45μm滤膜除去颗粒物。
用水稀释1000倍,备用。
2 结果与讨论
Carbopac MA1允许用NaOH淋洗液的浓度范围是0-1M。
该点非常重要,因糖醇的pKa 高,而且各不相同。
在MA1柱上分离时,淋洗液的pH值接近糖醇的pKa值。
改变淋洗液NaOH的浓度可改变淋洗液的pH值,从而改变化合物的有效电荷和洗脱顺序,达到好的分离结果。
图1A和图1B是一些糖醇的淋洗液浓度和容量因子的关系。
从图可找出糖醇分离的最佳浓度。
图1A 一些糖醇的Logk’与Log[NaOH]之间的关系
图1B 一些糖类的Logk’与Log[NaOH]之间的关系
图2为“无糖”硬糖的色谱图。
这种糖是作为减肥食品卖的。
它的电化学活性水溶组分主要是山梨醇和甘露醇。
3.4g的糖果中含的山梨醇和甘露醇分别是2.7g和50.5mg。
图2“无糖”硬糖中山梨醇和甘露醇的色谱图
图3为稀释苹果汁的色谱图,在所有果汁中都有葡萄糖、果糖和蔗糖。
而山梨糖醇只在苹果、梨、杏和另一些水果中找到[4]。
8-ounce(237-mL)的果汁中含有1.86g山梨醇、8.22g 葡萄糖、18.8g果糖和7.76g蔗糖。
图3稀释苹果汁中山梨醇的色谱图
图4为口香糖的色谱图。
4个峰分别为丙三醇、山梨糖醇、甘露醇和氢化葡萄糖。
2.7g 口香糖中含有218mg丙三醇、1140mg山梨醇、280mg甘露醇。
氢化葡萄糖没有定量测定。
图4口香糖中丙三醇、山梨醇和甘露醇的色谱图
PAD检测器通常都能检测到较低的浓度。
PAD检测器在电极上施加电压使糖氧化,从而可以得到较低的检测限并提高选择性,消除基体干扰。
PAD检测器重复施加三电位电压,具体设置见TN21[3]。
为了能够使工作电极发生氧化反应,淋洗的pH应大于12。
戴安公司生产的CarboPac 系列的柱子都是聚合物基的柱子,可以在pH 0-14稳定。
关于PAD检测糖的进一步的信息请参考TN20[5]。
3 结论
CarboPac MA1柱是分离糖醇的推荐柱子,适合于糖的选择性差异较大的分离,允许淋洗液的浓度有较大的变化。
CarboPac MA1柱分离糖醇具有高的灵敏度和选择性,用PAD检测所以不需要加入柱后衍生试剂。
柱子可以在室温下使用从而方便操作并延长柱子的使用寿命。
与其他CarboPac柱相比,具有更好的重复性。
参考文献
1. Shaw PE. CRC Handbook of Sugar Separations in Food by HPLC; CRC Press, Boca Raton, Florida, 1988.
2. Solomons TWG. Organic Chemistry, 2nd ed., John Wiley & Sons, New York, 1980.
3. Dionex Technical Note 21: “Optimal Settings for Pulsed Amperometric Detec tion of Carbohydrates using the
Dionex Pulsed Electrochemical Detector (PED-2) and the Pulsed Amperometric Detector (PAD-2)”.
4. Coppola ED. Food Technology, 1984, 38(4), 88-91.
5. Dionex Technical Note 20: “Analysis of Carbohydrates by Anion Exchange C hromatography with Pulsed Amperometric Detection”.。