水杨醛缩乙二胺席夫碱及金属铜(Ⅱ)配合物的合成
- 格式:doc
- 大小:531.00 KB
- 文档页数:3




水杨醛Schiff碱及其金属配合物的合成摘要】水杨醛Schiff碱及其金属配合物在目前各学科的相关研究领域的应用已经得到广泛关注。
而对于合成的水杨醛Schiff碱及其金属配合物的合成而言,一般可以用红外、紫外以及荧光光谱等来实施光谱分析,用以确定其合成的是否为想要得到的目标产物。
【关键词】Schiff碱金属配合物合成1.有关 Schiff 碱及其金属配合物的概述Schiff碱是一种含有亚胺、甲亚胺特性基团(-RC=N-)的有机化合物,一般由胺和活性羰基缩合而成的。
Schiff碱的C=N键的长度在0.124~0.128nm之间,其偶极矩约为0.90D。
与此同时,schiff碱有顺(Z)-、反(E)-两种主要的构型。
而存在其结构中的亚胺基属于极活泼的基团,能够和氰氢酸发生反应形成α-氨基酸,与丙二酸二乙酯反应生生成β-氨基酸还可以与格利雅试剂发生反应生成胺的衍生物,还可以水解作用生成醛或酮和胺。
伴随着生物科学以及化学科学的的不断发展和进步,Schiff碱及其金属配合物的应用已经在医学、催化、分析化学中得到了普遍和广泛的应用。
在医学中,Schiff碱能够用在抑菌、杀菌、抗病毒等;而在催化领域中,Schiff碱在一些具有催化作用的配合物的作用下可以作为催化剂进行相应的应用;对于有关的分析领域而言,Schiff碱能够作为一种非良好的配体用来对金属离子进行鉴定同时还可以对金属离子做一定的定量分析在此基础上分析出其具体含量的多少。
Schiff碱以及金属配合物具有的生物活性已经得到了很大的重视,尤其是在医学研究领域中的抗菌、抗肿瘤、抗氧化等方面。
为了找出高效低毒的药物,我们合成了大量的、不同类型的Schiff碱及其金属配合物对其生物活性进行了研究。
由于在Schiff碱中有C=N键的存在,其轨道上的N原子是含有孤对电子的,可见其具有相当重要的化学和生物学价值。
单纯的schiff碱的水溶性是比较差的,而其水溶性的高低直接影响到的是schiff碱在在具体应用领域中的应用。

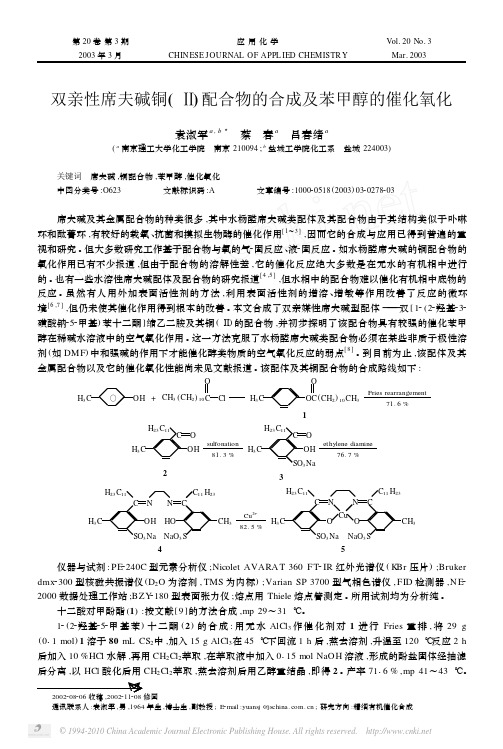
双亲性席夫碱铜(Ⅱ)配合物的合成及苯甲醇的催化氧化袁淑军a ,b 3 蔡 春a 吕春绪a(a 南京理工大学化工学院 南京210094;b 盐城工学院化工系 盐城224003)关键词 席夫碱,铜配合物,苯甲醇,催化氧化中图分类号:O623 文献标识码:A 文章编号:100020518(2003)03202782032002208206收稿,2002211208修回通讯联系人:袁淑军,男,1964年生,博士生,副教授;E 2mail :yuansj @ ;研究方向:精细有机催化合成席夫碱及其金属配合物的种类很多,其中水杨醛席夫碱类配体及其配合物由于其结构类似于卟啉环和酞菁环,有较好的载氧、抗菌和摸拟生物酶的催化作用[1~3],因而它的合成与应用已得到普遍的重视和研究。
但大多数研究工作基于配合物与氧的气2固反应、液2固反应。
如水杨醛席夫碱的铜配合物的氧化作用已有不少报道,但由于配合物的溶解性差,它的催化反应绝大多数是在无水的有机相中进行的。
也有一些水溶性席夫碱配体及配合物的研究报道[4,5],但水相中的配合物难以催化有机相中底物的反应。
虽然有人用外加表面活性剂的方法,利用表面活性剂的增溶、增敏等作用改善了反应的微环境[6,7],但仍未使其催化作用得到根本的改善。
本文合成了双亲媒性席夫碱型配体———双[12(22羟基232磺酸钠252甲基)苯十二酮]缩乙二胺及其铜(Ⅱ)的配合物,并初步探明了该配合物具有较强的催化苯甲醇在稀碱水溶液中的空气氧化作用。
这一方法克服了水杨醛席夫碱类配合物必须在某些非质子极性溶剂(如DMF )中和强碱的作用下才能催化醇类物质的空气氧化反应的弱点[8]。
到目前为止,该配体及其金属配合物以及它的催化氧化性能尚未见文献报道。
该配体及其铜配合物的合成路线如下:θH 3C OH +C CH 3(CH 2)10OCl H 3C OC O (CH 2)10CH 31Fries rearrangement 71.6%H 3COH C H 23C 11O 2sulfonation 81.3%H 3COH C H 23C 11O SO 3Na3ethylene diamine 76.7%H 3C OHC H 23C 11N N C 11H 23HO CH 3NaO 3S SO 3Na 4Cu 2+82.5%H 3C O Cu CH 23C 11N N C 11H 23O CH 3NaO 3S SO 3Na5仪器与试剂:PE 2240C 型元素分析仪;Nicolet AVARA T 360F T 2IR 红外光谱仪(K Br 压片);Bruker dmx 2300型核磁共振谱仪(D 2O 为溶剂,TMS 为内标);Varian SP 3700型气相色谱仪,FID 检测器,N E 22000数据处理工作站;BZY 2180型表面张力仪;熔点用Thiele 熔点管测定。

水杨醛缩乙二胺希夫碱及金属配合物的合成一实验目的1 掌握水杨醛缩乙二胺席夫碱碱合成的基本原理和方法。
2 复习回流、重结晶、热过滤、洗涤等基本操作方法。
3掌握磁力搅拌器的使用方法。
二实验原理水杨醛及其衍生物是重要的有机合成中间体。
由水杨醛及其衍生物与胺类化合物反应生成的希夫碱与其金属配位生成的金属配合物在医药、催化、分析化学、腐蚀和光致变色领域有着重要应用,因而受到人们的广泛关注。
本文对回流条件下双水杨醛缩乙二胺Schiff 碱及金属铜(Ⅱ)配合物的合成进行了研究。
席夫碱碱的合成是涉及到加成、重排、消去等过程的一种缩合反应。
反应物的立体结构及电子效应在合成中起着重要作用,其反应机理如下图:本实验采用水杨醛和乙二胺在50℃的条件下用回流法制备相应的Schiff碱配体L,反应方程式如下:希夫碱基团通过碳氧双键(-C=N-)上的氮原子与相邻的具有孤对电子的氧(O)、硫(S)、磷(P)原子作为给体与金属原子配对,所以氮原子相邻位置存在这类原子的Schiff碱往往具有高配位能力。
M2+为金属离子(M2+分别为Cu2+、Zn2+、Ni2+、Mn2+、Ni2+等离子)二仪器和药品1 仪器100mL三口烧瓶恒压滴液漏斗磁力搅拌器玻璃塞抽滤瓶烧杯2 药品水杨醛(相对分子质量122.12,密度1.17g/cm³乙二胺(相对分子质量60.10,密度0.90g/cm³无水乙醇乙酸铜、硝酸钴、乙酸锰、乙酸锌、硝酸锌、氯化镍三实验步骤1 希夫碱配体(L)的合成步骤移取5.2mL(0.05mol)的水杨醛与15 mL的无水乙醇溶于三口瓶中,再量取1.8mL(0.025mol)的乙二胺与10mL的无水乙醇于烧杯中搅拌溶解。
将三口瓶固定在搅拌器上,开启仪器,将乙二胺的无水乙醇溶液逐滴滴加到三口瓶中,恒温55℃反应1小时。
反应结束。
抽滤得黄色的固体,干燥称重并计算产率。
反应装置图如下:乙二胺的无水乙醇溶液2 希夫碱配体(L)与金属离子(M2+)的反应步骤称取1.34g(0.005mol)配体L,与20 mL的无水乙醇混合溶解于三口瓶中,在称取金属盐,若为乙酸铜时质量为1g(0.005mol)。

水杨醛缩乙二胺席夫碱及金属铜(Ⅱ)配合物的合成一实验目的1 掌握水杨醛缩乙二胺Schiff 碱合成的基本原理和方法2 复习回流、重结晶、热过滤、洗涤等基本操作方法3 掌握磁力搅拌器的使用方法二实验原理水杨醛及其衍生物是重要的有机合成中间体。
由水杨醛及其衍生物与胺类化合物反应生成的席夫碱与其金属配位生成的金属配合物在医药、催化、分析化学、腐蚀和光致变色领域有着重要应用,因而受到人们的广泛关注。
本文对回流条件下双水杨醛缩乙二胺Schiff 碱及金属铜(Ⅱ)配合物的合成进行了研究。
Schiff碱的合成是涉及到加成、重排、消去等过程的一种缩合反应。
反应物的立体结构及电子效应在合成中起着重要作用,其反应机理如下图:本实验采用水杨醛和乙二胺在50℃的条件下用回流法制备相应的Schiff碱配体L,反应方程式如下所示:席夫碱基团通过碳氧双键(-C=N-)上的氮原子与相邻的具有孤对电子的氧(O)、硫(S)、磷(P)原子作为给体与金属原子配对,所以氮原子相邻位置存在这类原子的Schiff碱往往具有高配位能力。
COHHNCH 22HCNCHOH2+COHCH 22HCNCMOHM 2+为金属离子(M 2+分别为Cu 2+、Zn 2+、Ni 2+等离子)二 仪器和药品 1 仪器100ml 三口烧瓶 恒压滴液漏斗 磁力搅拌器 玻璃塞 抽滤瓶 烧杯 2 药品水杨醛(相对分子质量122.12 ,密度1.17g/cm³0) 乙二胺(相对分子质量 60.10,密度 (0.90g/cm³0) 无水乙醇 硫酸铜三 实验步骤1 希夫碱配体(L )的合成步骤移取10.4ml (0.1mol )的水杨醛与25 ml 的无水乙醇溶于三口瓶中,再量取3.6ml (0.05mol )的乙二胺与15ml 的无水乙醇于烧杯中搅拌溶解。
将三口瓶固定在搅拌器上,开启仪器,将乙二胺的无水乙醇溶液逐滴滴加到三口瓶中,恒温55℃反应1小时。

水杨醛缩苯胺Cu(Ⅱ)配合物的合成及表征一、实验目的(1)通过查阅文献设计实验路线,了解席夫碱的性质及用途,了解制备席夫碱的基本方法及反应的基本原理。
(2)掌握制备水楊醛缩苯胺Cu(Ⅱ)配合物的方法。
二、实验原理席夫碱简介:席夫碱是指含亚胺(-CH=N-)或甲亚胺基(-C=N-)的一类有机化合物,可以与许多金属离子通过配位键形成配合物。
席夫碱可以由伯胺与活泼毅基化合物缩合制得,其特点是能够灵活地选择反应物,改变取代基给予体原子本性及其位置,便于开拓出许多从链状到环合,从单齿到多齿的性能各异,结构多变的席夫碱配体,如单齿席夫碱、双齿席夫碱、不对称席夫碱、异双席夫碱等。
水杨醛的物理化学性质分子式C7H6O2,分子量112.12。
水杨醛又称邻羟基苯甲醛,是无色或深红色油状液体。
具有苦杏仁气味。
熔点-7℃,沸点196.5℃、密度(20/4℃)1.167g/cm3。
微溶于水,溶于乙醇、乙醚和苯中。
能与蒸气一起挥发。
水杨醛的分子式:苯胺的物理化学性质分子式C6H5NH2 ,分子量93.128无色油状液体。
熔点-6.3℃,沸点184℃,相对密度 1.02 (20/4℃),加热至370℃分解。
稍溶于水,易溶于乙醇、乙醚等有机溶剂。
暴露于空气中或日光下变为棕色。
可用水蒸气蒸馏,蒸馏时加入少量锌粉以防氧化。
提纯后的苯胺可加入10~15ppm的NaBH4,以防氧化变质。
间甲苯胺分子式:合成产物的相关化学方程式:★本实验采用水杨醛及苯胺合成水杨醛缩苯胺配体席夫碱化合物乙醇中培养出水杨醛缩苯胺Cu的配合物晶体2 +CuCl2→Cu(Ⅱ)离子的测定三、实验仪器与试剂★仪器:磁力加热搅拌器、电热套、小烧杯、玻璃棒、布氏漏斗、抽滤瓶、滤纸、250ml容量瓶、移液管、滴定管、PH试纸、天平、熔点仪、锥形瓶★药品:水杨醛、苯胺、无水乙醇(A.R)、10%KI溶液、Na2S2O3标准溶液、1%淀粉溶液、CuCl2固体(A.R)甘油、浓硫酸四、实验步骤1、水杨醛缩苯胺席夫碱配体的合成称取11.2g(0.10mol)水杨醛于干燥的小烧杯中→磁力搅拌器中升温至30℃→迅速加入9.3g(0.10mol)苯胺→搅拌→升温至50—60℃时→恒温搅拌15 min→将其混合液倒入70%的乙醇溶液中→冷却→结晶→抽滤→用无水乙醇和乙醚各洗涤两次→粗产品用无水乙醇重结晶→烘干(得微黄色针状晶体)→称量→测量熔点2、水杨醛缩间甲基苯胺schiff碱配合物合成取3.7g(0.02mol)制得的席夫碱和1.8g(0.01mol)CuCl2·2H2O 溶于6mL乙醇中→边加热边搅拌(大概1h)→完全反应后冷却→抽滤→用水和无水乙醇各洗涤三次→烘干→称量→测量熔点3.配合物中Cu(Ⅱ)含量的测定(1)Na2S2O3标准溶液的滴定★准确称取K2Cr2O7(g)0.05~0.07g于锥形瓶→加入10~20mL去离子水→加入20mL 10%KI溶液和5mL6mol/L的HCl→在暗处放置5min后滴定★用Na2S2O3标准溶液滴定到呈浅黄绿色→加入1%淀粉溶液1mL →继续滴定至蓝色变为绿色(终点)★平行测定三次★根据K2Cr2O7的质量以及消耗的Na2S2O3溶液体积,计算Na2S2O3溶液浓度(2)Cu(Ⅱ)含量的测定★准确称取1g所制得的配合物→用容量瓶配成250mL溶液→用移液管移取25mL溶液于锥形瓶→缓慢加入2—3mL浓硫酸并加热至沸一段时间→加入7—8mL10%KI溶液→立即用Na2S2O3标准溶液滴定至浅黄色→加入1mL1%淀粉溶液→继续滴定至米色悬液(终点)★平行测定三次★记录数据,计算配合物中Cu(Ⅱ)的含量4.测定配合物的红外光谱将所得配合物用KBr压片,在红外光谱仪上记录某一范围的红外光谱图,并标识主要的特征吸收峰。

双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物的合成及其晶体结构
本文讨论了双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物的合成及其晶体结构。
首先,我们用抗坏血酸与硝酸铜反应,合成了双核铜(ⅱ)离子。
然后,将锡铜金属离子与β-丙氨酸酰基缩水杨醛席夫碱反应,成功地合成了目标配合物。
最后,我们通过X射线晶体学分析技术,分析了该配合物的三维晶体结构。
实验结果表明,所合成的双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物具有四角柱形亚单元构型,由八个铜离子聚集而成,并与两个缩水杨醛席夫碱分子存在八个键合点,其中两个存在螯合键,六个存在氢键。
通过结构分析,可以清楚地看到缩水杨醛席夫碱分子存在螯合关系,并与铜离子发生键合作用。
该配合物是一种以金属离子与有机缩水杨醛席夫碱配体结合的金属框架结构,具有很强的稳定性和特殊的催化活性,能够有效地应用
于有机合成中的催化和加氢反应,以及生物领域的药物开发等关键领域。
因此,双核铜(ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物重要性在于其具有良好的稳定性和特殊功能,能够有效应用于有机合成中的催化和加氢反应,以及生物领域的药物开发等关键领域。

化学与生物工程2011,Vol.28No.7Chemistry &Bioen gineering55基金项目:黑龙江省教育厅资助项目(1030129)收稿日期:2011-04-28作者简介:李翠勤(1978-),女,河南人,硕士,讲师,主要从事精细化学品合成及聚烯烃的化学改性。
E mail:licuiqin78@163.com 。
doi:10.3969/j.issn.1672-5425.2011.07.013水杨醛缩胺类双席夫碱过渡金属配合物的合成与表征李翠勤1,孟祥荣2,张 鹏1,景常荣2,刘长环1,朱秀雨1(1.东北石油大学化学化工学院,黑龙江大庆163318;2.大庆石化公司化工一厂,黑龙江大庆163714)摘 要:以水杨醛与乙二胺为原料,通过席夫碱反应合成一类水杨醛缩胺类双席夫碱,并进一步与铜、锌、镍3种金属离子络合得到3种过渡金属配合物;采用元素分析、红外光谱和紫外光谱对席夫碱及其金属配合物的结构进行表征。
结果表明,合成的水杨醛缩乙二胺配体分子结构与理论结构相符,且分别与铜、锌、镍离子络合形成了稳定的过渡金属配合物。
关键词:水杨醛;席夫碱反应;金属配合物中图分类号:O 625.62 文献标识码:A文章编号:1672-5425(2011)07-0055-03席夫碱是一类非常重要的配体,通过改变连接的取代基、变化电子给予体原子本性及其位置,便可开拓出许多从链状到环状、从单齿到多齿的性能迥异、结构多变的席夫碱配体,这些配体可以与周期表中大部分金属离子形成不同稳定性的配合物[1,2]。
目前,研究较多的是水杨醛及其衍生物的席夫碱,其中水杨醛缩胺类双席夫碱是一类有代表性的离域 共轭有机分子,在合成上具有极大的灵活性和强络合作用,因具有良好的电子转移性质而成为人们研究的热点[3,4]。
此类席夫碱具有一个N,N,O,O 构成的空腔,可以容纳金属离子,形成稳定的金属配合物[5]。
张英菊等[6]对水杨醛缩乙二胺配体结构研究表明,水杨醛缩乙二胺配体失去两个酚羟基上的氢,随后与Ni 、M n 等过渡金属离子形成稳定的四齿配合物,该配合物的稳定性随配位原子数的增加而增大。



2009 年11 月NOV . 2009J O U RN AL O F XIAO GA N U N IV ERSI T Y水杨醛缩邻苯二胺与Cu (Ⅱ)、Ni (Ⅱ)配合物的微波合成丁瑜,胡晓霞,左志岭,孙晓莉,伊(孝感学院化学与材料科学学院,湖北孝感432000)然摘要:采用微波辐射方法合成了水杨醛缩邻苯二胺S chiff 碱及其Cu ( Ⅱ) 、Ni ( Ⅱ) 两种金属配合物;通过红外光谱、元素分析、热重2差热对S chiff 碱及其配合物进行了表征。
采用循环伏安法研究了两种配合物在DM F溶液中的电化学性质。
关键词: S chiff 碱;铜镍配合物;电化性质;微波文章编号:1671 - 2544 (2009) 06 - 0009 - 04 中图分类号: O613 . 5 文献标识码: A双齿及多齿Schiff 碱配体配合物在催化、金属酶模拟和磁性研究等方面具有很重要的作用[ 1 ] 。
各种各样的此类配体的配合物已被有目的地合成出来[ 2 - 6 ] 。
含C = N 结构的金属配合物, 以其良好的抗菌、抗癌和抗病毒等广泛的生物活性和药物活性及仿酶催化活性而倍受人们的关注。
水杨醛缩邻苯二胺Schiff 碱H2 ( salp he n) 配体的单核和同、异双核配合物已有文献报道,已报道的配合物结构中,过渡金属原子的配位环境大多为六配位、八面体结构[ 7 - 9 ] 。
低热液相反应是现今所提倡的绿色化学工业生产中一种节能、高效、减污的合成方法[ 10 - 13 ] 。
微波辐射辅助液相合成,能简化反应步骤、缩短反应时间、方便分离产物、提高产率和产品纯度[ 14 ,15 ] 。
与传统加热条件下溶液中的配位化学反应相比,利用微波辐射进行液相合成速度提高了几十倍甚至几百倍,且进行得很完全,产率较高。
本文采用微波合成方法合成了水杨醛缩邻苯二胺Schiff 碱,并合成了Schiff 碱- 咪唑- 过渡金属离子三元混配配合物,并研究了两种配合物在DM F 中的电化学性质,研究表明,两种配合物均具有较好的电化学活性。



双核铜(Ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物的合成及其性质冯小珍;李金虹;刘峥【摘要】以β-丙氨酸、水杨醛和乙酸铜为原料在乙醇溶液中合成了双核铜(Ⅱ)-β-丙氨酸缩水杨醛席夫碱配合物[Cu2(β-ala-sala)2·H2O]·H2O,采用元素分析、IR、紫外光谱、热重分析对其结构进行了表征.分别用循环伏安法和抗菌活性实验研究了配合物的电化学性质和抗菌活性,结果表明:该配合物的电化学行为是一个不可逆过程,且具有比青霉素更好的抗菌活性.【期刊名称】《桂林理工大学学报》【年(卷),期】2007(027)004【总页数】3页(P562-564)【关键词】氨基酸席夫碱;铜配合物;抗菌活性;电化学性质【作者】冯小珍;李金虹;刘峥【作者单位】桂林工学院,材料与化学工程系,广西,桂林,541004;桂林电子科技大学,电子工程学院,广西,桂林,541004;桂林工学院,材料与化学工程系,广西,桂林,541004【正文语种】中文【中图分类】O614.121研究氨基酸类Schiff碱及其金属配合物有助于了解金属离子-蛋白质间的键合作用,并且可以作为生物模拟,因而合成氨基酸类Schiff碱具有重要意义[1-3].文献[4]报道含O、N、S的Schiff碱类配合物具有较高的生物活性、催化活性和抗癌活性,文献[5]报道了[Cu2(β-ala-sala)2·H2O]·H2O单晶结构,但并未见到有关该配合物性质研究的报道.笔者合成了该化合物,用X射线单晶衍射分析证实了配合物的结构,分别用循环伏安法和抗菌活性实验研究了配合物的电化学性质和抗菌活性.1.实验部分1.1 仪器和试剂德国Elementar Vario ELⅢ型元素分析仪,STA-449C热重分析仪,电热恒温培养箱CHHB11500,集热式恒温加热磁力搅拌器DF-101S,北京产XT4双目显微熔点测定仪(温度计未经校正),电化学工作站CHI660B.β-丙氨酸(生化试剂,BR),中国医药上海化学试剂公司;水杨醛(CP),上海化学试剂站中心化工厂生产;醋酸铜(AR),广东汕头新宁化工厂生产.大肠杆菌[CMCC(B)44 103],金黄色葡萄球菌[CMCC(B)26 003],藤黄微球菌[CMCC(B)28 001],短小芽孢杆菌[CMCC(B)63 202],枯草芽孢杆菌[CMCC(B)46 117].固体营养琼酯培养基(中国中科昆虫生物技术开发公司).1.2 合成5 mmol β-丙氨酸和5 mmol氢氧化钾溶于20 mL蒸馏水中,置于65℃水浴中加热搅拌,逐滴加入10 mL含5 mmol水杨醛的乙醇溶液,反应约2 h,再滴加20 mL含5 mmol Cu(Ac)2的水溶液,65℃下继续反应5 h,过滤,旋转蒸发浓缩滤液,析出绿色固体,干燥,产率75%.粗品用甲醇重结晶得到绿色透明的针状晶体.熔点241℃,C20H22Cu2N2O8计算值(%):C 44.06;H 4.04;N 5.14;O 23.47;Cu 23.29.实验值(%):C 44.10;H 4.06;N 5.17;O 23.45;Cu 23.22.合成路线如下:图1 合成路线示意图Fig.1 Sketch map of synthesis route2 结果与讨论2.1 配合物IR光谱用KBr压片法,在4 000~400 cm-1范围内测定了配合物及配体的红外光谱(表1).红外数据表明:配合物在ν=CN、νas(COO-)、νs(COO-)、ν(Ph-O-)的吸收峰由配体中1 649、1 558、1 409.9、1 280.6 cm-1处分别移至1 635.5、1 539、1 390.6、1 261.4 cm-1,表明配体中亚胺基N原子、羧基氧及酚氧均参与配位.此外,在466.7和408.2 cm-1分别观测到Cu—N和Cu—O的伸缩振动吸收峰.配合物在3 361.7 cm-1附近出现强而宽的O—H振动带,表明配合物中有水分子存在,可能为结晶水和配位水的伸缩振动峰.在1 579.6和623.0 cm-1有吸收峰,表明配合物有配位水存在,而在3 200~3 500 cm-1范围内呈现出吸收峰,表明配合物存在较强的氢键.2.2 紫外光谱以甲醇为溶剂,在220~500 nm进行扫描,其特征吸收列于表1.游离配体在紫外光区(200~4 0 0 nm)产生强烈的吸收,其最大吸收峰为311.5与253.0 nm.在311.5 nm处产生的吸收峰是=C N基团中氮原子的p轨道上的孤对电子与苯环大π键的p-π共轭的n-π*吸收带;在253.0 nm处的吸收峰可归属为席夫碱共轭体系的吸收(π-π*跃迁).在配合物中—=CH N—上的π-π*跃迁为364 nm,红移了53 nm,表明席夫碱配体的=C N参与了金属离子的配位.2.3 热重分析配合物的热分解过程及其对应的分解温度及失重率(括号内为理论值)如下:可以看出,实验值与理论值较吻合,在热分解过程中,结晶水与配位水的分解温度很接近,说明这两种水在分子中的结合力接近,可能是由于结晶水在分子中形成氢键有关,这与单晶结构分析得出的结论相吻合.2.4 循环伏安性质研究以玻碳电极为工作电极,Ag/AgCl(饱和KCl溶液)为参比电极(RE),铂丝电极为辅助电极(AE)构成三电极系统.扫描速度为100 mV·s-1.高氯酸锂(0.1 mol·L-1)为支持电解质,在CHI660B电化学工作站上完成,图2为配合物的循环伏安曲线,在负向扫描过程中,于-0.759 0 V给出一个还原峰.由于在所示电位范围内,金属离子是唯一的电化学活性物质.因此,此峰为Cu(Ⅱ)的双电子还原.同时在逆向扫描过程中看到在1.044 8和1.625 1 V处分别给出2个氧化峰,表明还原产物在电极表面发生单电子分步氧化.对此的解释是最终的还原产物金属铜在电极表面存在.由图2可以看出,标题配合物在电极上的反应为不可逆过程.2.5 抗菌活性将配体、醋酸铜用少量甲醇溶解,用无水甲醇稀释配成1 mg/mL的溶液,配合物用生理盐水做5个浓度的梯度稀释,使C1、C2、C3、C4、C5分别含药为1、0.5、0.25、0.125和0.1 mg/mL.对照溶液浓度:青霉素1 mg/mL;土霉素40μg/mL;罗红霉素10 μg/mL;交沙霉素30 μg/mL.表1 化合物的光谱数据Table 1 Spectrum data of the ligand and the complexcm-1图2 配合物的循环伏安曲线Fig.2 Cyclic voltammogram of the title complex 参考文献[6]的方法,每个试样均平行测试3次,以平均值作为最后的实验结果.实验显示,醋酸铜、甲醇、生理盐水对受试菌种不产生抑制作用.而配合物对5种试验菌均产生较强的抑制作用,抑制作用随着浓度的降低而减弱,本实验条件下,配合物的抑菌能力比青霉素强,配合物的最低抑菌浓度为0.1 mg/mL,低于这个浓度配合物基本没有抑菌能力.配合物显著的抑菌效果可能来源于配合物对细菌有特殊的构效性.表2 双核铜(Ⅱ)配合物的抑菌圈直径Table 2 Diameter of the inhibitionzonemm注:1—大肠杆菌;2—金黄色葡萄球菌;3—藤黄微球菌;4—短小芽孢杆菌;5—枯草芽孢杆菌;Ⅰ—配体;Ⅱ—生理盐水;Ш—甲醇;Ⅳ—醋酸铜;Ⅴ—青霉素;Ⅵ—土霉素;Ⅶ—罗红霉素;Ⅷ—交沙霉素【相关文献】[1]Svajlenova O,Vanco J,Marek J.Di-mu-aqua-bis[(N-salicylidene-beta-alaninato-kappa3O,N,O)copper(II)]ureadisolvate[J].Acta Crystallogr.,Sect.C:Cryst.Struct.,2004,60(6):275-277.[2]Marek J,Vanco J,Svajlenova O.Catena-poly[potassium[copper(II)-μ-isothiocyanato-μ-N-salicylidene-β-alaninato(2-)]][J].Acta Crystallogr.,Sect.C:Cryst.Struct.,2003,59(12):509-511.[3]Lou B Y,Yuan D Q,Wu B L,et al.A self-assembled molecular ladder withCu(H2O)4units as cross rungs[J].Inorg.Chem.,2005,8(6):539-542.[4]马长勤,王续宁,张文兴,等.含N,O和S的Schiff碱配体的双核锌配合物的合成与晶体结构[J].化学学报,1996,54(6):562-567.[5]Werner P E,Valent A,Adelskoeld V,et al.The crystal structure of aquabis(N-salicylid ene-alanin-ato)dicopper(II)monohydrate[J].Acta Chemica Scandinavica,Series A:Physical and Inorganic Chemistry,1983,37(1):51-55.[6]国家药典委员会.中国药典2005版Ⅱ部[K].北京:化学工业出版社,2005.。


水杨醛缩乙二胺席夫碱及金属铜(Ⅱ)配合物的合成
一实验目的
1 掌握水杨醛缩乙二胺Schiff 碱合成的基本原理和方法
2 复习回流、重结晶、热过滤、洗涤等基本操作方法
3 掌握磁力搅拌器的使用方法
二实验原理
水杨醛及其衍生物是重要的有机合成中间体。
由水杨醛及其衍生物与胺类化合物反应生成的席夫碱与其金属配位生成的金属配合物在医药、催化、分析化学、腐蚀和光致变色领域有着重要应用,因而受到人们的广泛关注。
本文对回流条件下双水杨醛缩乙二胺Schiff 碱及金属铜(Ⅱ)配合物的合成进行了研究。
Schiff碱的合成是涉及到加成、重排、消去等过程的一种缩合反应。
反应物的立体结构及电子效应在合成中起着重要作用,其反应机理如下图:
本实验采用水杨醛和乙二胺在50℃的条件下用回流法制备相应的Schiff碱配体L,反应方程式如下所示:
席夫碱基团通过碳氧双键(-C=N-)上的氮原子与相邻的具有孤对电子的氧(O)、硫(S)、磷(P)原子作为给体与金属原子配对,所以氮原子相邻位置存在这类原子的Schiff碱往往具有高配位能力。
C
OH
H
N
CH 2
2HC
N
C
HO
H
2+
C
O
H
CH 2
2HC
N
C
M
O
H
M 2+为金属离子(M 2+分别为Cu 2+、Zn 2+、Ni 2+等离子)
二 仪器和药品 1 仪器
100ml 三口烧瓶 恒压滴液漏斗 磁力搅拌器 玻璃塞 抽滤瓶 烧杯 2 药品
水杨醛(相对分子质量122.12 ,密度1.17g/cm³0) 乙二胺(相对分子质量 60.10,密度 (0.90g/cm³0) 无水乙醇 硫酸铜
三 实验步骤
1 希夫碱配体(L )的合成步骤
移取10.4ml (0.1mol )的水杨醛与25 ml 的无水乙醇溶于三口瓶中,再量取3.6ml (0.05mol )的乙二胺与15ml 的无水乙醇于烧杯中搅拌溶解。
将三口瓶固定在搅拌器上,开启仪器,将乙二胺的无水乙醇溶液逐滴滴加到三口瓶中,恒温55℃反应1小时。
反应结束。
抽滤得黄色的固体,干燥称重并计算产率。
反应装置图如下:
乙二胺的无水乙醇溶液
2 配体L与硫酸镍的反应步骤
称取2.5g(0.01mol)的配体L,与20 ml的无水乙醇混合溶解于三口瓶中,在称取2.5g(0.01mol)的硫酸铜溶解于10 ml的水中,将三口瓶固定在搅拌器上,设定温度为55℃。
,开启仪器,将硫酸铜溶液逐滴滴加到三口瓶中,反应1小时。
反应结束后抽滤并用乙醇水溶液洗涤,得墨绿色固体,干燥称重并计算产率。