
A
①
F A
B
C
③
G 电解
②
D ④
E
F
B 溶液 高三化学(无机推断题)精选汇编
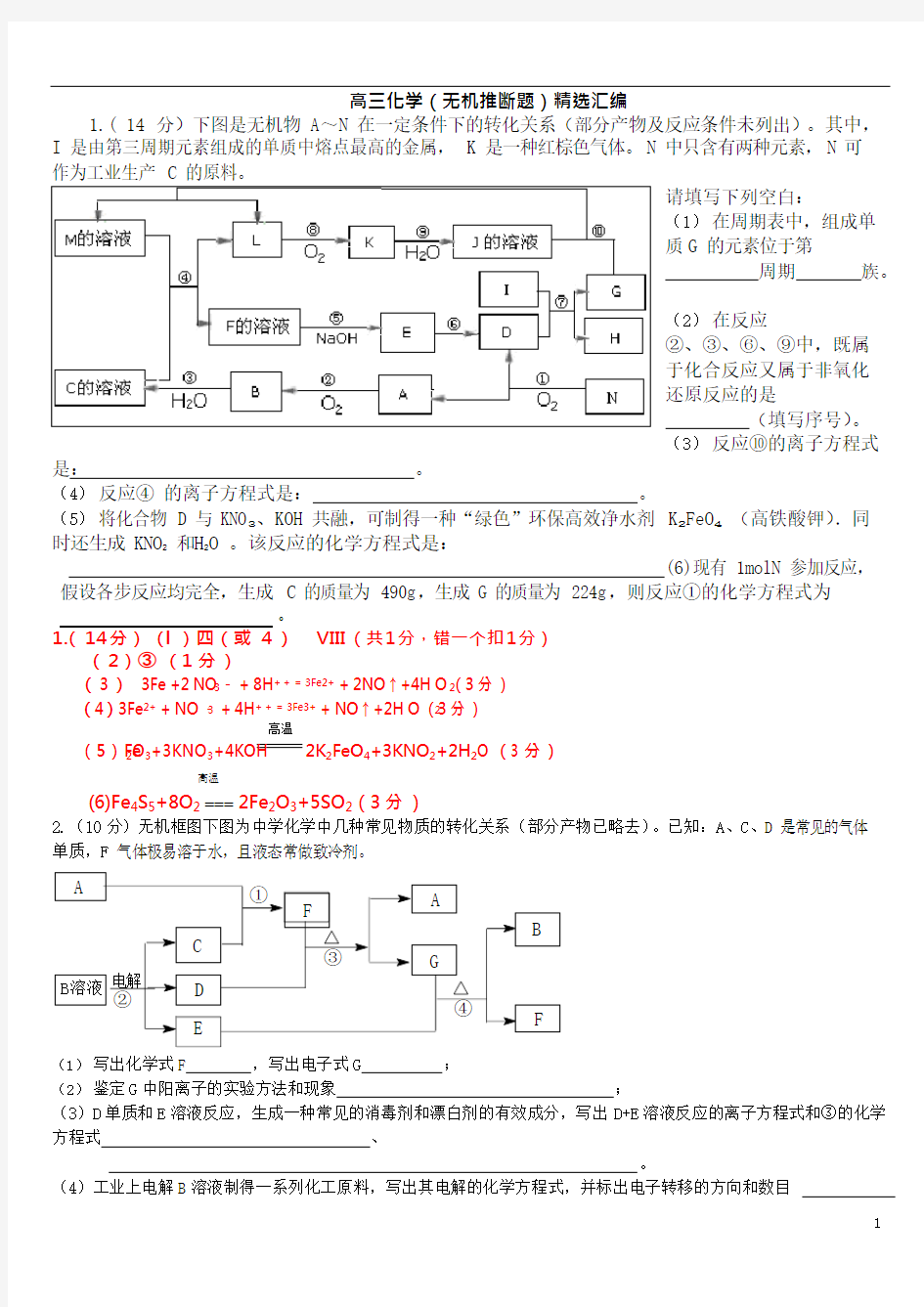
1.( 14 分)下图是无机物 A ~N 在一定条件下的转化关系(部分产物及反应条件未列出)。其中, I 是由第三周期元素组成的单质中熔点最高的金属,K 是一种红棕色气体。N 中只含有两种元素,N 可作为工业生产 C 的原料。
请填写下列空白: (1) 在周期表中,组成单质 G 的元素位于第 周期 族。
(2) 在反应
②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是 (填写序号)。 (3) 反应⑩的离子方程式
是:
。
(4) 反应④ 的离子方程式是: 。
(5) 将化合物 D 与 KNO 3、KOH 共融,可制得一种“绿色”环保高效净水剂 K 2FeO 4 (高铁酸钾).同时还生成 KNO 2 和H 2O 。该反应的化学方程式是:
(6)现有 1molN 参加反应, 假设各步反应均完全,生成 C 的质量为 490g ,生成 G 的质量为 224g ,则反应①的化学方程式为
。 1.( 14 分) ( l )四(或 4 ) VIII (共1 分,错一个扣1 分)
( 2 )③ (1 分 )
( 3 ) 3Fe +2 NO 3- + 8H + + = 3Fe2+ + 2NO ↑+4H O 2(3 分 )
( 4 ) 3Fe 2+ + NO -3 + 4H + + = 3Fe3+ + NO ↑+2H O (23 分 )
高温
( 5 ) Fe 2O 3+3KNO 3+4KOH
2K 2FeO 4+3KNO 2+2H 2O (3 分 )
高温
(6)Fe 4S 5+8O 2 2Fe 2O 3+5SO 2(3 分 )
2.(10 分)无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A 、C 、D 是常见的气体单质,F 气体极易溶于水,且液态常做致冷剂。
(1) 写出化学式 F ,写出电子式 G ;
(2) 鉴定 G 中阳离子的实验方法和现象
;
(3)D 单质和 E 溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出 D+E 溶液反应的离子方程式和③的化学方程式
、
。
(4)工业上电解 B 溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数目
。
2.答案:(10 分)(1)NH 3、 ; (共 2 分) (2)取少量 G 的溶液加人试管中,用胶头滴管加入少量 NaOH 浓溶液,加热 用湿润的红色石蕊试纸在试管口检
验放出的气体,试纸变蓝色(2 分)
△
(3)2OH -+Cl 2=ClO -+Cl -
+H 2O (2 分) 8NH 3+3Cl 2
N 2+6NH 4Cl (2 分)
(4)
(2 分)
3.(本题 10 分)A -H 及X 均为中学化学常见物质, X 是一种金属单质,A 、B 是非金属单质且 A 在常温下为气体。它们在一定条件下有如下转化关系(图中条件均已略去)。
NaClO 溶液
试回答下列问题:
(1) 写出 C 物质的化学式
;
(2) 在上述①-⑤反应中肯定不属于氧化还原反应的是 (填编号); (3) 指出元素 X 在元素周期表中的位置:第 周期,第
族;
(4) 请写出反应④和⑤的离子方程式: ④
,
⑤
;
(5) 用离子方程式表示在 D 溶液中加入 NaClO 溶液产生红褐色沉淀的原因:
。
3.(10 分)(1)FeCl 3 (2 分) (2)④
(2 分)(3)4、Ⅷ (2 分)
(4)FeS +2H +
=Fe 2+
+H 2S↑ (2 分) H 2S +Cl 2=S↓+2H +
+2Cl -
(2 分) (5)2Fe 2+
+ClO -
+4OH -
+H 2O =2Fe(OH)3↓+Cl -
(2 分)
(或 6Fe 2+
+3ClO -
+3H 2O =2Fe(OH)3↓+4Fe 3+
+3Cl -
)
4.(15 分)物质的转化关系如下图所示(有的反应可能在水溶液中进行)。其中 A 为化合物,甲可由两种单质直接化
合得到,乙为金属单质,G 为酸,乙在 G 的浓溶液中发生钝化。
(1) 若 A 为硫酸工业的重要原料,C 能使品红试液褪色,D 的水溶液中加入 HNO 3 酸化的 AgNO 3 溶液有白色沉淀生
成。则
①
③
B
E
X
C
A X ② F ④
G D
A ⑤
F
B
H (红褐色沉淀)+……
①(4 分)工业上反应II 在中进行(填设备名称),工业上反应III 用于吸收E 的试剂是
。
②(2 分)D 的水溶液呈性(填“酸”、“碱”或“中”)
③(2 分)反应I 的化学方程式是。
(2)若甲为淡黄色固体,D、F 的溶液均呈碱性,用两根玻璃棒分别蘸取 A、G 的浓溶液,并使它们接近,有大量白烟生成。则
①(2 分)甲的电子式是。
②(2 分)写出B 和甲反应的化学方程式是。
③(3 分)若17gA 与O2反应生成气态的B 和C 时放出226.7kJ 热量,写出该反应的热化学方程式:
。
4.(15 分)
(1)①接触室:98.3%的硫酸(或浓硫酸)②酸
高温
③4FeS2+11O2 ==== 2Fe2O3+8SO2
(2)① ②2Na2O2+2H2O = 4NaOH+O2↑
③4NH3(g)+5O2(g) = 4NO(g) +6H2O(g);△H=-906.8kJ·mol-1(其它合理答案均给分)
5.(8 分)如下图的转化关系中,已知 A 是由短周期元素组成的盐,H 与Na
2O
2
可发生化合反应,生成的
盐与 Ba2+反应可生成不溶于稀 G 的白色沉淀,一个 D 分子中含有 10 个电子。
试回答下列问题;
(1)写出D(少量)、H、X 反应生成A 的化学方程式:;
(2)写出D 与K 反应生成的正盐溶液中的离子浓度大小关系:;
(3)一定温度下,有可逆反应:aD(g)+bY(g) cE(g)+dX(g)。在2L 密闭容器中,充入4mol D 和
5mol Y,有催化剂存在下,2min 后反应达到平衡,测得平衡时容器内的压强比反应前增加了1
18 。则前2min 内用E 表示的平均反应速率为mol·L-1 ·min-1 ,平衡时D 的浓度为
mol·L-1 。
(4)已知:2H(g)+Y(g) 2I(g);△H=-196.6kJ·mol-1 。当加入4mol H 和2mol Y 后,放出345
kJ 的热时,H 的转化率最接近于(填字母)。
D 无水晶体 A 、40% B 、50% C 、80% D 、90%
5.、(8 分)(1)NH 3+SO 2+H 2O == NH 4HSO 3 (2 分)
+
2-
(2)C(NH
4 )>C(SO 4 )>C(H +)>C(OH -)(2 分) (3)0.
5 1 (2 分) (4)D (2 分 )
6.(10 分)下图是无机物 A ~M 在一定条件下的转化关系(部分产物及反应条件未列出)。其中,A 是具有刺激性气味
的气体,I 是由地壳中含量最高的金属元素形成的单质,K 是一种红棕色气体,D 是一种红棕色粉末,常用作红色油漆和涂料。
请填写下列空白:
⑴在周期表中,组成单质 G 的元素位于第 周期 族。 ⑵在反应⑨中还原剂与氧化剂的物质的量之比为 。 ⑶在反应②、③、⑥、⑧中,既属于化合反应又属于氧化还原反应的是 (填写序号)。
⑷反应④的离子方程式是: 。 ⑸将化合物 D 与 KNO 3、KOH 共融,可制得一种“绿色”环保高效净水剂 K 2FeO 4 (高铁酸钾),同时还生成 KNO 2 和
H 2O 。该反应的化学方程式是:
6.⑴四 Ⅷ ⑵2:1 ⑶②⑧
⑷3Fe
2+
+ N 3
O - + 4H + = 3Fe 3+
+ NO ↑2 + 2H O
⑸Fe 2O 3 + 3KNO 3 + 4KOH = 2K 2FeO 4 + 3KNO 2 + 2H 2O
7.(10 分)已知A 为常见金属,X 、Y 为常见非金属,X 、E 、F 、G 常温下为气体,C 为液体,B 是一种盐,受热极易分 解,在工农业生产中用途较广(如被用作某些电池的电解质)。现用 A 与石墨作电极,B 的浓溶液作电解质,构成原电池。有关物质之间的转化关系如下图:
(注意:其中有些反应的条件及部分生成物被略去)
A
原电池反应①
Y
+氧气⑥
X
C
④ +Y 高温⑦
A
电解
操作
⑤ 熔融
G
△
③
请填写下列空白:
+氧气 E
②
+氧气
+C
F
G
H
浓溶液
(1) 反应④为A 在某种气体中燃烧,生成单质Y 和A 的氧化物,其反应方程式为
。 (2) 从D 溶液制备D 的无水晶体的“操作 a”为 。 (3) 反应②的化学方程式为 。 (4) 反应⑤的化学方程式为
。
氯气
B 溶液
D 溶液
A B E
X
¢? J
×?á?Ba(NO 3)2è
üòo 1y??
F
????
¢ü
???? ¢ú
G
H ¢Y I
¢T
éè±?¢? °×é?3áμí N
K L M
H+I
éè±?¢ò
D
O 3 2
???1
¢?
C
D
(5) 原电池反应①中正极的电极反应式为
7.(1)2Mg+CO 2===2MgO+C; (2 分) (2)将 D 溶液在 HCl 气流中蒸干;(2 分)
(3)②4NH 3+5O 2
4NO+6H 2O; (2 分 )
(4)⑤C+4HNO 3(浓)
CO 2↑+4NO 2↑+2H 2O (2 分)
(5)2NH 4 ++2e - = 2NH ↑+H ↑ (2 分) 8.下图表示各物质之间的转化关系。已知 A 、D 、F 、H 均为单质,X 常温下为无色液体,B 为淡黄色固体,J 溶于酸得
到黄色溶液。
请按要求填空:
⑴写出 B 的电子式: 。
⑵反应⑤的现象是
。
⑶反应①的化学反应方程式是 , 在实验室引发反应④的操作是 。 ⑷反应⑥的离子方程式是 。
8. ⑴Na +
[
]2-
Na +
⑵白色物质迅速变为灰绿色,最终变为红褐色
?? ??
⑶3Fe+4H 2O
Fe 3O 4+4H 2↑
在铝热剂上加少量 KClO 3,插上镁条并将其点燃
⑷2A l +2OH -
+2H 2O =2Al 2O -
+32H
↑ 9、(10 分)物质之间的转化关系如下图所示,A 可作为工业生产 J 的原料,B 、C 、H 、I 为非金属单质,X 的水溶液为
一种常见的医用消毒液,F 为常见的红棕色防锈油漆颜料的主要成分,O 是常见氮肥,且反应⑦中 L 与M 的物质的量之比为 1:2,A 、E 、J 、N 中含有同一种元素。
???? ¢ù
回答下列问题: ⑴X 的化学式为
,O 的结构简式为 ,其中属于置换反应的是 (填序号)。
⑵考虑到综合经济效益,工业生产 M 时,可采取的措施有
(填序号)。
⑶写出反应⑦的化学方程式
。
a .使用催化剂
b .适当降低温度
c .选择合适的温度
d .适度增大压强
e .及时分离出产物
f .对原料进行循环利用
g .充分利用反应本身放出的热量
h .工厂地址尽可能选择在交通发达的城市
i .工厂地址可选择在盛产天然气的地区
设备Ⅰ的名称 。工业生产中为了节约资源、降低成本和保护环境,常常对某些物质进行循环利用。上述转化关系中能达到该目的的是 (填序号)。
⑶现有 1molA 参加反应,假设各步反应均完全,生成 N 的质量为 1165g ,生成 K 的质量为 224g ,则反应①的化学方程式为
。
9. ⑴H 2O 2
②
⑵acdefgi 合成塔 ⑥
高温
高压
⑶Fe 4S 5+8O 2 === 2Fe 2O 3+5SO 2 ⑶CO 2+2NH 3 === CO(NH 2)2+H 2O
10. 下图为中学化学常见物质间的转化关系。其中 B、F 为无色气体, E 为黑色固体,I 为红色沉淀, J、K、B 为单质,J、B 的组成元素在周期表中位于同一主族,L 与M 的摩尔质量相同,M、N 的焰色反应黄色。
根据以上转化回答下列问题:
(1)转化关系图中条件1 是,有机物1 必须具有的官能团的名称是I 的名称是
(2)C 与D 的浓溶液反应的化学方程式是
(3)写出N 的溶液与过量的F 反应的离子方程式
(4)F 到H 的反应是放热反应,工业生产中完成这一转化的条件是
常压,400℃~500℃,催化剂,选用这一条件的理由是
在此条件下,若要提高F 的转化率,你认为还可采用的措施是
参考答案:
10、(1)用惰性电极通电电解;醛基;氧化亚铜
(2)Cu+2H2SO4(浓)=CuSO4+2H2O+SO2
(3)OH-+SO2=SH3O-
(4)略
11.(8 分)已知 X、Y、Z 为三种由短周期元素构成的粒子,每 mol 粒子都有 10mol 电子,其结构特点如下:
物质 A 由X、Z 构成,B、C、D、K 都是单质,反应①~⑤都是用于工业生产的反应,各有关物质之间的相互反应
转化关系如下图所示:
M
⑧+E↑
⑤+D
高温高压催化剂②冰晶石1000℃熔融电解
③+水
B C
高温
⑥+水
高温、催化剂① 1400~1800℃
R
④+N aOH 溶液
加热
Y 溶液
D↑E↑
A↑
O2↑
G↑
E↑
D↑
J↑
请回答下列问题:
(1)A 的化学式为;D 的结构式为。
(2)完成下列反应的离子方程式:
反应①。
反应④。
(3)若J 气体浓度过高可导致高铁血红蛋白血症,且污染大气等。但J 也有不少的用途,如
(举出一例)
11.(共 8 分)
(1)A: NaOH (1 分) D: N ≡ N (1 分)
(2) 反应①: Cl2 + 2OH-== Cl-+ ClO-+ H2O(2 分)
通电
反应④:2Cl-+2 H2O == 2OH-+ Cl2↑ + H2↑(2 分)
(3)作为一种信使参与炎症反应、信号传递、血管调节及免疫调节等(只要答案合理均可得分)。(2 分)
12.(10 分)下图涉及多种无机化工反应,其中 R 是一种新型无机材料,M 是一种应用广泛的金属材料,F 是人工合成的第一种有机物,且是一种常见的化学肥料,A、C、D、M 均为常见元素的单质,“↑”表示该物质常温下是气体,反应G+J→F+H2O 中G 与J 的最佳配比为2∶1,向 Y 溶液中通入足量的 J 气体时可得到一种白色胶状沉淀,将该白色胶状沉淀滤出洗净后加热分解可以得到 B。
⑴试写出下列指定物质的化学式:B,F。
F 水
⑦
适宜
条件J↑
G↑
A B E
X
¢? J
×?á?Ba(NO 3)2è
üòo 1y??
????
¢ü
????
¢ú
¢T
H+I
°×é?3áμí N
F G
H M
O
D
2
2 2 2
éè±?¢? ¢Y
éè±?¢ò
???1 ¢?
C
D
⑵反应①的化学方程式为 。 ⑶反应④的离子方程式为
。
⑷上述反应中属于非氧化还原反应的有 (填写相应反应的序号)。
12.⑴Al 2O 3(2 分)
CO(NH 2)2(2 分)
⑵N +Al O +3
1400~1800℃
3CO +2AlN(2 分)
2
2 3
C
⑶AlN+OH -
+H 2O =AlO - +NH 3↑(2 分) ⑷④⑦(2 分,少一个正确答案扣 1 分、错选一个倒扣一分扣完为止)
13.物质之间的转化关系如下图所示,A (只含两种元素)可作为工业生产 J 的原料,B 、C 、H 、I 为非金属单质, X 的水溶液为一种常见的无色医用消毒液,F 为常见的红棕色防锈油漆颜料的主要成分,O 是常见氮肥,且反应⑦中 L 与M 的物质的量之比为 1∶2,A 、E 、J 、N 中含有同一种元素。
????
¢ù
回答下列问题: ⑴X 的化学式为
,C+D 的反应方程式为 _
⑵考虑到综合经济效益,工业生产 M 时,可采取的措施有
(填字母序号)。
a .使用催化剂
b .适当降低温度
c .选择合适的温度
d .适度增大压强
e .及时分离出产物
f .对原料进行循环利用
g .充分利用反应本身放出的热量
h .工厂地址尽可能选择在交通发达的城市
i .工厂地址可选择在盛产天然气的地区; 设备Ⅰ的名称是
。工业生产中为了节约资源、降低成本和保护环境,
常对某些物质进行循环利用。上述转化关系中能达到该目的的是 (填数字序号)。
⑶写出反应⑦的化学方程式
。
⑷现有 1molA 参加反应,假设各步反应均完全,生成 N 的质量为 1165g ,生成 K 的质量为 224g ,则反应①的化学方程式为
。
13.(12 分)
高温
(1)H O (2 分),C+H O = CO+H 2 (2 分); (2)acdefgi (2 分), 合成塔 (1 分), ⑥ (1 分);
高压
(3)CO 2+2NH 3 === CO(NH 2)2+H 2O (2 分)
; 高温
I K
L
(4)Fe4S5+8O2 2Fe2O3+5SO2(2 分)。
X
E
M
MSO 4
E
14.(宁夏卷)
某厂的酸性工业废水中含有一定量的 Fe 3+
、Cu 2+
、Au 3+
等离子。有人设计了图中的工艺流程,利用常用的酸、碱和工业生产中的废铁屑,从废水中回收金,并生产一定量的铁红和氧化铜。
填写下面空白。
(1)图中标号处需加入的相应物质分别是①
、② 、③ 、④ 、⑤
。
(2)写出①处发生反应的离子方程式
。写出③处发生反应的化学方
程式 。
(3)铁红的化学式为
;分别写出铁红和氧化铜在工业上的一种主要用途:铁红
;氧化铜
。
答案:(1)①铁屑;②稀硫酸;③稀硝酸;④氢氧化钠;⑤氢氧化钠。
(2)Fe+2H +
=Fe 2+
+H 2↑;2Fe 3+
+Fe =3Fe 2+
。 Cu 2+
+Fe =Cu+Fe 2+
;2Au 3+
+3Fe =2Au+3Fe 2+
。 3Cu+8HNO 3(稀)=3Cu(NO 3)2+2NO↑+4H 2O
(3)Fe 2O 3;用作红色涂料;用作制造铜盐的原料。15.(江苏卷)根据下列框图回答问题(答题时,方程式中的 M 、E 用所对应的元素符号表示):
oì é??eê? H 2SO 4
H 2O 2
à?é?èüòo
?eê?
H 2SO 4 H 2O 2
KOH KOH Cl 2
KSCN
oì é?èüòo
⑴写出 M 溶于稀 H 2SO 4 和 H 2O 2 混合液的化学方程式: 。
⑵某同学取 X 的溶液,酸化后加入 KI 、淀粉溶液,变为蓝色。写出与上述变化过程相关的离子方程式:
、 。
⑶写出 Cl 2 将 Z 氧化为 K 2EO 4 的化学方程式:
。
⑷由 E 制备的 E(C 2H 5)2 的结构如右图,其中氢原子的化学环境完全相同。但早 期人们却错误地认
磁共振氢谱中,正
确为的它结构有为:
种峰E ,错误的结构有 种峰。 答案: ⑴Cu + H O + H SO == CuSO +。2核H 磁O 共振法能够区分这两种结构。在核
2 2
2
4
4
2
⑵4Fe 2+ + O 2 + 4H + == 4Fe 3+ + 2H 2O 2Fe 3+ + 2I — == 2Fe 2+
+ I 2
⑶10KOH + 3Cl 2 + 2Fe(OH)3 == 2K 2FeO 4 + 6KCl + 8H 2O ⑷1 3
16.(海南卷)下图表示某固态单质 A 及其化合物之间的转化关系(某些产物和反应条件已略去)。化合物 B 在常温常压下为气体,B 和C 的相对分子质量之比为 4:5,化合物 D 是重要的工业原料。 (1) 写出 A 在加热条件下与 H 2 反应的化学方程式
(2) 写出 E 与 A 的氢化物反应生成 A 的化学方程式
K 2EO 4
M
Y
Z
(3)写出一个由D 生成B 的化学方程式;
(4)将5mL0.10mol·L-1
的E 溶液与10mL0.10 mol·L-1的NaOH 溶液混合。
①写出反应的离子方程式;
②反应后溶液的pH 7(填“大于”、“小于”或“等于”),理由是;
③加热反应后的溶液,其pH (填“增大”、“不变”或“减小”),理由是
。
解析:固态单质 A 能与空气中的氧气反应生成气体物质 B,则 A 可能为 C 或S 等,假定为 S,则 B 为SO2,C 为SO3,它们的相对分子质量为64∶80=4∶5,恰好与题意相符(同时也证明 A 不是C),则D 为H2SO4,它是一种重要的工业原料,与题意也相符,进一步证明 A 为S。E 为H2SO3。
△
答案:(1)H2+S H2S(写成可逆反应也正确)。
(2)H2SO3 + 2H2S=3S + 3H2O。
△△
(3)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O 或Cu+ 2H2SO4(浓)CuSO4 +SO2↑+ 2H2O 等。
(4)①H SO+2OH— = SO 2— + 2H O。
2 3 3 2
②大于;Na2SO3溶液中 S3O 2-发生水解使溶液显碱性。
③增大;升高温度促进 Na2SO3溶液的水解。
17.(全国Ⅰ卷)V、W、X、Y、Z 是由周期表中 1~20 号部分元素组成的 5 种化合物,其中 V、W、X、Z 均为两种元素
组成,上述 5 种化合物涉及的所有元素的原子序数之和等于 35。它们之间的反应关系如下图:
(1)5 种化合物分别是V 、W 、X 、Y 、Z 。(填化学式)
(2)由上述5 种化合物中2 种化合物反应可生成一种新化合物,它包含了5 种化合物中的所有元素,生成该化合物的化学方程式是。
(3)V 的电子式是。
解析:此题的关键V 由两种元素组成,且V+H2O Y(白色固体)+Z(无色气体),在中学阶段常见的有Na2O2、Mg3N2、CaC2,很明显 Na2O2不满足 V+O2W(白色固体)+X(无色气体),若为 Mg3N2,则 Y 为Mg(OH) 2,Z 为 NH3,X 可能为 NO,W 为 MgO,所有的原子序数的总和为 28,与题意不符;若为 CaC2,则 Y 为 Ca(OH) 2,根据 Y 逆推W 为CaO,Z 为C2H2,X 为CO2,其中 C、H、O、Ca 的原子序数的总和为 36,与题意符合。
答案:(1)CaC2;CaO;CO2;Ca(OH)2;C2H2。
(2)Ca(OH)2+2CO2===Ca(HCO3)2。
(3) Ca2+ C2-。
⑶10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4 + 6KCl + 8H2O
⑷13
18.(北京卷)通常状况下,X、Y 和Z 是三种气态单质。X 的组成元素是第三周期原子半径最小的元素(稀有气体元素除
外);Y 和Z 均由元素 R 组成,反应 Y+2I-+2H+===I2+Z+H2O 藏作为 Y 的鉴定反应。
(1)Y 与Z 的关系是(选填字母)。
a、同位素
b、同系物
c、同素异形体
d、同分异构体
(2)将Y 和二氧化硫分别通入品红溶液,都能使品红褪色。简述用褪色的溶液区别二者的实验方法
C
(3)举出实例说明 X 的氧化性比硫单质的氧化性强(用化学方程式表示)。
。
(4)气体(CN)2与X 化学性质相似,也能与 H2反应生成HCN(其水溶液是一种酸)。
①HCN分子中含有4 个共价键,其结构式是。
②KCN溶液显碱性,原因是(用离子方程式表示)。
(5)加热条件下,足量的Z 与某金属M 的盐MCR3(C 为碳元素)完全反应生成CR2和MmRn(m、n 均为正整数)。若CR2
质量为w1g,MmRn 质量为w2g,M 的相对原子质量为a,则M m R n中m∶n=(用含w1、w2、和
a 的代数式表示)。
【解析】X 的组成元素是第三周期原子半径最小的元素,为:Cl2,根据反应式:Y+2I-+2H+=I2+Z+H2O,可知Y 中必含有“O”,其为气体单质,只能是 O3,故 Z 是O2,据此可知 Y 和Z 是同素异形体;O3的漂白是利用其强氧化性,是不可逆的,而 SO2的漂白具有可逆性,受热能恢复原色,故可以加热区分;证明 Cl2比S 的氧化性强,可以从其单质的置换,氧化变价金属呈现的价态不同等多方面体现;HCN 的结构简式为:,KCN 溶液呈碱性,是由于其中的CN-水解和MmRn,根据原子守恒,可知 R 为O,据此反应式可写为:
的缘故;足量的 Z 与盐完全反应生成CR
2
1
O2+MCO3= CO2+m M m R n
w1w2
44 1/m(am+16n),列比例式整理得:m:n=
【答案】
1.9.(北京卷)由Fe2O3、Fe、CuO、C、Al 中的几种物质组成的混合粉末,取样进行下列实验(部分产物略去):
(1)取少量溶液X,加入过量的NaOH 溶液,有沉淀生成。取上层清液,通入CO2,无明显变化,说明样品中不含有
的物质是(填化学式) 。
(2)Z 为一种或两种气体:
①若 Z 只为一种气体,试剂 a 为饱和 NaHCO3溶液,则反应Ⅰ中能同时生成两种气体的化学方程式是
。
②若Z 为两种气体的混合物,试剂a 为适量的水,则Z 中两种气体的化学式是。
(3)向Y 中通入过量的Cl2,并不断搅拌,充分反应后,溶液中的阳离子是(填写离子符号)。(4)取
Y 中的溶液,调节pH 约为7,加入淀粉KI 和H2O2,溶液呈蓝色并有红褐色沉淀生成。当消耗2molI-时,共转移3mol 电子,该反应的离子方程式是。
(5)另取原样品,加入足量稀硫酸充分反应,若溶液中一定不会产生Y 中的红色固体,则原样品中所有可能存在的
物质组合是(各组合中物质用化学式表示)。
【解析】根据题给物质,包括 Fe2O3,Fe,CuO,C,Al,根据(1)中现象,可知不含 Al,Y 为亚铁盐溶液,固体为
△
Cu 和Fe;Z 为一种气体时,浓酸为硫酸,其:C+2H2SO4(浓) CO2↑+2SO2↑+2H2O,通过碳酸氢钠后,气体只有
2 2 2 2
3 2
6 CO 2, 若是两种气体时,浓酸为硝酸,C +
4HNO 3=CO
2↑+4NO 2↑+2H 2O ,通过水后,气体为 CO 2 和 NO ;向 Y 中通入过量氯气,生成的 FeCl 3 逐渐与铁粉和铜粉反应生成 CuCl 2 和 FeCl 3,溶液阳离子为 Cu 2+
,Fe
3+和 H +;氯化亚铁溶液中加淀粉碘化钾和 H
O 时,其反应为:2Fe 2+
+3H O +4I -
=2Fe(OH) ↓+2I ;原样品中加足量稀硫酸,Y 溶液中不出现红色固体,则原样品中不存在铁和铝,故其可能组合为:CuO 和C 或CuO 、C 和Fe 2O 3。
【答案】
20.(10 分)A 、B 、C 、D 、E 都是短周期元素,原子序数依次增大,B 、C 同周期,C 的非金属性最强,A 、D 同主族隔周期,E 元素原子最外层的 p 亚层电子数是 s 亚层电子数的一半。A 、B 能形成两种液态化合物甲和乙,原子个数比分别为 2∶1 和 1∶1。根据以上信息回答下列问题:
⑴甲、乙两分子中含有非极性共价键的物质的电子式是
,
C 元素在周期表中的位置是
。
⑵C 和 D 的离子中,半径较小的是
(填离子符号)。
⑶将 D 的单质投入甲中,待 D 消失后再向上述溶液中加入 E 的单质,此时发生反应的化学方程式是
⑷C、D 、E 可组成离子化合物,其晶胞(晶胞是在晶体中具有代表性的最小重复单元)结构如下图所示,阳离子
D +
(用○表示)位于正方体的棱的中点和正方体内部;阴离子 EC 6
x -(用●表示)位于该正方体的顶点和面心。该
化合物的化学式是 。
○ :阳离子 D +
● :阴离子 EC x -
晶胞
晶胞的 1
8 (5)如图,铁有 δ、γ、α 三种同素异形体,三种晶体在不同温度下能发生转化。下列说法正确的是(
)
A. γ-Fe 晶体中与每个铁 原子距离相等且最近的铁原子有 6 个
B. α-Fe 晶体中与每个铁原子距离相等且最近的铁原子有 6 个
C. 若 δ-Fe 晶胞边长为 acm ,α-Fe 晶胞边长为 bcm ,则两种晶体密度比为 2b 3
:a 3
D. 将铁加热到 1500℃分别急速冷却和缓慢冷却,得到的晶体类型相同
(10 分)(1)⑴(1 分) 第二周期、第ⅦA族 (2 分)
⑵ Na+ (1 分 )
⑶2Al+2NaOH+2H2O=2NaAlO2+3H2↑(2 分) ⑷ Na3AlF6 (2 分) (5) B C(2 分,选1 个且正确的给1 分,
错选一个该题0 分,)
“”
“”
At the end, Xiao Bian gives you a passage. Minand once said, "people who learn to learn are very happy people.". In every wonderful life, learning is an eternal theme. As a professional clerical and teaching position, I understand the importance of continuous learning, "life is diligent, nothing can be gained", only continuous learning can achieve better self. Only by constantly learning and mastering the latest relevant knowledge, can employees from all walks of life keep up with the pace of enterprise development and innovate to meet the needs of the market. This document is also edited by my studio professionals, there may be errors in the document, if there are errors, please correct, thank you!
2015年浙江化学高考无机化学推断专题复习 2013高考题赏析: 26、(15分)氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将 6.00 g甲加热 至完全分解,只得到一种短周期元素的金属单质和 6.72 LH2(已折算成标准状况)。甲与水反应也能产生H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状态下的密度为 1.25 g/L。请回答下列问题:(1)甲的化学式是_________;乙的电子式是__________。 (2)甲与水反应的化学方程式是__________________________________-。 (3)气体丙与金属镁反应的产物是_______(用化学式表示)。 (4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式 _________ 。 有人提出产物Cu中可能还含有Cu2O,请设计实验方案验证之 _________________________ 。 (已知Cu2O+2H+==Cu+Cu2++H2O) (5)甲与乙之间_______(填“可能”或“不可能)发生反应产生H2,判断理由是________ 。 2014浙江样卷赏析: 26、(15分)汽车安全气囊是行车安全的重要保障。当车辆发生碰撞的瞬间,安全装置通电点火使 其中的粉末分解释放出大量的氮气形成气囊,从而保护司机及乘客免受伤害。为研究安全气囊工作 的化学原理,取安全装置中的粉末进行实验。经组成分析,确定该粉末仅Na、Fe、N、O四种元素。水溶性试验表明,固体粉末部分溶解。经检测,可溶物为化合物甲;不溶物为红棕色固体,可溶于 盐酸。 取13.0g化合物甲,加热使其完全分解,生成氮气和单质乙,生成的氮气折合成标准状况下的体积 为6.72L。单质乙在高温隔绝空气的条件下与不溶物红棕色粉末反应生成化合物丙和另和一种单质。 化合物丙与空气接触可转化为可溶性盐。请回答下列问题: (1)甲的化学式为,丙的电子式为。 (2)若丙在空气中转化为碳酸氢盐,则反应的化学方程式为。 (3)单质乙与红棕色粉末发生反应的化学方程式为,安全气囊中红棕色粉末的作用是。 (4)以下物质中,有可能作为安全气囊中红棕色粉末替代品的是。 A. KCl B. KNO3 C. Na2S D. CuO (5)设计一个实验方案,探究化合物丙与空气接触后生成可溶性盐的成分(不考虑结晶水合 物)。 26题解题思路与命题格式:根据题给物质的性质和应用,以及题中隐含的反应方程式结合定量分析 及守恒,推导出题中各物质。一般问题: (1)分子式、电子式等; (2)基础反应方程式; (3)新情景下的氧化还原反应; (4)物质用途; (5)寻找替代品——物质的结构和性质相似; (6)实验设计——取样、操作、现象、结论; (7)某物质结合电化学知识; (8)某物质结合电离、水解、沉淀平衡知识;(9)其他知识,,
无机推断题复习
?? ? ? ???↑+=++↑+=++↑??→?- 232222222232222H SiO Na O H NaOH Si H NaAlO O H NaOH Al H Si Al OH 、单质 铵盐:O H NH NH 234 +↑?→?+碱 (2)与酸反应产生气体 ①? ??? ?? ???????????????????↑↑??→?↑???→??????↑↑??→?↑↑???→??????↑↑?? →?↑?? ?→?↑??→?22222222223 4 234 23 4 2NO SO SO S CO NO CO SO C NO NO SO H HNO SO H HNO SO H HNO SO H HCl 、、、非金属、金属单质浓浓浓浓浓 ②() () () ???????↑?→?↑?→?↑ ?→?++ + ------2323 222323SO HSO SO S H HS S CO HCO CO H H H 化合物 9.物质组成的特殊配比 能形成原子个数比为2:1或1:1的特殊化合物有:Na 2O 、Na 2O 2类,H 2O 、H 2O 2类,CaC 2、C 2H 4、C 2H 2、C 6H 6类。 10.物质间的一些特殊转化关系 物质间的转化关系是解无机推断题的精髓,除了熟记一般的转化网络如“铝三角”、“铁三角”等外,还要了解一些特殊的转化关系,例如:
电解饱和食盐水2NaCl+2H2O2NaOH+H2↑+Cl2↑ 电解制镁、铝MgCl2Mg+Cl2↑;2Al2O34Al+3O2↑ 工业制玻璃 Na2CO3+SiO2Na2SiO3+CO2↑; CaCO3+SiO2CaSiO3+CO2↑ 工业制硫酸 4FeS2+11O22Fe2O3+8SO2(或S+O2SO2); 2SO2+O22SO3;SO3+H2O H2SO4 工业制粗硅SiO2+2C Si+2CO↑ 一、卤素 二、碳族元素 电解 电解 高温 高温 高温点燃 催化剂 △ 电解 高温 ①Cl2+H2O=HCl+HClO ②Cl2+2NaOH=NaCl+NaClO+H2O ③ 2Cl+2Ca(OH)=CaCl+Ca(ClO)+2H O ①2Fe2++Cl2=2Fe3++2Cl- ②2I-+Cl2=I2+2Cl- ③S2-+Cl2=S↓+2Cl- ④SO2+Cl2+2H2O=H2SO4+2HCl ⑤8NH3+3Cl2=N2+6NH4Cl HCl HClO (强氧化性) H+ Zn OH- NH3 CaCO H2 H2O NH4+ CO2 Cl- Ag+ MnO2 AgCl Cl2 C2H5OH C2H5Cl 取代 CH2=CH Cl 加成 CH AgNO3 Ca(OH)2 光 H+、CO2 电解 Na AgNO3 Cl2 (黄绿色 Ca(ClO)2 氧化性 KMnO4、电解 H2S、HBr、HI 还原性 化合物 金属①2Fe+3Cl2=2FeCl3 ②Cu+Cl2=CuCl2(生成高价) 非金 ①H2+Cl2=2HCl ② 自身 氧化 NaCl AgCl
2019年高考化学无机推断题解题技巧 无机推断题是集元素化合物知识、基本概念和基本理论于一体,且综合性强、考查知识面广、思维容量大、题型多变、能力要求高、推理严密,既能检查学生掌握元素化合物的知识量及熟练程度,又能考查学生的逻辑思维能力,在历年高考中频频出现,且体现出很好的区分度和选拔功能。无机推断题考查内容及命题主要呈现如下趋势: 1.限定范围推断:主要适用于气体或离子的推断,该类题目的主要特点是在一定范围内,根据题目给出的实验现象(或必要的数据)进行分析,作出正确判断。解题关键:①审明题意,明确范围,注意题目所给的限定条件;②紧扣现象,正确判断;③要注意数据对推断结论的影响。 2.不定范围推断:常见元素化合物的推断。该题目的主要特点是:依据元素化合物之间相互转化时所产生的一系列实验现象,进行推理判断,确定有关的物质。题目往往综合性较强,具有一定的难度。从试题形式来看,有叙述型、图表型等。解题关键:见题后先迅速浏览一遍,由模糊的一遍“扫描”,自然地在头脑中产生一个关于该题所涉及知识范围等方面的整体印象,然后从题中找出特殊现象或特殊性质的描述,作为解题的突破口,进而全面分析比较,作出正确判断。
3.给出微粒结构等的微粒(或元素)推断题。解题关键: ①熟记元素符号,直接导出;②掌握几种关系,列式导出;③利用排布规律,逐层导出;④弄清带电原因,分析导出;⑤抓住元素特征,综合导出;⑥根据量的关系,计算导出。 4.给出混合物可能组成的框图型(或叙述型)推断题。解题关键:解框图型(或叙述型)推断题一般是根据物质的转化关系,从其中一种来推知另一种(顺推或逆推),或找出现象明显、易于推断的一种物质,然后左右展开;有时需试探求解,最后验证。 5.给出物质间转化关系的代码型推断题。解题关键:此类推断题的特点是用代号表示各物质的转化关系,要求“破译”出各物质的分子式或名称等,看起来较复杂,其实在解题时,只要挖掘题眼,顺藤摸瓜,便可一举攻克。 6.给出物质范围的表格型推断题。解题关键:列表分析,对号入座;直观明快,谨防漏解。
2020-2021北京高考化学高无机综合推断综合题 一、无机综合推断 1.已知A为金属单质,它们之间能发生如下反应(部分产物未标出) 请根据以上信息回答下列问题: (1)写出物质B的化学式:___________ (2)写出下列反应的化学方程式: 反应①______________________________________________________________________ 反应②______________________________________________________________________(3)写出下列反应的离子方程式: 反应C→D______________________________________________________________________ 反应D→C _____________________________________________________________________(4)检验D中阳离子的方法: _________________________________________________________ 【答案】Fe3O4 4Fe(OH)2+O2+2H2O===4Fe(OH)3 3Fe + 4H2O(g) Fe3O4 + 4H2 2Fe2++ Cl2 =2Fe3++2Cl-2Fe3++Fe=3Fe2+取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。 【解析】 红褐色固体固体出现,为氢氧化铁,说明金属单质A为铁,铁与盐酸反应生成氯化亚铁(C)和氢气(F),氯化亚铁被氯气氧化为氯化铁(D),氯化铁又被铁还原为氯化亚铁,氯化亚铁与氢氧化钠溶液反应生成白色沉淀氢氧化亚铁(E),接着被氧气氧化为红褐色固体氢氧化铁,铁与水蒸气加热条件下反应生成四氧化三铁(B)和氢气(F); (1)B为四氧化三铁,正确答案为 Fe3O4 。 (2)正确答案:① 4Fe(OH)2+O2+2H2O===4Fe(OH)3;② 3Fe + 4H2O(g) Fe3O4 + 4H2。(3)氯化亚铁被氯气氧化为氯化铁:2Fe2++ Cl2 =2Fe3++2Cl-;氯化铁又被铁还原为氯化亚铁:2Fe3++Fe=3Fe2+;正确答案:2Fe2++ Cl2 =2Fe3++2Cl-;2Fe3++Fe=3Fe2+。 (4) Fe3+检验方法:①加入氢氧化钠溶液,生成红褐色沉淀;②加入硫氰化钾溶液,出现红色溶液,该方法简单易操作;正确答案:取少量D溶液于试管中,滴加少量KSCN溶液,若溶液变红,证明D中含有Fe3+。 点睛:推断题要抓住题眼:红褐色固体为氢氧化铁,从而推出金属单质铁。
新高考化学27题——无机推断题 例1:浙江2015年9月份化学选考卷27题 某固体粉末中可能含有SiO2、Na2O、Ca0、Cu0、Fe2 03,某同学设计并完成如下实验: 请回答: (1)步骤②中生成蓝色沉淀的离子方程式为。 (2)步骤⑤中生成的白色沉淀是(填化学式)。 (3)根据实验现象,固体粉末中一定存在的组分是(填化学式)。 例2:浙江2015年10月份化学选考卷27题 某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。 请回答: (1)沉淀a中含有的单质是。 (2)沉淀c的化学式是。 (3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是。 例3:浙江2016年4月份化学选考卷27题 下图中,固体A是铁锈的主要成分。 请回答: (1) 白色沉淀E的化学式________。 (2) 写出A---B的化学方程式____ ____。 (3) 写出C---D在溶液中发生氧化还原反应的离子方程式____ ____。 例4:浙江2016年10月份化学选考卷27题 为探究不溶性盐X(仅含四种元素)的组成和性质,设计并完成如下实验: 请回答: (1) X的组成元素为H、O和_______(用元素符号表示),化学式为__________。 (2) 写出经一步反应能得到X的化学方程式(要求非氧化还原反应)_________________。 练习1、(2017温州高二十校期末联考) 有一种埋在地下的矿物X(仅含四种元素),挖出后在空气中容易发黄,现探究其组成和性质,设计完成如下实验: 请回答: (1)X的化学式_____________,挖出后在空气中容易发黄的原因___________________________。 (2)写出溶液分二等份,加KSCN无明显现象后,滴加双氧水的两个离子方程式:_____________________________,_________________________。 练习2、(2017湖州高三期末) 为探究无机盐X(仅含三种元素,摩尔质量为238g·mol-1,原子个数比为1:1:4)的组成和性质,设计并完成了如下实验:将11.9gX与水共热,生成一种气体单质和某强酸的酸式盐溶液A。A的焰色
第二轮复习无机推断题专题讲座 [命题趋向] 推理能力是高考测试的五项能力之一。《考试大纲》中对推理能力是这样界定的:“通常根据已知的知识和题目给定的事实和条件,抽象、归纳相关信息,对自然科学问题进行逻辑推理和论证,得出正确的结论或做出正确的判断,并能把推理过程正确地表达出来”。 无机物质推断题既可以综合考查元素化合物方面的基础知识、还可联系到化学基础理论、化学基本计算、化学实验现象等等,另外无机物质推断题可以较好地测试推断能力,所以近几年的高考试题中,无机物质推断题成了每年高考中考查推理能力的保留题型。分析今高考中物质推断题,主要可分成以下三类:选择型推断题、文字叙述型推断题、框图型推断题。 从推理能力考查的特点分析,高考无机推断题中主要表现了以下几个特点: ①单信息、多信息并重。同一道推断题中,有的结论只要分析单个信息就可以得出,有的结论需要同时综合多条信息才能得出。 ②正向、逆向、统摄三种形式的推理并重。有些结论的得出过程中,需要正向、逆向、统摄等三种推理形式。 ③定性、定量分析并重。推断过程中既需要定性分析、又需要定量分析。 ④计算和逻辑推理(讨论)并重。 [知识体系和复习重点] 《考试大纲》中对元素化合物知识的综合要求较高,具体要求如下: ①了解在生活和生产中常见无机化合物的性质和用途。 ②能够运用无机化合物各部分知识进行综合推断,解决有关的综合问题。 ③能够综合运用无机化合物、有机化合物知识进行综合分析,解决有关的综合问题。[知识指津] 无机物的相互反应(见下图所示) (1)无机物间能否反应,主要决定于反应物的性质及反应时的客观条件。左边所示的无机物间的相互反应指其主要性质而言,至于各个具体物质间能否反应,还有一些具
2020-2021备战高考化学《高无机综合推断的综合》专项训练附答案 一、无机综合推断 1.下列各物质中只有A、B、C三种单质,A的焰色反应为黄色,主要以G形式存在于海水中,F是一种淡黄色的固体,H是一种常见的无色液体,I是造成温室效应的“元凶”,各物质间的转化关系图如下: 回答下列问题: (1)A是:_____,C是:_____,L是:______,I是:____(填化学式)。 (2)写出反应①②③的化学反应方程式: ①:____________________________________; ②:____________________________________; ③:____________________________________; 【答案】Na Cl2HCl CO22Na+2H2O=2NaOH+H2↑2Na2O2+2H2O=4NaOH+O2↑ 2NaHCO3Na2CO3+CO2↑+H2O 【解析】 【分析】 焰色反应为黄色的单质是钠,钠元素在自然界主要以氯化钠的形式存在,淡黄色固体是过氧化钠,常见的无色液体是水,造成温室效应的“元凶”是二氧化碳。因此,A是钠,B是氧气,C是氯气,D是氢氧化钠,E是氧化钠,F是过氧化钠,G是氯化钠,H是水,I是二氧化碳,J是碳酸氢钠,K是碳酸钠,L是盐酸。 【详解】 (1)A是钠,化学式为Na,C是氯气,化学式为Cl2,L是氯化氢,化学式为HCl,I是二氧化碳,化学式为CO2; (2)①是钠与水的反应,化学方程式为:2Na+2H2O=2NaOH+H2↑; ②是过氧化钠与水的反应,化学方程式为:2Na2O2+2H2O=4NaOH+O2↑; ③是碳酸氢钠的受热分解,化学方程式为:2NaHCO3Na2CO3+CO2↑+H2O; 【点睛】 无机框图推断题要找出题眼,关键点,熟记特殊物质的颜色,特殊的反应,工业生产等等,找出突破口,一一突破。 2.已知A、B、C、D是元素周期表中的四种短周期元素,A分别与B、C、D结合生成三种
高考化学高无机综合推断综合题及答案解析 一、无机综合推断 1.由三种元素组成的化合物A ,按如下流程进行实验。气体B 为纯净物,溶液C 焰色反应为砖红色,气体E 能使湿润的红色石蕊试纸变蓝。 请回答: (1)组成A 的三种元素是________,A 的化学式是________。 (2)固体A 与足量稀盐酸反应的化学方程式是________。 (3)气体E 与甲醛在一定条件可生成乌洛托品(学名:六亚甲基四胺),该反应的化学方程式是________(乌洛托品可以用分子式表示)。 【答案】Ca 、H 、N 2Ca HN 2422Ca HN 5HCl 2CaCl H NH Cl +=+↑+ 34NH 6HCHO +→ (或6124C H N )26H O + 【解析】 【分析】 溶液C 焰色反应为砖红色说明溶液C 中含有Ca 元素,可知沉淀F 为CaCO 3,4.00g 碳酸钙的物质的量为 4.00g =0.04mol 100g/mol ,根据元素守恒可知固体A 中含有Ca 元素,其质量为 0.04mol×40g/mol=1.60g ;气体E 能使湿润的红色石蕊试纸变蓝说明气体E 为NH 3,所以溶液D 中含有NH 4+,根据元素守恒可知溶液C 中含有N 元素,固体A 中含有N 元素;气体B 为纯净物,其物质的量为0.448L =0.02mol 22.4L/mol ,固体A 中Ca 元素的质量为1.60g ,则其 他元素为1.90g-1.60g=0.30g ,可先假设E 为一种常见的气体,若该气体为NO 、NO 2、O 2,则固体A 中另外一种元素为O ,而0.02mol NO 或NO 2或O 2所含氧元素的质量均大于0.30g ,故不合理,若该气体为H 2,固体A 中另外一种元素为H ,则符合题意,同时可以参考CaH 2与水的归中反应生成氢气。 【详解】 (1)根据分析可知固体A 中的三种元素为:Ca 、N 、H ;Ca 的常见化合价为+2价,已知固体A 中Ca 元素的物质的量为0.04mol ,质量为1.60g ,N 元素的和H 元素质量为0.04g 共0.30g ,N 的相对原子质量为14,氢的相对原子质量为1,据此可推测A 的化学式可能为
2020-2021 高考化学知识点过关培优训练∶高无机综合推断及详细答案 一、无机综合推断 1.现有金属单质 A 和气体甲、乙、丙及物质B、 C、 D、 E、 F、G,它们之问能发生如下反应,其中乙是黄绿色气体(图中有些反应的产物和反应的条件没有全部标出)。 请根据以上信息回答下列问题: (1)写出下列物质的名称:丙 -_______________; (2)写出下列物质的化学式: F________________; (3)气体乙是一种重要的化工原料,在工农业生产、生活中有着重要的应用。请你根据所 学 知识回答下列问题: ①把气体乙通入紫色石蕊溶液中,可以观察到的现象是:__________,请你解释其中的原因__________________ 。 ② 某化学兴趣小组计划用气体乙和物质 B 制取简易消毒液D。其反应原理为:(用化学方程式 表示) ______________。 【答案】氯化氢Ca(ClO)2先变红后褪色氯气和水反应生成 HCl、 HClO,溶液显酸性使石蕊变红 HClO 具有漂白性(或强氧化性)使溶液褪色Cl2+2NaOH=NaCl+NaClO+HO 【解析】 【分析】 金属单质 A 和氧气反应生成淡黄色固体 G,所以 A 是钠、 G 是过氧化钠;乙是黄绿色气体, 乙是氯气;钠与水反应生成氢气和氢氧化钠;氢气和氯气生成氯化氢,氯化氢溶于水 生成盐酸;浓盐酸与二氧化锰加热生成氯气;氯气与石灰乳反应生成漂白粉;氢氧化钠与 氯气生成次氯酸钠。据此分析解答。 【详解】 (1)根据以上分析,丙是氯化氢; (2) F 是 Ca(ClO)2; (3)①把氯气通入紫色石蕊溶液中,氯气与水生成盐酸和次氯酸,溶液呈酸性,石蕊变红 色,次氯酸具有漂白性,所以石蕊褪色,可以观察到的现象是:先变红后褪色; ②氢氧化钠与氯气生成次氯酸钠的方程式为Cl2+2NaOH=NaCl+NaClO+HO。 2.已知 A 为金属单质,它们之间能发生如下反应(部分产物未标出)
1、(14分) 常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示 (1)分别写出A 、B 、C 、D 的化学式: A B C D (2) 试写出有关化学方程式: A → B D →A 。 2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________; ②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。 3、(8分)现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些 反应的产物和反应的条件没有全部标出)。 请根据以上信息回答下列问题: ⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式: 反应① 反应⑤ 4、(13分)A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出) (1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.
的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________. (3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应 ①的化学方程式为____________________,B固体属于__________晶体. 5.(10分)短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间的 反应不在溶液中进行(E可能 ..与A、B两种物质中的某种相同)。 请回答下列问题: (1)若C是离子化合物,D是一种强碱,写出C的化学式。 (2)若C与水发生复分解反应,E的水溶液呈弱酸性,D是既能溶于强酸、又能溶于强碱的化合物。 ①用电离方程式解释D既能溶于强酸,又能溶于强碱的原因(仅写出电离方程式即可)。 。 ②用等式表示E与NaOH溶液反应生成的正盐溶液中所有离子 ..浓度之间的关系 ______________________________________________________。 (3)若C是一种气体,D是一种强酸。 ①C与水反应的化学方程式_________________________。 ②有人认为“浓H2SO4可以干燥气体C”。某同学 为了验证该观点是否正确,用右图装置进行实验。 实验过程中,浓H2SO4中未发现有气体逸出,且变为红棕色,则你得出 的结论是__________________________________________________________________________。 6、已知A、B均是由两种短周期元素组成的化合物,A中某元素的质量分数为75%,C、J是同周期元素的气态氢化物,X为无色液体,D具有两性。反应生成的水均已略去。它们有如下图所示的关系。 (1)写出化学式:A.,B.,C.。 (2)反应③中每生成lmolF,转移电子的数目为:。 (3)反应④的化学方程式为:。 (4)写出离子方程式分别为:反应②; 反应⑤。 (5)反应①中,每1.00g C与足量的F作用,恢复到25℃放出55.6kJ热量,写出反应①的热化学方程 式。。 7、下图是由短周期元素组成的物质之间的转化关系。其中,A的相对分子质量为144,反应①中生成C、D 物质的量之比为3 :1,D是不溶于水的白色固体,除反应③⑤外其它反应均在溶液中进行,F、G是气态非金属单质,K是一种常见的非极性有机溶剂,密度比水大。(某些生成物和反应条件已略去)
提升训练26 元素与物质推断(第27题) 1.(2018·学军中学模拟)探究无机盐X(仅含三种短周期元素)的组成和性质,设计并完成如下实验: 请回答: (1)X的化学式是。 (2)白色粉末溶于氢氧化钠溶液的离子方程式 是。 (3)白色沉淀用途广泛,请列举一例:。 2.某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期第ⅤA族。D、E、H均为难溶于水的白色固体,化合物C、E均含A元素。其余物质均为中学化学中的常见物质。 请回答: (1)写出H的化学式:。 (2)化合物A3M4中含有的化学键类型为。 (3)写出反应②的离子方程式:。 3.为了探究不溶性盐X(仅含5种元素)的组成和性质,设计并完成如下实验(所加试剂均过量,气体体积均在标准状况下测定)。 请回答: (1)X的组成元素为H、O和(用元素符号表示),气体C的电子式 为。 (2)写出反应①的离子方程式:。 4.为探究含结晶水的化合物X(含四种元素,摩尔质量为180 g·mol-1)的组成和性质,某兴趣小组设计并完成如下实验:
请回答: (1)黑色固体Y的化学式为,气体C的电子式为。 (2)晶体X隔绝空气受热分解的化学方程式为。 5.某盐A是由三种元素组成的化合物,某研究小组按如图流程探究其组成: 请回答: (1)写出红棕色固体C的化学式:。 (2)写出A受热分解反应的化学方程式:。 (3)写出检验A中阳离子的实验方案:。 6.为探究某矿物X(仅含三种元素)的组成,设计并完成了如下实验: 已知:气体A能使品红溶液褪色,固体B中仅含CuO、Fe2O3。 请回答: (1)X的化学式为。 (2)溶液C中存在的阳离子有。 参考答案 提升训练26元素与物质推断(第27题) 1.答案: (1)Mg2SiO4或2MgO·SiO2 (2)SiO2+2OH-Si+H2O (3)优良的阻燃剂(答案合理即可)
“无机框图推断题”题眼 方法一:根据物质的特殊颜色推断 知识准备:物质颜色 1.有色固体: 白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3、铵盐,白色或黄色腊状固体:白磷 淡黄色或黄色:S 黄或浅黄、FeS2黄、AgI 黄、Au 黄、Na2O2 浅黄、AgBr 浅黄、Ag3PO4浅黄等。 红色或红棕色:Cu 紫红、Cu2O 红、Fe2O3红棕色、Fe(OH)3红褐色。 黑色:C、CuS、Cu2S 、FeS 、MnO2、FeO、Fe3O4(磁性物质)、CuO、PbS 、Ag2O棕黑 紫黑色:I2紫黑、KMnO4紫黑。 2.有色溶液: Cu2+蓝、MnO4-紫红、Fe2+浅绿、Fe3+ 棕黄、Fe(SCN)3血红、NO2-浅黄。 氯水浅黄绿色、溴水橙黄色、碘水棕黄色、溴的有机溶液橙红—红棕、I2的有机溶液紫红 3.气体小结 1、有颜色的气体:F2(淡黄绿色),Cl2(黄绿色),NO2(棕色),溴蒸气(红棕色)、I2(紫色)、O3(淡蓝色)。其余均为无色气体。 2、有刺激性的气体:HF,HCl,HBr,HI,NH3,SO2,NO2,F2,Cl2,溴蒸气。有臭鸡蛋气味的气体:H2S 3、易溶于水的气体:HF,HCl,HBr,HI,NH3,SO2和NO2。能溶于水的气体:CO2,Cl2,H2S和溴蒸气。 4、易液化的气体:NH3,SO 2,Cl2 5、有毒的气体:F2,HF,Cl2,H2S,SO2,CO,NO,NO2和溴蒸气。 6、在空气中易形成白雾的气体:HF,HCl,HBr,HI 7、常温下由于发生化学反应而不能共存的气体:H2S和SO2,H2S和Cl2,HI和Cl2,NH3和HCl,NO 和O2,F2和H2 8、其水溶液呈酸性且能使紫色石蕊试液变红色的气体:HF,HCl,HBr,HI,H2S,SO2,CO2,NO2和溴蒸气。可使紫色石蕊试液先变红后褪色的气体:Cl2。可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH3 9、有漂白作用的气体:Cl2(有水时)和SO2。 10、能使澄清石灰水变浑浊的气体:CO2,SO2,HF。 11、能使无水CuSO4变蓝的气体:水蒸气。 12、在空气中可燃的气体:H2,CH4,C2H2,C2H4,CO,H2S。在空气中点燃后火焰呈淡蓝色的气体:H2S,CH4,CO,H2。 13、具有氧化性的气体:F2,Cl2,溴蒸气,NO2,O2。具有还原性的气体:H2S,H2,CO,NH3,HI,HBr,HCl,NO。SO2和N2通常既可显示氧化性又可显示还原性。
无机推断题复习 1.颜色状态 状态常温下呈液态的特殊物质:H2O、H2O2、C6H6 、C2H6O 、Br2、Hg、等 颜色有色气体:NO2 (红棕色)、F2(浅 黄绿色)、Cl2(黄 绿色);无色刺激 性气体:SO2、 NH3、HX(F、Cl、 Br、I);无色无 味气体:H2、N2、 O2、CO2、CO、 CH4、C2H2、NO。 溶液中的有色离 子:Cu2+(蓝色)、Fe2 +(浅绿色)、Fe3+(黄 色)、MnO4-[紫(红) 色]。Br2在水中显黄 (橙)色,在有机溶剂 中显橙(红)色,I2在 水中显黄(褐)色,在 有机溶剂中显紫 (红)色。 有色固体:(淡)黄(棕) 色固体:Na2O2、S、 FeS2、FeCl3;黑色固体: MnO2、C、CuO、FeO、 Fe3O4、CuS CuS2; 紫(黑)色固体:KMnO4、 I2;(紫)红色固体:Cu Fe2O3Cu2O e(OH)3 Cu; 蓝(绿)色固体: Cu(OH)2CuSO4·5H2O。 有色沉淀:①白色沉淀: H2SiO3、AgCl、BaSO4(不 溶于酸)、BaSO3、 Mg(OH)2、Fe(OH)2、 Al(OH)3、BaCO3、 CaCO3、CaSO3、MgCO3 等;②(浅)黄色沉淀: AgBr、AgI、S;③红褐 色沉淀:Fe(OH)3;④蓝 色沉淀:Cu(OH)2;⑤黑 色沉淀:CuS、FeS。 2、物质的特征结构 10电子微粒可能为N3-、O2-、F-、OH-、NH2-、Ne、CH4、NH3、H2O、HF、Na+、Mg2+、Al3+、NH4+、H3O+等。 18电子微粒可能为K+、Ca2+、Ar、F2、SiH4、PH3、H2S、HCl、H2O2、N2H4 CH3CH3 CH3F CH3OH HS-、S2-、Cl-、O22-等。 14电子微粒可能为CO、N2 、C22- 常见的正四面体结构有甲烷、CCl4、白磷、NH4+;三角锥形有NH3;直线型的多原子分子可能为CO2。 H的原子核内没有中子。 常见元素中半径最小的是H。 最外层电子数等于电子层数 的元素有 H、Be、Al、Ge等。 最外层电子数是次外层电子数2倍或3倍的元素一定在第二周期常见的原子晶体单质是金刚石和晶体硅
2020届高考化学无机推断精讲精练 1.复习重点: 1、关心学生熟练把握重要的元素〔CL、Br、N、S、H、O、Si、Na、Mg、Al、Fe、Cu等〕单质及其化 合物的性质,以及它们之间存在的转化关系,是分析解决推断题的必备的基础知识。 2、以网络的形式让学生自我找出知识点之间的内在联系,构筑学生自我的知识框架 3、要紧题型有选择题和框图题两大题型,解选择题要防备题设的陷井。解框图题不外乎两种方法, 一种是依照专门性质找到题眼后顺藤摸瓜,另一种是缩小范畴后发散推理。 2.难点聚焦 1.氯元素的知识网络 2.次氯酸、漂白粉的性质 HClO分子的结构式为H-O-Cl〔氧处于中心〕,因此电子式为。次氯酸、次氯酸钙等有多方面的性质,经常用到以下几方面性质: 〔1〕HClO是一种弱酸,与碳酸比较电离能力有如下关系:H2CO3>HClO>HCO3-,请分析以下反应:少量二氧化碳通入NaClO溶液中:NaClO + CO2+H2O=NaHCO3+HClO 氯气通入碳酸氢钠溶液中:Cl2+NaHCO3=NaCl+CO2↑+HClO 〔2〕ClO-是一种弱酸的酸根离子,能发生水解反应:ClO-+H 2O HClO+OH-,因此次氯酸钙溶液显碱性。 假设遇到铁盐、铝盐易发生双水解:3ClO-+Fe3++3H2O=Fe(OH)3↓+3HClO 〔3〕HClO和ClO-都具有强氧化性,不管酸性、碱性条件下都能够跟亚铁盐、碘化物、硫化物等发生氧化还原反应,但不能使品红溶液褪色。如: 硫酸亚铁溶液遇漂白粉:2Fe2+ + 5ClO- + 5H2O = 2Fe(OH)3↓+Cl- + 4HClO 漂白粉遇亚硫酸酸盐:ClO-+SO32-=Cl-+SO42- ??2HCl+O2↑ 〔4〕HClO见光易分解:2HClO?→ 〔5〕次氯酸钙中的Ca2+、ClO-能够表现出一些综合性质。如少量二氧化碳通入次氯钙溶液中:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO 注意明白得二氧化碳、碳酸钠、碳酸氢钠分不跟次氯酸钙溶液反应的差异: Ca(ClO)2+Na2CO3=CaCO3↓+2NaClO Ca(ClO)2+NaHCO3=CaCO3↓+HClO+NaClO 3.碳、硅及化合物的联系网络
2020-2021高考化学——高无机综合推断的综合压轴题专题复习附答案解析 一、无机综合推断 1.化合物A由三种元素组成,某兴趣小组进行了如下实验: 已知:气体甲为纯净物且只含两种元素,在标况下体积为672 mL;溶液乙为建筑行业中常用的粘合剂。 请回答下列问题: (1)A的组成元素为________(用元素符号表示); (2)写出气体甲与NaOH(aq)反应的离子方程式________; (3)高温下,A与足量氯气能发生剧烈爆炸,生成三种常见化合物试写出相应的化学方程式________。 【答案】Mg、Si、H Si2H6 + 4OH- + 2H2O = 2 SiO32- + 7H2↑ MgSi2H4 + 7Cl2 = MgCl2 + 2SiCl4 + 4HCl 【解析】 【分析】 因溶液乙为建筑行业中常用的粘合剂,则为硅酸钠,根据元素守恒可知,气体甲中含有硅元素,与氢氧化钠恰好完全反应生成气体单质乙,所消耗的氢氧化钠的物质的量为1 mol/L×120×10-3 L = 0.12 mol,根据硅酸钠中Na元素与Si元素的原子个数比为2:1,可知气体甲中含Si的物质的量为0.12mol/2 = 0.06 mol,又知气体甲为纯净物且只含两种元素, 在标况下体积为672 mL,即 3 67210 22.4/ L L mol - ? = 0.03 mol,则易知A为0.03 mol,其摩尔质量为 2.52 0.03g mol = 84 g/mol,且1个气体甲分子中含2个硅原子,同时气体甲与氢氧化钠按物质的量为0.03 mol:0.12 mol = 1:4的反应生成硅酸钠与气体单质乙,根据元素守恒可知气体单质乙中含氢元素,即为氢气。因此气体甲中的另一种元素不能为氧元素,可推知气体甲中的两种元素为硅元素与氢元素。另外,结合溶液甲只有一种溶质,且加入过量的氢氧化钠生成白色沉淀,沉淀受热不易分解,推出白色沉淀为难溶氢氧化物,所用盐酸的物质的量为3 mol/L×20×10-3 L = 0.06 mol, A的质量为2.52 g,化合物A由三种元素组成,推测所含的金属元素为镁,根据Mg~2HCl可知,一个分子A中含1个镁原子,再根据分子组成可确定A中所含氢原子的个数为84-1×24-2×28 = 4,据此分析作答。 【详解】 根据上述分析可知, (1)A的组成元素为Mg、Si、H, 故答案为Mg、Si、H;
高考化学高无机综合推断(大题培优)及答案 一、无机综合推断 1.某新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期V A族。D、E、H 均为难溶于水的白色固体:化合物C、E均含A元素。其余物质均为中学化学中常见物质。 请回答: (1)写出H的化学式:________________。 (2)化合物A3M4中含有的化学键类型为:________________。 (3)写出反应②的离子方程式:________________。 【答案】AgCl共价键SiO2+2OH- = SiO32-+H2O 【解析】 根据题中各物质转化关系,D受热得E,E能与氢氧化钠反应生成F,F与过量的二氧化碳反应生成D,说明D为弱酸且能受热分解;新型无机材料A3M4由两种非金属元素组成,元素M位于第二周期VA族,应为N元素,A元素为四价元素,C、E均为含A元素,可知A3M4应为Si3N4,可以确定A为Si,E为SiO2,F为Na2SiO3,则D为H2SiO3,G与硝酸银反应生成 不溶于稀硝酸的沉淀H,则可知G中有Cl- ,H为AgCl,故C为SiCl4,B为Cl2;由SiCl4+3H2═4HCl+H2SiO3,生成G:HCl; (1)H的化学式为AgCl; (2)化合物Si3N4中含有的化学键类型为共价键; (3)SiO2溶解于NaOH溶液发生反应的离子方程式为SiO2+2OH- = SiO32-+H2O。 2.黑色固体物质A有如下图所示的转化关系。每个方框表示有一种反应物或生成物(反应条件及生成的水已略去),其中C、F常温下为无色气体,D、E有共同的阳离子。 ⑴写出B和C的化学式:B______________;C______________。 ⑵写出反应④的离子方程式______________ 【答案】FeSO4 H2S 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ 【解析】 【分析】 从框图中可以看出,反应②是解题的突破口。因为它的已知信息多,不仅有“D、E有共同
高三化学(无机推断题)精选汇编 1.( 14 分)下图是无机物A ~N 在一定条件下的转化关系(部分产物及反应条件未列出)。其中,I 是由第三周期元素组成的单质中熔点最高的金属,K 是一种红棕色气体。N 中只含有两种元素,N 可作为工业生产C 的原料。 请填写下列空白: (1)在周期表中,组成单质G 的元素位于第__________周期_______族。 (2)在反应②、③、⑥、⑨中,既属于化合反应又属于非氧化还原反应的是_________(填写序号)。 (3)反应⑩的离子方程式是:_______ ______。 (4)反应④ 的离子方程式是:___________________________________。 (5)将化合物D 与KNO 3、KOH 共融,可制得一种“绿色”环保高效净水剂K 2FeO 4 (高铁酸钾).同时还生成KNO 2和H 2O 。该反应的化学方程式是: ________________________________________________________________(6)现有1molN 参加反应,假设各步反应均完全,生成C 的质量为490g ,生成G 的质量为224g ,则反应①的化学方程式为_______________________。 1.( 14 分) ( l )四(或4 ) VIII (共1分,错一个扣1分) ( 2 )③ (1分) ( 3 ) 3Fe +2 NO 3- + 8H + + = 3Fe 2+ + 2NO ↑+4H 2O (3分) ( 4 ) 3Fe 2+ + NO 3- + 4H + + = 3Fe 3+ + NO ↑+2H 2O (3分) ( 5 ) Fe 2O 3+3KNO 3+4KOH 高温 2K 2FeO 4+3KNO 2+2H 2O (3分) (6)Fe 4S 5+8O 2高温 2Fe 2O 3+5SO 2(3分) 2.(10分)无机框图下图为中学化学中几种常见物质的转化关系(部分产物已略去)。已知:A 、C 、D 是常见的气体单质,F 气体极易溶于水,且液态常做致冷剂。 电解 C D E F ① ③ F B ② ④ A G A B 溶液 (1 )写出化学式F ,写出电子式G ; (2)鉴定G 中阳离子的实验方法和现象__________________________________; (3)D 单质和E 溶液反应,生成一种常见的消毒剂和漂白剂的有效成分,写出D+E 溶液反应的离子方程式和③的化学方程式 、 。 (4)工业上电解B 溶液制得一系列化工原料,写出其电解的化学方程式,并标出电子转移的方向和数
无机推断 24.(9分)甲、乙、丙是分别由H、C、O、Si、Al、Cu等六种元素中的两种或多种元素组成的化合物。已知甲、乙、丙均不含结晶水,含化合物甲的矿物是工业上电解法冶炼某种常见金属单质的原料,经检测甲是一种高熔点化合物,能溶于强酸、强碱溶液;化合物乙是光导纤维的主要成分;化合物丙为一种呈深蓝色的碱式盐,将34.6g丙隔绝空气加热分解生成24g黑色固体X、无色酸性气体Y(标准状况下,密度为1.96 g/L)和水。生成的Y折合成标准状况下的体积为4.48L。固体X难溶于水,能溶于硫酸,形成蓝色溶液。请回答下列问题: (1)写出气体Y的结构式,化合物丙的化学式。 (2)写出甲与NaOH溶液反应的离子方程式。另外,工业上常用甲与焦炭、氯气共热生成化合物丁和CO,而丁仅由两种元素组成,请写出该反应的化学方程式并标出电子转移的方向和数目。 (3)乙溶于氢氟酸后生成一种极强的二元酸和水。经分析该酸由3种元素组成,其中氟元素的质量分数为79.17%。请写出乙溶于氢氟酸的离子方程式。 (4)将固体X溶于适量 ..的硫酸,往所得溶液中滴加NaOH浓溶液时,先出现蓝色絮状沉淀,继续滴加NaOH浓溶液并不断振荡,则沉淀消失形成蓝色溶液。综合以上信息可以说明蓝色絮状沉淀物具有__________性(填化学性质)。 26.(14分) M、N、Q、X、Y五种短同期元素,它们的原子序数依次增大。①M元素组成的单质是密度最小的物质;②N元素原子的最外层电子数是其内层电子总数的2倍;③Y 原子的电子层数与最外层电子数之比为3:1;M、N、Q、Y四种元素,每一种均能与X 元素形成原子个数比不相同的若干化合物。 请回答下列问题: (1)X在元素周期表中的位置;写出Y的离子结构示意图; (2)写出M与N构成含14电子的分子的电子式; (3)由上述元素中2种原子按1:1组成一种常见液态化合物的稀溶液的分解,可选用的催化剂__________ A.KMnO4 B.MnO2C.NaCl D.FeCl3E.Na2SO3 (4)列举由以上3种元素组成的均含Q的酸性盐、碱性盐各1种________________,__________,并用离子方程式说明某盐溶液显碱性的原因: _____________________; (5)甲是Y元素最高价氧化物的水化物。常温下,将CH3COOH溶液和甲溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表: