高中化学无机推断题带答案解析
- 格式:doc
- 大小:932.00 KB
- 文档页数:8

高中化学10道无机推断练习题_一、推断题1.某课外学习小组对日常生活中不可缺少的调味品M进行探究。
已知C可在D中燃烧发出苍白色火焰。
M与其他物质的转化关系如下图所示(部分产物、反应条件已略去):(1)常温下,用惰性电极电解M溶液(足量)发生反应的离子方程式为___________________,电解一段时间后,让溶液复原的方法为______________________,若M溶液为0.5L,电解一段时间后,两极共生成气体1.12L(已折算为标准状况下的体积),则电解后溶液的pH为________(忽略溶液的体积变化)。
(2)若A是一种常见的难溶于水的酸性氧化物,可用于制造玻璃,则E溶液的俗称是_____________。
(3)若A是CO2气体,将一定量的A通入B溶液,得到溶液W,再向溶液W中滴入盐酸,相关量如图所示,则溶液W中的溶质及其物质的量分别为__________________、______________________。
(4)若A是一种化肥。
A和B反应可生成气体E,E与D相遇产生白烟,工业上可利用E与D的反应检查输送D的管道是否泄漏,是因为E与D可发生反应:____________________(写化学方程式)。
2.已知A为淡黄色固体,T为生活中使用最广泛的金属单质,D是具有磁性的黑色晶体,C是无色无味的气体,H是白色沉淀。
(1)物质A的化学式为 ________。
(2)H在潮湿空气中变成M的实验现象是_____________________,化学方程式为______________________。
(3)A和水反应生成B和C的离子方程式为_______________,列出A的一种重要用途_________。
(4)反应①的离子方程式为________________________。
3.A-I分别表示中学化学中的常见物质,它们之间的相互转化关系如下图所示(部分反应物、生成物没有列出),且已知G是一种两性氧化物,A、B、C、D、E、F六种物质中均含有同一种元素,F 为红褐色沉淀。
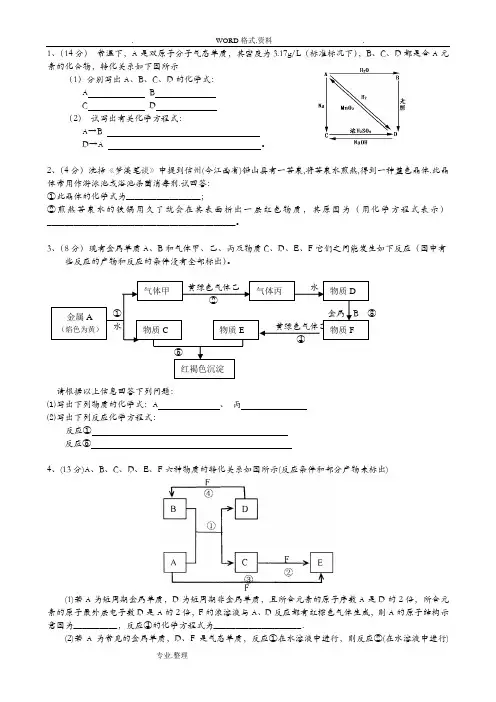
1、(14分) 常温下,A 是双原子分子气态单质,其密度为3.17g/L (标准标况下),B 、C 、D 都是含A 元素的化合物,转化关系如下图所示(1)分别写出A 、B 、C 、D 的化学式:A B C D (2) 试写出有关化学方程式:A →B D →A 。
2、(4分)沈括《梦溪笔谈》中提到信州(今江西省)铅山县有一苦泉,将苦泉水煎熬,得到一种蓝色晶体.此晶体常用作游泳池或浴池杀菌消毒剂.试回答: ①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________。
3、(8分)现有金属单质A 、B 和气体甲、乙、丙及物质C 、D 、E 、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙 水 ② ① 金属 B ③ 水 黄绿色气体乙 ④ ⑤请根据以上信息回答下列问题:⑴写出下列物质的化学式:A 、 丙 ⑵写出下列反应化学方程式:反应① 反应⑤4、(13分)A 、B 、C 、D 、E 、F 六种物质的转化关系如图所示(反应条件和部分产物未标出)(1)若A 为短周期金属单质,D 为短周期非金属单质,且所含元素的原子序数A 是D 的2倍,所含元素的原子最外层电子数D 是A 的2倍,F 的浓溶液与A 、D 反应都有红棕色气体生成,则A 的原子结构示意图为__________,反应④的化学方程式为____________________.(2)若A 为常见的金属单质,D 、F 是气态单质,反应①在水溶液中进行,则反应②(在水溶液中进行)金属A (焰色为黄) 气体甲 气体丙 物质D 物质C 物质E 物质F 红褐色沉淀的离子方程式是____________________,已知常温下1g D与F反应生成B(气态)时放出92.3kJ热量,写出反应的热化学方程式____________________.(3)若A、D、F都是短周期非金属元素单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式为____________________,B固体属于__________晶体.5.(10分)短周期常见元素形成的纯净物A、B、C、D、E的转化关系如下图所示,物质A与物质B之间与A、B两种物质中的某种相同)。

高一化学无机推断试题答案及解析1.(15分)下图是无机物A~M在一定条件下的转化关系(部分产物及反应条件未列出)。
其中,I是第三周期原子半径最小的金属元素组成的单质,D是一种红棕色固体粉末,G为单质,K是一种红棕色气体,A、B相对分子质量相差16,J、C都是常见的强酸。
请填写下列空白:(1)写出下列物质的化学式B E 。
(2)反应⑦的化学方程式为。
反应⑦属于。
A.吸热反应B.放热反应C.置换反应D.氧化还原反应(3)反应⑩的离子方程式为。
(4)将化合物D与KNO3、KOH混合,在高温条件下可制得一种“绿色”环保高效净水剂K2GO4(G显+6价),同时还生成KNO2和H2O。
该反应的化学方程式是:。
(5)反应①中生成的A、D物质的量之比为4:1,已知甲矿石的主要成分是由两种元素组成的化合物,则该化合物的化学式为。
【答案】(1)B SO3 E Fe(OH)3;(2) Fe2O3+ 2Al Al2O3+2Fe 。
反应⑦属于BCD 。
(3) 3Fe+2NO3-+8H+ = 3Fe2++2NO↑+4H2O 。
(4) Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O。
(5) FeS2。
【解析】(1)甲矿石是FeS2,矿石煅烧得到A:SO2和D:Fe2O3;SO2与O2发生反应得到B:SO3,SO3与水作用得到C:硫酸;I是Al,Al与Fe2O3发生铝热反应:Fe2O3+ 2Al Al2O3+2Fe,得到的G的Fe;H是Al2O3。
E是Fe(OH)3;F是Fe2(SO4)3和Fe(NO3)3的混合物,M是Fe(NO3)2.L是NO;K是NO2,J是 HNO3。
(1)B是SO3;E是Fe(OH)3;(2)反应⑦的铝热反应的化学方程式为Fe2O3+ 2Al Al2O3+2Fe,铝热反应是放热反应,因为符合置换反应的定义,所以属于置换反应,有元素的化合价的升高与降低,所以也是氧化反应反应。
因此选项是B、C、D。

浙江省普通高中学业水平考试选择题第28题无机推断题【题前知道】常见物质的物理性质(物质的颜色、溶解性、密度等)、化学性质、氧化还原反应、分解反应、物质的检验、物质的量计算、质量守恒定律等知识。
具体考查卤族元素的单质及化合物、钠镁铝单质及化合物、氧硫单质及化合物、铁铜单质及化合物的性质及转变。
考查内容:推导物质的化学式、某一转化过程的化学方程式或离子方程式、某一步在操作时要注意的问题等。
一般要推导的无机物不太常见。
如:K2FeO4,KFeO2,Na2S2O3,S2Cl2,KO2,K2S2O8,CuCl,NaN3,CuH,K2S X(X=16),KI3,FeC2O4,Cu2(OH)2SO4,FeC2O4·2H2O,Na2S2O8等。
解题思路:先审题,阅读题目所给的流程图,找到有用的信息,如物质的颜色、性质等,确定物质是什么,根据已知物质确定要推导物质的组成元素是什么,根据给出物质一般为沉淀如硫酸钡,氧化铜,氧化铁等或气体如NH3、CO2的质量算出物质的量,推导出未知物质的组成元素或原子团的物质的量,再根据质量守恒,计算出各元素或原子团的物质的量,物质的量之比就是物质组成各元素原子或原子团的个数之比,推导出该物质的化学式。
如果求算出原子团或原子个数之比不符合电荷守恒,则所推导的物质中还有其它原子或原子团,如碱性盐还有OH等。
沉淀的颜色是一个重要的信息,可以推导出组成的元素或离子。
常考有颜色的离子或物质有:含Cu2+物质的水溶液或含有结晶水的物质为蓝色。
含Fe2+的水溶液为浅绿色,该溶液能使酸性高锰酸钾溶液或氯水溴水褪色。
Fe3+的水溶液为黄色,与KSCN溶液变血红色溶液,通入SO2气体黄色变浅绿色。
Fe2O3为红色(红棕色固体)。
CuO为黑色固体。
Cu2O为砖红色固体。
FeS2为黄色固体。
BaSO4和AgCl白色沉淀。
【真题回顾】1.(2022年7月浙江学考)盐X为某种矿石的主要成分,仅含四种元素,不含结晶水。

高中化学学习材料解答无机框图推断题的思路与技巧顾浩平无机框图推断题以其涉及知识面广,思维能力要求高等特点而倍受高考命题者的青睐,是近年高考的热点题型之一。
在高考试题中,无机框图推断通常作为一道大题出现,因此在高考试卷中的权重较大,理应引起广大迎考师生的重视!在解答框图推断题时,同学们常常会出现如下一些情况:思路顺畅时,解答这类试题会十分顺利,如果思路不畅时,或者一时想不到某一物质时,这类试题的解答常常会显得无从下手,即这类试题的解答对同学们来说,常常会出现时好时坏的现象,具有一定的偶然性和不稳定性,因此考试成绩也会因此而忽上忽下。
在高考成绩可能决定个人命运的今天,这种忽上忽下的成绩变化可能是致命的。
为帮助同学能顺利地解答这类试题,本文将重点介绍这类试题的解题思路和解题技巧,以供参考。
一、注意有关物质的特性,掌握常见的解题“题眼”,为顺利解题作好知识准备。
无机框图推断所涉及的知识主要是元素化合物的性质知识,因此若要顺利解答无机框图推断题,首先就应掌握相关物质的性质知识,否则解题是很难做到得心应手的。
其次要熟悉一些用作顺利解题的“题眼”,以便解题时能顺藤摸瓜,快速得出正确结论。
在解答框图推断题时,常用作解题“题眼”的知识有:1.既能与酸反应又能与碱反应(两性)的物质常常是解答框图推断题的“题眼”或切入点;这类物质通常有:①Al、Al2O3、A l(O H)3的两性;②弱酸的铵盐,如碳酸铵、碳酸氢铵、硫化铵、亚硫酸铵等;③除硫酸以外的多元弱酸的酸式盐,如碳酸氢钠、亚硫酸氢钠等;④氨基酸的两性;⑤酯的水解等。
2. 受热分解的物质或反应通常有:①2KMnO4K2MnO4+MnO2+O2↑②2KClO32KCl+3O2↑③难溶性碳酸盐,如:CaCO3CaO+CO2↑、C u2(O H)2C O32CuO+CO2↑+H2O ④酸式碳酸盐,如:2NaHCO3Na2CO3+CO2↑+H2O ⑤硝酸或硝酸盐,如:4HNO34NO2↑+O2↑+2H2O、2NaNO32NaNO2+O2↑、2C u(N O3)22CuO+4NO2↑+O2↑、2AgNO32Ag+2NO2↑+O2↑⑥铵盐,如:NH4HCO3NH3↑+CO2↑+H2O、(N H4)2C O32NH3↑+CO2+H2O、NH4Cl NH3↑+HCl等⑦难溶性碱,如:2F e(O H)3Fe2O3+3H2O等⑧2H2O22H2O+O2↑3.与水反应或溶于水时,既有沉淀又有气体产生的物质或反应通常有:①Al2S3+6H2O2A l(O H)3↓+3H2S↑②Mg3N2+6H2O3M g(O H)2↓+2NH3↑③CaC2+2H2O C a(O H)2↓+C2H2↑等。
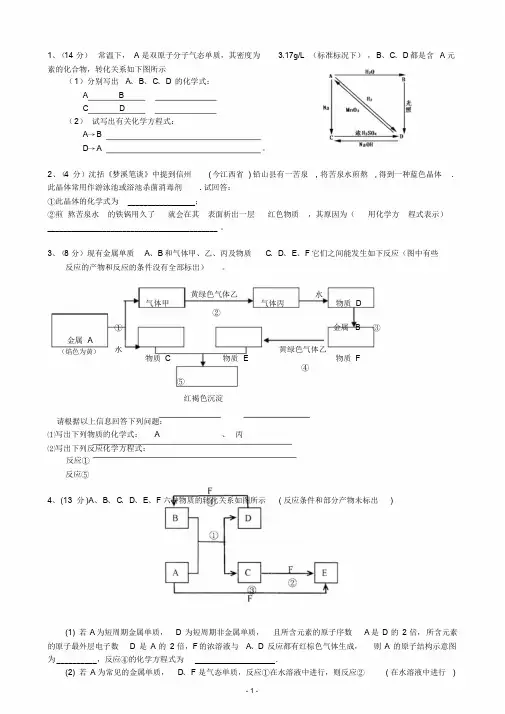
1、(14 分)常温下, A 是双原子分子气态单质,其密度为 3.17g/L (标准标况下),B、C、D 都是含 A 元素的化合物,转化关系如下图所示(1)分别写出A、B、C、D的化学式:A BC D(2)试写出有关化学方程式:A→BD→A 。
2、(4 分)沈括《梦溪笔谈》中提到信州(今江西省) 铅山县有一苦泉, 将苦泉水煎熬, 得到一种蓝色晶体. 此晶体常用作游泳池或浴池杀菌消毒剂. 试回答:①此晶体的化学式为_________________;②煎熬苦泉水的铁锅用久了就会在其表面析出一层红色物质,其原因为(用化学方程式表示)___________________________________________ 。
3、(8 分)现有金属单质A、B 和气体甲、乙、丙及物质C、D、E、F 它们之间能发生如下反应(图中有些反应的产物和反应的条件没有全部标出)。
黄绿色气体乙水气体甲气体丙物质 D②①金属 B ③金属 A(焰色为黄)水黄绿色气体乙物质 C 物质 E 物质 F④⑤红褐色沉淀请根据以上信息回答下列问题:⑴写出下列物质的化学式: A 、丙⑵写出下列反应化学方程式:反应①反应⑤4、(13 分)A、B、C、D、E、F 六种物质的转化关系如图所示( 反应条件和部分产物未标出)(1) 若A 为短周期金属单质,D为短周期非金属单质,且所含元素的原子序数 A 是D的2 倍,所含元素的原子最外层电子数D是A的2 倍,F 的浓溶液与A、D反应都有红棕色气体生成,则A的原子结构示意图为__________,反应④的化学方程式为____________________.(2) 若A 为常见的金属单质,D、F 是气态单质,反应①在水溶液中进行,则反应②( 在水溶液中进行)- 1 -的离子方程式是____________________,已知常温下1g D 与F 反应生成B(气态)时放出92.3kJ 热量,写出反应的热化学方程式____________________ .(3) 若A、D、F 都是短周期非金属元素单质,且A、D所含元素同主族,A、F 所含元素同周期,则反应①的化学方程式为____________________,B 固体属于__________晶体.5. (10 分)短周期常见元素形成的纯净物A、B、C、D、E 的转化关系如下图所示,物质 A 与物质 B 之间的反应不在溶液中进行( E 可.能.与A、B两种物质中的某种相同)。

高考化学与高无机综合推断有关的压轴题含答案解析一、无机综合推断1.化合物甲由四种元素组成。
某化学研究小组按如图流程探究其组成:已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一。
请回答下列问题:(1)甲的化学式为____。
(2)甲发生爆炸反应的化学方程式为____。
(3)已知化合物甲中,有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,则爆炸反应中被氧化的元素与还原产物的物质的量之比为____。
【答案】AgOCN 2AgOCN=2Ag+N2↑+2CO↑ 1:2【解析】【分析】已知丙和丁是相对分子质量相同的常见气体,其中丁是空气的主要成分之一,由此可知丁是氮气,丙是一氧化碳。
根据流程图可知氮气的物质的量为0.01mol,一氧化碳的物质的量为n(CO)= (3-2.16-0.0128)g0.02mol28g/mol⨯=,由此可知甲中C、N、O的原子个数比为1:1:1,化合物由四种元素组成,已知化合物中有两种元素的化合价为最高正价,另两种元素的化合价为最低负价,撞击甲容易发生爆炸生成三种物质,则甲中应该有一种金属元素,设甲的化学式为R(CNO)x,R的相对原子质量为M,根据反应2R(CNO)x=2R+2xCO+xN2,有2M+84x x=30.01,所以M=108x,设x=1,2,3,……,当x=1时,M=108,R为银元素,当x取2、3……时,没有对应的金属元素的相对原子质量符合要求,所以甲为AgOCN。
【详解】(1)由分析可知,甲的化学式为AgOCN,故答案为:AgOCN;(2)由分析可知,乙为银单质,丙为一氧化碳,丁为氮气,则甲发生爆炸反应的化学方程式为2AgOCN=2Ag+N2↑+2CO↑,故答案为:2AgOCN=2Ag+N2↑+2CO↑;(3)根据爆炸反应方程式可知,爆炸反应中被氧化的元素为氮元素,共2mol,还原产物为银单质和一氧化碳,共4mol,则爆炸反应中被氧化的元素与还原产物的物质的量之比为1:2,故答案为:1:2。

高考化学无机推断题大汇总高考化学无机推断题大汇总高考化学中,无机推断题是一种常见的题型。
在这类题目中,考生需要根据所给的实验现象和化学知识进行推断和判断,从而确定物质的性质、反应方式或溶液中所含物质的种类。
下面是一些常见的无机推断题,供考生参考。
1. 实验室中有一个无色溶液,加入酸性钾高锰酸钾溶液后,溶液的颜色变为粉红色。
这时,我们可以推断原来溶液中是铁离子、铬离子还是锰离子?答案:由于酸性高锰酸钾溶液与铁离子和铬离子无反应,而与锰离子反应生成棕黑色固体,所以可以推断原来溶液中是铁离子。
2. 实验室中有一个无色气体X,能让红色石蕊试纸变蓝和黄色湿润性试纸变红,加入氢氧化钠溶液后溶液变浑浊,并生成一种白色固体Y。
这时,我们可以推断气体X是氯气、二氧化硫还是二氧化氮?答案:气体X能让红色石蕊试纸变蓝和黄色湿润性试纸变红,这表明它具有酸性。
而气体X与氢氧化钠反应生成白色固体Y,所以可以推断气体X是二氧化硫。
3. 实验室中有一个无色固体,热解后生成红色气体,与盐酸反应产生氯气。
这时,我们可以推断无色固体是碘化钠、碘化铅还是碘化汞?答案:无色固体热解后生成红色气体,说明它本身含有硫元素。
而与盐酸反应产生氯气,可以推断无色固体是碘化铅。
4. 实验室中有一个无色气体,不可燃,无味,能使湿润性试纸变红,能与二氧化锰反应生成紫红色物质。
这时,我们可以推断无色气体是氢气、氮气还是氧气?答案:无色气体能使湿润性试纸变红,表明它具有酸性。
而与二氧化锰反应生成紫红色物质,可以推断无色气体是氮气。
5. 实验室中有一种无色溶液,与氯气反应生成浑浊物。
这时,我们可以推断无色溶液是盐酸溶液、硫酸溶液还是硝酸溶液?答案:无色溶液与氯气反应生成浑浊物,这表明无色溶液中有一种物质具有还原性,所以可以推断无色溶液是硫酸溶液。
以上只是一些常见的高考化学无机推断题,希望对考生有所帮助。
在解答无机推断题时,需要考生熟练掌握化学常识和实验现象,构建正确的推理链条,准确推断出物质的性质和反应方式。
![高中化学无机推断框图题精选[附答案解析]](https://uimg.taocdn.com/1af367e09ec3d5bbfc0a7418.webp)
1.下图为某些物质之间的变化关系(未注明用量的物质间均按恰好充分反应处理)已知A的焰色反应呈黄色,常温下,甲为能使湿润的红色石蕊试纸变蓝的气体,乙为可燃性气体,甲、乙分子中质子数相等。
(1) A的化学式是;乙的化学式是。
(2) X是一种纯净物,X的化学式是;C中含有、。
(填化学式)(3)能否确定B为何种物质?如果能,写出B的化学式;如果不能,请说明理由。
2.甲、乙、丙为短周期元素形成的常见单质,A、B、C、D、E、F、G、X均为常见的化合物。
B、X的式量(分子量)相同,E的式量比D大16,在一定条件下各物质之间相互转化如下图所示:(1) X的电子式是,G的化学式是。
(2)上述物质中能与水发生反应(不考虑单纯的盐的水解)且反应中水既不是氧化剂也不是还原剂的物质的代号是。
(3)反应“D+丙”的化学方程式是。
(4)写出X与D在稀硫酸中反应的离子方程式。
3.甲、乙、丙三种常见的单质,X、Y、Z三种常见的化合物,它们在一定条件下的相互转化关系如下:请填写以下空白:(1)在X、Y、Z三种化合物中肯定含有乙、丙两种元素的化合物是。
(2)在X、Z两种化合物的正价元素的化合价中,是。
A.前者高B.后者高C.不一定原因是。
(3)当X为两种非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
(4)当X为金属元素与非金属元素组成的化合物时,写出X跟甲反应的化学方程式。
写出丙跟乙反应的化学方程式。
4.有X、Y、Z三种单质,常温下X是固体,Y是液体,Z是气体。
它们之间的反应关系如下图所示:请填写下列空白:(1)据此推断X、Y、Z的化学式:X 、Y 、Z 。
(2) X是常见的单质,它是主族元素,还是副族元素,其理由是:。
(3)写出C+Y → A的离子方程式:。
5.根据以下反应关系图,回答下列问题:(1) A溶液所含溶质是:________________________;(2) A溶液跟B溶液反应的化学方程式是:_______________________________;(3) G转变为E的离子方程式是:__________________________________________。

高中化学离子共存物质分类离子方程式无机推断练习题一、单选题1.下列有关NaClO 和NaCl 混合溶液的叙述正确的是( )A .该溶液中,H +、+4NH 、2-4SO 、Br-可以大量共存B .该溶液中,Ag +、K +、-3NO 、CH 3CHO 可以大量共存C .向该溶液中滴入少量FeSO 4溶液,反应的离子方程式为: 2Fe 2++ClO -+2H +=== Cl -+2Fe 3++H 2OD .向该溶液中加入浓盐酸,每产生1mol Cl 2,转移电子约为6.02×1023个 2.下列说法正确的是( ) A.酸性氧化物都是非金属氧化物B.2O 和3O 互为同素异形体,二者相互转化属于氧化还原反应C.22Na O 和2O 分别属于电解质、非电解质D.由二种元素的阴离子与另一种元素的阳离子构成的物质一定是纯净物 3.下列法正确的是( )A.碱都是强电解质,酸都是弱电解质B.NH 3的水溶液能导电,所以NH 3比为电解质C.强电解质溶液的导电能力很强D.CaCO 3在水中的溶解度小,但溶解的部分完全电离,故CaCO 3是强电解质 4.下列指定反应的离子方程式正确的是( ) A .氯气溶于水:Cl 2+H 2O=2H ++Cl -+ClO -B .Na 2CO 3溶液中2-3CO 的水解:2-3CO +H 2O=-3HCO +OH -C .酸性溶液中KIO 3与KI 反应生成I 2:-3IO +I -+6H +=I 2+3H 2OD .NaHCO 3溶液中加足量Ba(OH)2溶液:-3HCO +Ba 2++OH -=BaCO 3↓+H 2O5.给定条件下,下列选项中所示的物质间转化均能一步实现的是( )A.粗硅4SiCl SiB. ()2Mg OH ()2MgCl aq MgC. 23Fe O ()3FeCl aq 无水3FeClD. ()3AgNO aq ()()32Ag NH OH aq ⎡⎤⎣⎦Ag6.称取424()NH SO 和44NH HSO 混合物样品7.24g,加入含0.1mol NaOH 的溶液,完全反应,生成3NH 1792mL(标准状况),则424()NH SO 和44NH HSO 的物质的量比为( )A.1:1B.1:2C.1.87:1D.3.65:17.酸性条件下,22H O 可氧化CuS :+2+222CuS+H 2H =Cu +S+2H O O +。

“无机框图推断题”题眼方法一:根据物质的特殊颜色推断知识准备:物质颜色1.有色固体:白色:Fe(OH)2、CaCO3、BaSO4、AgCl、BaSO3、铵盐,白色或黄色腊状固体:白磷淡黄色或黄色:S 黄或浅黄、FeS2黄、AgI 黄、Au 黄、Na2O2 浅黄、AgBr 浅黄、Ag3PO4浅黄等。
红色或红棕色:Cu 紫红、Cu2O 红、Fe2O3红棕色、Fe(OH)3红褐色。
黑色:C、CuS、Cu2S 、FeS 、MnO2、FeO、Fe3O4(磁性物质)、CuO、PbS 、Ag2O棕黑、紫黑色:I2紫黑、KMnO4紫黑。
2.有色溶液:Cu2+蓝、MnO4-紫红、Fe2+浅绿、Fe3+ 棕黄、Fe(SCN)3血红、NO2-浅黄。
氯水浅黄绿色、溴水橙黄色、碘水棕黄色、溴的有机溶液橙红—红棕、I2的有机溶液紫红3.气体小结1、有颜色的气体:F2(淡黄绿色),Cl2(黄绿色),NO2(棕色),溴蒸气(红棕色)、I2(紫色)、O3(淡蓝色)。
其余均为无色气体。
2、有刺激性的气体:HF,HCl,HBr,HI,NH3,SO2,NO2,F2,Cl2,溴蒸气。
有臭鸡蛋气味的气体:H2S3、易溶于水的气体:HF,HCl,HBr,HI,NH3,SO2和NO2。
能溶于水的气体:CO2,Cl2,H2S和溴蒸气。
@4、易液化的气体:NH3,SO 2,Cl25、有毒的气体:F2,HF,Cl2,H2S,SO2,CO,NO,NO2和溴蒸气。
6、在空气中易形成白雾的气体:HF,HCl,HBr,HI7、常温下由于发生化学反应而不能共存的气体:H2S和SO2,H2S和Cl2,HI和Cl2,NH3和HCl,NO和O2,F2和H28、其水溶液呈酸性且能使紫色石蕊试液变红色的气体:HF,HCl,HBr,HI,H2S,SO2,CO2,NO2和溴蒸气。
可使紫色石蕊试液先变红后褪色的气体:Cl2。
可使紫色石蕊试纸变蓝且水溶液呈弱碱性的气体:NH39、有漂白作用的气体:Cl2(有水时)和SO2。
高二化学无机推断试题答案及解析1.下图所示的是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质和反应条件被略去。
常温常压下,化合物A是家庭生活中常用的一种调味品,A、C的焰色反应都呈黄色,B 是无色无味的液体,D是黄绿色气体,E、F都是无色气体,F的水溶液是盐酸,H的水溶液具有漂白、杀菌性,J在水溶液中生成时为红褐色沉淀。
(1)H的化学式为。
(2)F的电子式为。
(3)反应①的化学方程式为。
(4)反应②的离子方程式为。
【答案】(1)NaClO(1分)(2)HCl的电子式(略)(1分)(3)2NaCl+2H2O2NaOH+Cl2↑+H2↑(2分)(4)Fe3++3OH-=Fe(OH)3↓(2分)【解析】A、B、C、D、E、F、G、H、I、G、J分别为NaCl、H2O、NaOH、Cl2、H2、HCl、NaClO、FeCl3、FeCl2、Fe(OH)3。
(3)反应①为电解饱和食盐水,产生NaOH、Cl2、H2;(4)反应②为铁盐与碱反应生成氢氧化铁沉淀。
【考点】考查物质的转化有关问题。
2.A~F是中学化学中常见物质,常温下A、C、E、F为气体,B、D为液体,其中B的分子为4原子分子,D在常温下不具有挥发性。
F的浓溶液与X共热通常用于实验室制备单质C,X是一种黑色粉末。
这些物质之间满足如下图所示的转化关系,图中部分生成物已略去。
(1)写出下列物质的化学式:A______,F______。
(2)B的电子式是______。
根据图中信息,B、C、X的氧化性由强到弱的顺序是_ _____(用化学式表示)。
(3)反应⑥的离子方程式是__ ____。
(4)在反应⑥中,F表现的性质是___ ____,当生成0.75mol C时,被氧化的还原剂的物质的量是___ ____。
【答案】(1)SO2 HCl(各1分)(2);MnO2>Cl2>H2O2(各1分)(3)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)(4)还原性、酸性(2分) 1.5 mol(2分)【解析】化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。
无机推断题典例例题1已知A、B、C、D为气体,E、F为固体,G是氯化钙,它们之间的转换关系如下图所示:⑴D的化学式(分子式)是,E的化学式(分子式)是。
⑵ A和B反应生成C的化学方程式是。
⑶E和F反应生成D、H和G的化学方程式是。
解析:由E(固)+F(固) → D(气) + H + G(CaCl2),容易联系到实验室用NH4Cl与Ca(OH)2制NH3的反应,这样可推断出D为NH3,H为H2O,E和F一个为NH4Cl、一个为Ca(OH)2。
由D(NH3)+C(气)→E,可确定E为NH4Cl,C为HCl,则A、B一个为H2、一个为Cl2。
A和B生成C的化学方程式为H2+Cl2===2HCl。
E和F生成D、H和G的化学方程式为2NH4Cl+Ca(OH)2NH3↑+2H2O+CaCl2。
例题2. A、B、C、D、E代表单质或化合物,它们之间的相互转换关系如下图所示。
A为地壳中含量仅次于氧的非金属元素的单质,其晶体结构与金刚石相似。
请填空:⑴形成单质A的原子的结构示意图为,它的最高化合价为。
⑵B的化学式(分子式)为,B的晶体类型为。
B和碳反应生成A和E的化学方程式是。
⑶C的化学式(分子式)为,D的化学式(分子式)为。
解析:由A为地壳中含量仅次于氧的非金属元素的单质,可确定A为Si,其原子结构示意图为,最高化合价为+4价。
由B与碳高温反应可得到A(Si)和E,不难推出B为SiO2,E为CO2,则C为CaSiO3,D为Na2SiO3。
B的晶体类型为原子晶体,B+碳→A+E的化学方程式为C+SiO2=== Si+CO2。
例题3提示:某些金属氧化物跟熔融烧碱反应可生成盐,根据图2化学反应方框图填空:图2(1)单质F是________;(2)写出由E生成G的离子方程式(或化学方程式)____________ ;(3)溶液I中所含金属离子是________________;(4)由若改用浓酸,则不能选用的浓酸是(写分子式)__。
2020-2021备战高考化学压轴题之高无机综合推断(备战高考题型整理,突破提升)附答案解析一、无机综合推断1.某兴趣活动小组利用物质间的互变,设计成一个平面魔方,如下图所示:已知①A、B、C、D、G含有同种元素。
②纯A(单质)B溶液D固体G溶液颜色银白色黄色红棕色浅绿色③E是通常情况下密度最小的气体;B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G。
依据以上信息填空:(1)写出D的化学式:___________________________________________。
(2)G生成C的过程中所出现的现象为_________________________。
(3)写出反应A→B的化学方程式:_________________________________。
(4)B→F的离子方程式为________;G与次氯酸反应的离子方程式为________________________________。
【答案】Fe2O3先产生白色沉淀,迅速变为灰绿色,最后变为红褐色 2Fe+3Cl22FeCl3 2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ H++2Fe2++HClO=2Fe3++Cl-+H2O【解析】【分析】结合框图,D固体呈红棕色,则其为Fe2O3;A、B、C、D、G含有同种元素,B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,则B为FeCl3,G中含有Fe2+,A为Fe。
由“B与硝酸银溶液反应生成不溶于稀硝酸的白色沉淀,也能将一种氧化物氧化为F,F是含有三种元素的化合物,与A反应生成E、G”,则F为H2SO4,G为FeSO4;E是通常情况下密度最小的气体,则E为H2。
由B→C→D的转化可推知,C为Fe(OH)3。
【详解】(1)由以上分析可知,D为氧化铁,其化学式:Fe2O3。
答案为:Fe2O3;(2)FeSO4生成Fe(OH)3,可先加碱、后氧化,所出现的现象为先产生白色沉淀,迅速变为灰绿色,最后变为红褐色。
二、无机推断题 标准答案 (1)极性(1分) (2)2Na 2O 2+2H 2O===4NaOH +O 2↑(2分) (3)NH 4HCO 3+2NaOH=====△Na 2CO 3+NH 3↑+2H 2O(2分) CO 2-3+H 2O HCO -3+OH -(2分)(4)2NH 3+6OH --6e -===N 2+6H 2O(2分) 减小(1分)(5) mol·L -1·min -1(2分) (2分) (6)ace(2分) 评分细那么 (1)按标准答案评分。
(2)不标“↑〞扣1分。
(3)少写条件或少写“↑〞均扣1分,把“〞写成“===〞不得分。
(4)写成最简形式不扣分。
(5)漏掉单位或写错扣1分,有效数字保存错不得分。
(6)对一个或两个得1分,有错不得分。
题型特点 无机推断题,集元素化合物知识、根本概念与根本理论知识于一体,考察面广,综合性强,思维容量大。
无机推断题层次清楚,区分度高。
由于此类题目具有较强的学科特色,考察知识点较多,是高考命题中一种重要的命题形式。
该题有四种命题类型:一是以阴、阳离子判断为中心的物质推断,二是以原子构造、元素周期律为中心的元素推断,三是以元素化合物知识为根底的无机框图推断,四是实验探究无机化合物成分类。
得分技巧 审题时要做到:迅速浏览全题―→找准突破口―→看准物质联系―→大胆假设认定―→全面进展分析―→最后验证确认。
答题时要细心:看准要求,标准书写。
类型一 以阴、阳离子判断为中心的物质推断1.(12分)饮水平安在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进展了分析,给出了如下实验信息:其中一处被污染的水源含有A 、B 两种物质,一处含有C 、D 两种物质,一处含有E 物质,A 、B 、C 、D 、E 是五种常见化合物,都是由下表中的离子形成: 阳离子K + Na + Cu 2+ Al 3+ 阴离子 SO 2-4 HCO -3 NO -3 OH -①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进展焰色反响,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中参加硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
高三化学无机推断试题答案及解析1.A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极;F常温下是气体,各物质有以下的转化关系(部分产物及条件略去)。
回答以下问题:(1)A的原子结构示意图为,M的化学式为。
(2)A与NaOH溶液反应的离子方程式为。
(3)写出②的化学方程式。
(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。
X的水溶液与NaHCO3溶液混合,反应的离子方程式为。
【答案】(1),FeS;(2)2Al + 2OH- + 6H2O=2[Al(OH)4]- + 3H2↑;(3)4NH3+5O24NO+6H2O;(4)Al3+ + 3HCO3-= Al(OH)3↓ + 3CO2↑。
【解析】根据题意知,A、J是日常生活中常见的两种金属,这两种金属和NaOH溶液组成原电池,A作负极,则A为铝;结合流程图知,C为偏铝酸钠,E为氢氧化铝,H为氧化铝,J为铁,M为硫化亚铁,D为氢气,F为氮气,G为氨气,I为一氧化氮,K为二氧化氮,L为硝酸。
(1)A为铝,原子结构示意图为,M为硫化亚铁,化学式为FeS;(2)铝与NaOH溶液反应生成四羟基合铝酸钠和氢气,离子方程式为2Al + 2OH- + 6H2O==2[Al(OH)4]- + 3H2↑;(3)反应②为氨的催化氧化,化学方程式4NH3+5O24NO+6H2O;(4)含A元素的某盐X常做净水剂,X做焰色反应时,透过蓝色钴玻璃观察火焰呈紫色。
X为明矾,其水溶液与NaHCO3溶液混合,反应的离子方程式为Al3+ + 3HCO3-="=" Al(OH)3↓ + 3CO2↑。
【考点】考查无机推断,涉及铝和氮元素单质及其化合物的性质及相互转化关系、化学方程式的书写。
2.A、B、C分别是元素甲、乙、丙的单质,它们都是常见的金属或非金属,D、E、F是常见的三种氧化物,且有如图所示转化关系,则下列说法不正确的是()A.D、E中一定都含有甲元素B.单质B肯定是氧化剂C.A、B、C中一定有一种是氧元素的单质D.若A是非金属,则B一定为金属【答案】B【解析】A是甲的单质,根据图示,E中必含甲元素,B是乙元素单质,与D反应生成A,该反应是置换反应,所以D中必含甲元素,A项正确;B项,D是氧化物,与B单质反应,一般B是还原剂,错误;C项,A与C单质反应生成氧化物E,所以必有一种是氧气,正确;D项,若A是非金属,则D与B的反应一般是类似于水与钠间的置换,即D项正确。
高三化学有机反应类型铁无机框图推断(O H)21.F e(O H)2制取F e(O H)2极易被氧化,溶解在水中的少量O2都能将它氧化成F e(O H)3,所以按一般方法很难得到F e(O H)2白色沉淀。
因此实验室中要解决的主要矛盾是防止Fe2+和F e(O H)2被氧化。
可采取的措施主要是:①采用新制备的纯亚铁盐溶液;②将溶解亚铁盐的蒸馏水煮沸除氧气;③在亚铁盐溶液表面加隔氧剂,如油或苯;④将碱直接加到亚铁盐溶液底部,使F e(O H)2生成于溶氧少的部位。
⑤通入不参加反应的气体排除空气,在此气氛中滴加强碱。
2.常见与铁或铜及其化合物的颜色相同或相近的物质红:Fe2O3F e(O H)3Fe(SCN)3Cu2O Cu NO2Br2(g)黄:Fe3+的溶液Na2O2S AgI AgBr Ag3PO4Cl2(黄绿)绿:Fe2+的溶液FeSO4·7 H2O C u2(O H)2C O3紫: ( Fe3+与苯酚作用的溶液) KMnO4I2黑:Fe3O4FeO FeS MnO2CuO Cu2S CuS白:F e(O H)2Fe(银白)Al(OH)3M g(O H)2BaCO3BaSO4 AgCl蓝:Cu2+的溶液CuSO4·5H2O3.常见物质的反应现象(1)火焰的颜色a.H2在Cl2中燃烧:苍白色 b.CO、H2、CH4在空气中燃烧:蓝色淡蓝色c.钠元素焰色反应:黄色(物理变化)d.钾元素焰色反应:浅紫色(透过蓝色钴玻璃,物理变化)(2有烟、雾或烟雾的现象a.空气中出现白雾:HCl、HBr、HI、NH3、HNO3b.空气中出现白烟:NH3与(HCl、HBr、HI、HNO3)c.燃烧出现白色烟雾..:P+Cl2d. 燃烧出现棕黄色烟: Cl2与(Cu 、Fe )(3)沉淀颜色变化Fe2+(含Fe2+的溶液)遇碱液,沉淀颜色转变:白色变灰绿色变红褐色..........(4)先有沉淀后沉淀消失a.CO2或SO2通入澄清石灰水中, b. H3PO4溶液滴入澄清石灰水中,c. 含Al3+的盐溶液中滴入强碱溶液,d. 含AlO2―的盐溶液中滴入强碱溶液.(5) 具有唯一性...的现象a. 溶于水显碱性且遇湿的红色石蕊试纸变蓝的气体唯有NH3b. 在空气中迅速由无色变为红棕色的气体唯有NOc. 在一定条件下能漂白有色物质的淡黄色固体唯有Na2O2d. 在空气中能自燃的固体唯有白磷e. 遇SCN-显红色的唯有Fe3+,遇OH―生成红褐色沉淀的唯有Fe3+f. 可溶于NaOH溶液的白色沉淀是Al(OH)3 ,可溶于NaOH溶液的金属氧化物是Al2O3。