盐类水解的原理
- 格式:ppt
- 大小:435.50 KB
- 文档页数:20


盐类的水解和沉淀溶解平衡一、盐类的水解原理及其应用(一)、盐类水解的定义和实质1、定义:盐电离产生的某一种或多种离子与水电离出来的H + 或OH - 生成弱电解质的反应。
2、盐类水解的实质:盐类的水解是盐跟水之间的化学反应,水解(反应)的实质是生成弱电解质使水的电离平衡被破坏而建立起新的平衡。
3、盐类水解的条件:(1)、盐必须溶于水中;(2)、盐中必须有弱酸根阴离子或弱碱阳离子。
4、盐类水解反应离子方程式的书写(1)、一般盐类水解程度很小,水解产物也很少,通常不生成沉淀或气体,书写水解方程式时,一般不用“↓”或“↑”,盐类水解是可逆反应,写可逆号。
(2)、多元弱酸根的正酸根离子的水解是分步进行的,其水解离子方程式要分步写。
(3)、双水解反应:弱酸根和弱碱阳离子相互促进水解,直至完全的反应。
如:Al3+ + 3 HCO3- = Al(OH)3↓+ 3 CO2↑注意:常见的能发生双水解反应的离子,Al3+与CO32-、HCO3-、S2-、HS-、AlO2-等;Fe3+与CO32-、HCO3-、AlO2-;NH4+与SiO32-等。
(二)、盐类水解平衡的影响因素1、内因:盐本身的性质(1)、弱碱越弱,其阳离子的水解程度就越大,溶液酸性越强。
(2)、弱酸越弱,其阴离子的水解程度就越大,溶液碱性越强。
即:有弱才水解,都弱都水解,越弱越水解,谁强显谁性。
2、外因(1)、温度:升高温度,水解平衡正向移动,水解程度增大。
(2)、浓度:①、增大盐溶液的浓度,水解平衡正向移动,水解程度减小,但水解产生的离子浓度增大;②、加水稀释,水解平衡正向移动,水解程度增大,但水解产生的离子浓度减小。
③、增大c(H + ),促进强碱弱酸盐的水解,抑制强酸弱碱盐的水解;增大c(OH-),促进强酸弱碱盐的水解,抑制强碱弱酸盐的水解。
(三)、盐类水解原理的应用1、判断盐溶液的酸碱性。
2、判断盐溶液中离子种类及其浓度大小关系。
3、判断溶液中离子能否大量共存时,有时要考虑水解,如Al3+、Fe3+ 与HCO3-、CO32-、AlO2- 等不能大量共存。
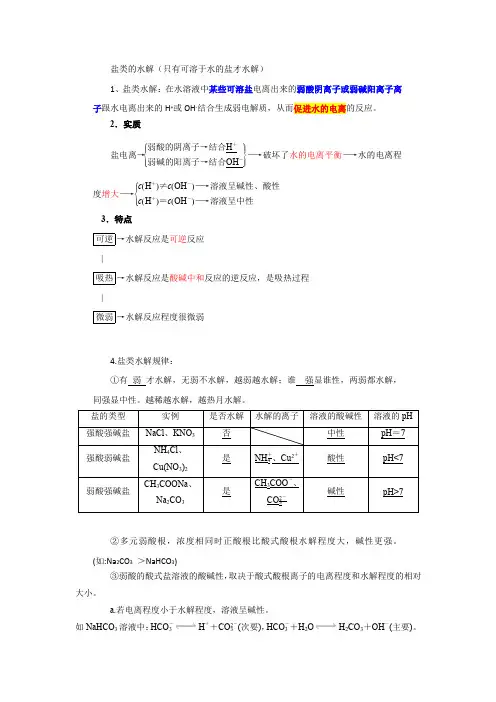
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。

《盐类的水解》讲义一、盐类水解的概念在溶液中,盐电离出来的离子跟水所电离出来的 H⁺或 OH⁻结合生成弱电解质的反应,叫做盐类的水解。
我们要知道,盐类水解的实质是破坏了水的电离平衡,促进了水的电离。
比如说,氯化铵(NH₄Cl)在水溶液中,NH₄⁺会和水电离出的OH⁻结合形成弱电解质一水合氨(NH₃·H₂O),使得溶液中 c(H⁺)> c(OH⁻),溶液呈酸性。
而碳酸钠(Na₂CO₃)在水溶液中,CO₃²⁻会和水电离出的 H⁺结合形成碳酸氢根离子(HCO₃⁻),使得溶液中 c(OH⁻)> c(H⁺),溶液呈碱性。
二、盐类水解的特点1、可逆性盐类的水解反应是可逆的,存在水解平衡。
以醋酸钠(CH₃COONa)为例,CH₃COO⁻与 H₂O 电离出的 H⁺结合生成 CH₃COOH,同时 CH₃COOH 也会电离出 CH₃COO⁻和H⁺,水解和电离是一个动态的平衡过程。
2、吸热性盐类的水解反应是吸热反应,升高温度会促进水解。
这是因为温度升高,水解平衡向正反应方向移动,水解程度增大。
3、微弱性盐类的水解程度一般都比较小。
例如,即使是碳酸钠这样的强碱弱酸盐,其水解产生的氢氧根离子浓度也相对较小,溶液的碱性并不是特别强。
三、盐类水解的规律1、有弱才水解只有含有弱酸阴离子或弱碱阳离子的盐才会发生水解。
比如氯化钠(NaCl),钠离子和氯离子对应的酸和碱都是强酸强碱,所以不会水解。
而醋酸铵(CH₃COONH₄),其中的醋酸根离子和铵根离子分别对应的醋酸和一水合氨是弱酸和弱碱,所以会发生水解。
2、谁弱谁水解盐中的阴离子对应的酸越弱,水解程度越大;阳离子对应的碱越弱,水解程度越大。
例如,相同浓度的碳酸钠(Na₂CO₃)和碳酸氢钠(NaHCO₃)溶液,由于碳酸的酸性弱于碳酸氢根的酸性,所以碳酸钠的水解程度大于碳酸氢钠。
3、谁强显谁性当盐中的阳离子对应的碱是强碱,阴离子对应的酸是弱酸时,溶液显碱性;反之,溶液显酸性。


诚西郊市崇武区沿街学校34盐类的水解一、盐类水解的原理(弱电解质离子破坏水的电离)1、水解本质〔本质〕:破坏水的电离平衡、促进水的水电离盐类水解的本质是盐溶液中盐电离出来的弱酸根离子或者者弱碱根离子与水分子电离出的H+或者者OH―结合成弱电解质,从而破坏了水的电离平衡,并使水的电离平衡正向挪动,最后使得溶液中c(H+)(或者者c(OH―))大于c(OH―)(或者者c(H+))而使溶液呈酸性〔或者者碱性〕。
如:NH4Cl :NH4++H2O NH3·H2O+H+〔显酸性〕CH3COONa :CH3COO ―+H2OCH3COOH+OH―〔显碱性〕 2、条件:盐必须可溶;必须有弱电解质的离子;〔有弱才水解〕3、影响因素:内因是盐本身的性质〔越弱越水解〕①升高温度有利于水解反响,盐类的水解反响是吸热反响,所以。
②浓度越稀,水解程度越大,但水解产生的酸碱性比浓溶液弱。
③溶液中有酸或者者碱对盐水解有较强的影响,一样抑制,不同促进。
例如:不同条件对FeCl3水解平衡的影响Fe3++3H2OFe(OH)3+3H+-Q 4、水解规律〔谁强显谁性〕盐的类型 实例 水解? 什么离子水解 溶液的pH 强酸强碱盐 NaCl 、KNO3、BaCl2 不水解 pH=7 强酸弱碱盐 NH4Cl 、FeCl3、CuSO4 水解 NH4+、Cu2+、Fe3+阳离子 pH<7强碱弱酸盐 Na2S 、Na2CO3、NaHCO3 水解 S2―、CO32―、HCO3―阴离子pH>7阳离子:一价:NH4+、Ag+二价:Fe2+、Cu2+、Zn2+三价:Fe3+、Al3+……阴离子:一价:CH3COO —、HS―、AlO2—、ClO —、F —、HCO3—二价:SiO32—、HPO42—、CO32—、S2—三价:PO43—……5、双水解:一般来说,酸性盐〔不是酸式盐〕与碱性盐混合时,应从双水解考虑:〔1〕两种水解情况相反的盐溶液混合后,按图所示连线间的反响进展双水解,且反响进展到底。


考点1| 盐类的水解原理1.盐类的水解及其实质(1)定义在溶液中盐电离出来的离子跟产生的H+或OH-结合生成的反应。
(2)实质―→c(H+)≠c(OH-)―→溶液不再呈中性。
(3)实例分析:以NH4Cl的水解为例H2O OH-+H++NH4Cl===NH+4+Cl-c(H+)>c(OH-),溶液呈性。
2.盐类的水解特点与规律(1)特点(2)盐类水解的类型及规律②规律:有弱才水解,越弱越水解;谁强显谁性,同强显中性。
提醒:弱酸、弱碱盐的性质决定于酸、碱的相对强弱,水解性质仍显较强的性质,如NH4ClO显碱性,CH3COONH4显中性。
(3)水解常数(K h)以CH3COO-+H2O CH3COOH+OH-为例:表达式为c(CH3COOH)·c(OH-)c(CH3COO-)=K h=K WK a。
3.水解离子方程式的书写(1)书写形式(2)书写规律(3)多元弱碱阳离子的水解方程式一步写完,如FeCl3的水解离子方程式:提醒:水解分别是酸性和碱性的离子组由于相互促进水解程度较大生成气体或沉淀的,书写时要用“===”“↑”“↓”,但水解不生成气体或沉淀,水解不完全,书写仍用“”。
如2Al3++3CO2-3+3H2O===2Al(OH)3↓+3CO2↑;CH3COO-+NH+4+H2O CH3COOH+NH3·H2O。
[应用体验]正误判断(正确的打“√”,错误的打“×”)。
(1)盐类水解的实质是促进水电离,水电离平衡右移。
()(2)能水解的盐溶液一定呈酸性或碱性,不可能呈中性。
()(3)Na2CO3溶液显碱性的原因:CO2-3+2H2O H2CO3+2OH-。
()(4)25 ℃,pH=11的Na2CO3溶液与pH=11的NaOH溶液中水的电离程度相同,均为1×10-11 mol/L。
()(5)AlCl3溶液显酸性的原因是:Al3++3H2O Al(OH)3+3H+。

第30讲盐类水解目录考情分析网络构建考点一盐类水解原理【夯基·必备基础知识梳理】知识点1 盐类水解知识点2 盐类水解规律知识点3 盐类水解方程式的书写【提升·必考题型归纳】考向1 考查盐类的水解及溶液的酸碱性考向2 考查盐类水解规律及应用考点二盐类水解的影响因素及应用【夯基·必备基础知识梳理】知识点1 影响盐类水解的因素知识点2 盐类水解的应用知识点3 水解常数及应用【提升·必考题型归纳】考向1 考查盐类水解的影响因素考向2 考查盐类水解的应用考向3 考查水解常数的应用与计算考点三水溶液中粒子的数量关系【夯基·必备基础知识梳理】知识点1 电解质溶液中的三大守恒知识点2 电解质溶液中粒子浓度大小比较知识点3 水溶液中函数图像分析【提升·必考题型归纳】考向1 考查单一溶液中粒子浓度大小比较考向2 考查混合溶液中粒子浓度大小比较真题感悟考点一 盐类水解原理知识点1 盐类水解1.定义:在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.条件:可溶性盐必须有弱酸根离子或弱碱阳离子 3.实质:盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
4.特点(1)可逆:水解反应是可逆反应;(2)吸热:水解反应是酸碱中和反应的逆反应; (3)微弱:水解反应程度很微弱。
知识点2 盐类水解规律1. 盐的分类与盐溶液的酸碱性“有弱才水解、无弱不水解、越弱越水解、都弱都水解、越热越水解、越稀越水解、谁强显谁性、同强是中性”。
知识点3 盐类水解方程式的书写1.一般要求水解记三点:①水写分子式,②中间用可逆(),③后无沉气出。
即盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。

【盐类的水解知识大复习】一、探究盐溶液的酸碱性结论:强酸弱碱盐显酸性,强碱弱酸盐显碱性,强酸强碱盐显中性。
二、盐溶液呈现不同酸碱性的原因三、盐的水解原理1.泄义:在溶液中,盐电离出来的阴离子或阳离子与水所电离出来的H+或0H结合生成弱电解质,这种作用叫做盐类的水解。
2.实质及结果实质:促进水的电离平衡。
结果:盐的溶液呈现出不同程度的酸、碱性。
3.水解条件a.盐必须溶于水中b.生成盐的酸或碱是弱酸或弱碱(有弱才水解,无弱不水解,都弱双水解)4.水解特征水解是微弱、可逆的,用可逆符号“=”【小结】水解规律:有弱才水解,无弱不水解,都弱双水解,谁强显谁性,都强显中性5盐溶液中水的电离规律【例题】1、pH=3的HC1和pH=ll的NaOH溶液中由水电离出来的c(H+)*2、pH=3的NHQ 和pH=ll的CH3COONa溶液中由水电离出来的c(H+)水【小结】盐溶液中水的电离有如下规律:a.在强酸弱碱盐溶液中,盐的水解促进了水的电离,水的电离程度比纯水、酸或碱溶液(抑制水的电离)中水的电离程度大。
b.在酸或碱溶液中,c(HJ、c(OH)中小的那一个表示水的电离:在盐溶液中,c(H+)、c(OH) 中大的那一个反映了水的电离程度。
四、水解方程式的书写(1)判断能否水解;(2)水解是微弱的,用可逆符号表示。
通常不生成沉淀或气体,也不发生分解。
在书写离子方程式时一般不标“丨"或“ f ",也不把生成物(如H2CO3、NH)・FhO等)写成其分解产物的形式:(3)多元弱酸的盐分步水解,以第一步为主。
(4)多元弱碱盐的水解视为一步完成。
(5)双水解一一不完全双水解与完全双水解不完全水解用可逆符号,完全水解用等号表示。
五、盐类水解的影响因素1•内因——越弱越水解〔越热越水解,越稀越水解)以醋酸钠为例:CH3COO+H2O CHsCOOH+OH- K hK _ c(CH.COOH) c(OH ) _ c(CH.COOH) ・c(OH) • c(H ) »c(CH,COO ) c(CHCOO ) c(H )KA弱酸或弱碱的电离常数越(越弱),其所生成的盐水解的程度就越大。

第1篇一、实验目的1. 了解盐类水解的概念和现象。
2. 掌握盐类水解的实验方法,学会利用pH试纸、pH计和酸碱指示剂检测溶液的酸碱性。
3. 理解盐类水解对溶液酸碱性的影响,并能根据实验结果分析盐类水解的规律。
二、实验原理盐类水解是指盐的离子与水分子反应,生成弱电解质的过程。
盐类水解的实质是盐中的离子与水分子反应,使水的电离平衡发生移动,产生氢离子或氢氧根离子,从而使溶液呈现酸性或碱性。
盐类水解的程度与盐中离子的性质有关。
一般来说,强碱弱酸盐的水解程度较大,溶液呈碱性;强酸弱碱盐的水解程度较大,溶液呈酸性;强酸强碱盐的水解程度较小,溶液呈中性。
三、实验仪器与试剂1. 仪器:烧杯、玻璃棒、pH试纸、pH计、酸碱指示剂、滴定管、电子天平、滤纸等。
2. 试剂:NaCl、NaOH、HCl、CH3COONa、NH4Cl、Na2CO3、KCl等。
四、实验步骤1. 配制溶液:分别配制NaCl、NaOH、HCl、CH3COONa、NH4Cl、Na2CO3、KCl等溶液。
2. 检测溶液酸碱性:利用pH试纸、pH计和酸碱指示剂检测上述溶液的酸碱性。
3. 观察并记录现象:观察溶液的颜色变化、沉淀生成等现象,并记录实验结果。
五、实验结果与分析1. NaCl溶液:呈中性,pH约为7。
2. NaOH溶液:呈碱性,pH约为13。
3. HCl溶液:呈酸性,pH约为1。
4. CH3COONa溶液:呈碱性,pH约为9。
5. NH4Cl溶液:呈酸性,pH约为5。
6. Na2CO3溶液:呈碱性,pH约为11。
7. KCl溶液:呈中性,pH约为7。
根据实验结果,我们可以得出以下结论:1. 强碱弱酸盐的水解程度较大,溶液呈碱性;强酸弱碱盐的水解程度较大,溶液呈酸性;强酸强碱盐的水解程度较小,溶液呈中性。
2. 盐类水解对溶液酸碱性有显著影响,可根据溶液的酸碱性判断盐类水解的程度。
3. 盐类水解的规律为:有弱才水解,无弱不水解;越弱越水解,都弱双水解;谁强显谁性,同强显中性。
(完整版)盐类的水解知识点总结水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但普通以为中和反应程度大,大多以为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱别水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐别一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(非常特别,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)妨碍水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度别变,浓度越小,水解程度越大.(2)浓度别变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的妨碍.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度考虑:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分不加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何妨碍?(五)盐类水解原理的应用考点 1.推断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分不为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。
高中化学频道:《盐类的水解》知识点详解(一)盐类水解实质(从水的电离平衡下手)盐溶于水电离出的某种离子,与水电离的氢离子或氢氧根离子结合生成弱电解质,使水的电离平衡发生移动。
(二)盐类水解规律口诀:无弱不水解,有弱才水解,越弱越水解,双弱双水解,谁强显谁性.解释:(1)弱碱强酸盐的水解在溶液中,存在的电离和水的电离电离出来的可以跟水电离出来的结合成弱电解质,使下降,水的电离平衡向正向移动,从而造成溶液中的溶液呈现酸性。
(2)弱酸强碱盐的水解在溶液中的弱酸根阴离子,与电离出来的结合成弱电解质分子,使的电离平衡向正向移动,不断增大,直至建立起新的平衡,溶液呈现碱性。
规律:(1)弱碱强酸盐可溶性的弱碱强酸盐,如、、等能发生水解反应,水解后溶液呈现酸性。
(2)弱酸强碱盐可溶性的弱酸强碱盐,如、、、等能发生水解反应,水解后溶液呈现碱性。
(3)弱酸弱碱盐可溶性的弱酸弱碱盐,如、、等很容易发生水解反应,水解后溶液的酸碱性取决于该盐水解生成的弱酸、弱碱的相对强弱。
(4)强酸强碱盐各种强酸强碱盐均不能发生水解反应,溶液仍为中性。
(三)正确书写盐类水解的例子方程式盐类水解属于离子反应,可以按照离子方程式的书写规范,写出正确的离子方程式。
例如,硫酸铜水解的离子方程式可按以下三个步骤写出:第一步写出水解的化学方程式第二步把易溶于水的强电解质改写为离子形式第三步消去反应式两边相同的离子()上述这个盐类水解的离子方程式揭示了水解的实质,是使水的电离平衡破坏,生成弱碱分子和,使溶液呈现酸性,比盐类水解的化学方程式有更大的优越性。
书写盐类水解的离子方程式时,要注意以下三点:(1)要写可逆号“”,不能写等号。
(2)难溶化合物不写沉淀符号“↓”。
(3)气体物质不写气体符号“↑”。
怎样才能又迅速、又准确地书写盐类水解的离子方程式呢?(1)弱碱强酸盐水解的离子方程式是弱碱阳离子的水解,弱碱阳离子所带电荷数,就是水分子的系数,也是氢离子的系数。
第三节盐类的水解上大附中何小龙一、盐类水解1、定义:在水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合生成弱电解质的反应。
2、实质:水溶液中盐电离出来的离子跟水电离出来的H+或OH-结合,破坏水的电离,是平衡向右移动,促进水的电离3、盐类水解的规律:①有弱才水解,无弱不水解,越弱越水解;谁强显谁性,两弱都水解,同强显中性。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na2CO3 >NaHCO3)3、影响盐类水解的外界因素:①温度:温度越高水解程度越大(水解吸热,越热越水解)②②浓度:浓度越小,水解程度越大(越稀越水解)③酸碱:促进或抑制盐的水解(H+促进阴离子水解而抑制阳离子水解促进阳离子水解而抑制阴离子水解)4、水解平衡常数○1对于强碱弱酸盐: =/ (为该温度下水的离子积,为该条件下该弱酸根形成的弱酸的电离平衡常数)○2对于强酸弱碱盐: =/(为该温度下水的离子积,为该条件下该弱碱根形成的弱碱的电离平衡常数)5、双水解反应(1)构成盐的阴阳离子均能发生水解的反应。
双水解反应相互促进,水解程度较大,有的甚至水解完全。
使得平衡向右移。
(2)双水解反应特点是相互水解成沉淀或气体。
双水解完全的离子方程式配平依据是两边电荷平衡。
【习题一】(2018春•宾阳县校级月考)下列水解方程式正确的是()A.B.C.D.【考点】盐类水解的原理.【专题】盐类的水解专题.【分析】水解反应的实质是:弱酸或弱碱离子结合水电离出的氢离子或氢氧根离子生成弱电解质的过程,水解反应方程式用可逆符号表示,以此分析得出正确结论.【解答】解:A、水解是非常微弱的,水解方程式应该用“⇌”,且不能使用沉淀符号,故A错误;B、溴离子是强酸酸根离子不发生水解,故B错误;C、CH3COOH+H2O⇌CH3COO-+H3O+,是醋酸的电离方程式,不是水解离子方程式,故C错误;D、水解是非常微弱的,水解方程式应该用“⇌”,铵根离子水解生成一水合氨和氢离子,书写氢离子为水和氢离子得到离子方程式为NH4++2H2O⇌NH3•H2O+H3O+,故D正确。
盐类水解原理
盐类水解是指盐在水中发生化学反应,产生酸性或碱性物质的过程。
盐类水解反应是一种离子反应,其中水分子作为酸或碱与盐离子发生反应。
不同的盐有不同的水解反应。
例如,氯化钠(NaCl)在水中水解成钠离子(Na+)和氯离子(Cl-)。
在这个反应中,水分子将与氯离子结合,形成盐酸(HCl):
Cl- + H2O → HCl + OH-
反应中形成的氢氧根离子(OH-)使溶液呈碱性。
类似地,一些盐如氯化铵(NH4Cl)也会发生水解反应。
在这个反应中,水分子与铵离子(NH4+)结合形成氨(NH3)和盐酸(HCl):
NH4+ + H2O → NH3 + HCl
反应中形成的氨使溶液呈碱性。
还有其他一些盐类的水解反应也是常见的,例如硝酸铵
(NH4NO3)的水解反应:
NH4NO3 + H2O → NH4OH + HNO3
在这个反应中,硝酸铵水解生成氨水和硝酸,氨水使溶液呈碱性。
盐类水解反应的结果有时会对溶液的酸碱性产生重要影响。
此
外,盐类水解也可以用于制备一些化学试剂,如氢氧化钠(NaOH)。
盐类的水解课标解读要点网络1.了解盐类水解的原理。
2.了解影响盐类水解的主要因素。
3.了解盐类水解的应用。
4.能正确书写盐类水解的化学或离子方程式。
盐类的水解原理及规律1.盐类的水解原理 (1)定义在溶液中由盐电离产生的离子与水电离产生的H +或OH -结合生成弱电解质的反应。
(2)实质―→[H +]≠[OH -]―→溶液不再呈中性。
(3)特点可逆→水解反应是可逆反应吸热→水解反应是酸碱中和反应的逆反应,ΔH >0 微弱→水解反应程度很微弱 (4)水解常数(K h ) A -+H 2OHA +OH -的水解常数表达式K h =[HA][OH -][A -]=[HA][OH -][H +][A -][H +]=K WK a,若25 ℃,HA 的K a 为1×10-6 mol·L -1则A -的水解常数K h 为1×10-8mol·L -1。
2.盐类的水解规律(1)类型盐的类型实例是否水解水解的离子溶液的酸碱性溶液的pH强酸强碱盐NaCl、KNO3否—中性=7强酸弱碱盐NH4Cl、Cu(NO3)2是NH+4、Cu2+酸性<7弱酸强碱盐CH3COONa、Na2CO3是CH3COO-、CO2-3碱性>7(2)一般规律有弱才水解,无弱不水解;越弱越水解,谁强显谁性;同强显中性,同弱不确定。
注意:这里说的“弱”指的是弱酸根离子或弱碱阳离子。
3.水解离子方程式的书写(1)书写形式在书写盐类水解方程式时一般要用“”号连接,产物不标“↑”或“↓”,用离子方程式表示为盐中的弱离子+水弱酸(或弱碱)+OH-(或H+)。
(2)书写规律①一般盐类水解程度很小,水解产物很少,如果产物易分解(如NH3·H2O、H2CO3)也不写成其分解产物的形式。
②多元弱酸盐的水解分步进行,以第一步为主,一般只写第一步水解的离子方程式,如Na2CO3的水解离子方程式:CO2-3+H2O HCO-3+OH-。