知识讲解_盐类水解的原理及水解平衡的移动(提高)
- 格式:doc
- 大小:125.22 KB
- 文档页数:6


水解平衡的移动1 盐类的水解平衡在一定条件(温度、浓度)下盐类的水解在水溶液中建立的化学平衡叫作盐类的水解平衡。
教材深挖水解平衡常数1.定义:水解反应的平衡常数叫作水解平衡常数或水解常数,用K h 表示。
以CH 3COONa 的水解为例:K h =。
1.K h 和K a 、K W 的关系:K h = 同理,可推出强酸弱碱盐的水解常数K h 和K b 、K W 的关系为K h =。
3.意义:K h 表示水解反应趋势的大小,K h 越大,水解趋势越大。
4.水解反应是吸热反应,K h 受温度影响,温度升高,K h 增大。
2 水解平衡的移动教材P103 活动·探究 影响盐类水解平衡的因素 (1)温度对盐类水解平衡的影响(2)讨论影响CH 3COONa 溶液和NH 4Cl 溶液中的水解平衡的因素()()()33CH COOH OH CH COOc c c --⋅平平平()()()()()()()()33Wa33CH COOH OH CH COOH OH H CH COO CH COO H c c c c c K K c c c --+--+⋅⋅⋅⋅平平平平平平平平==WbK K名师提醒应用Q 与K h 的关系判断水解平衡的移动方向水解平衡与其他化学平衡一样,可以应用Q 与K h 的相对大小来判断水解平衡的移动方向。
以NH 4Cl 溶液为例(NH + 4+H 2O NH 3·H 2O +H +),达到水解平衡时K h =Q =。
1.加入NH 4Cl ,使NH 4Cl 溶液的浓度加倍,c (NH + 4)增大,Q 减小,Q <K h ,水解平衡正向移动。
2.加水,使NH 4Cl 溶液的浓度变为原来的一半,Q =,即Q <K h ,则水解平衡正向移动。
3.向NH 4Cl 溶液中加入少量浓盐酸,c (H +)增大,Q 增大,Q >K h ,水解平衡逆向移动。
(3)影响盐类水解平衡的因素()()()324NH H O H NHc c c ++⋅⋅平平平()()()32h 411NH H O H 12212NH 2c c K c ++⋅⋅平平平=在一定条件下,Na 2CO 3溶液中存在水解平衡:CO 2- 3+H 2O HCO - 3+OH -。
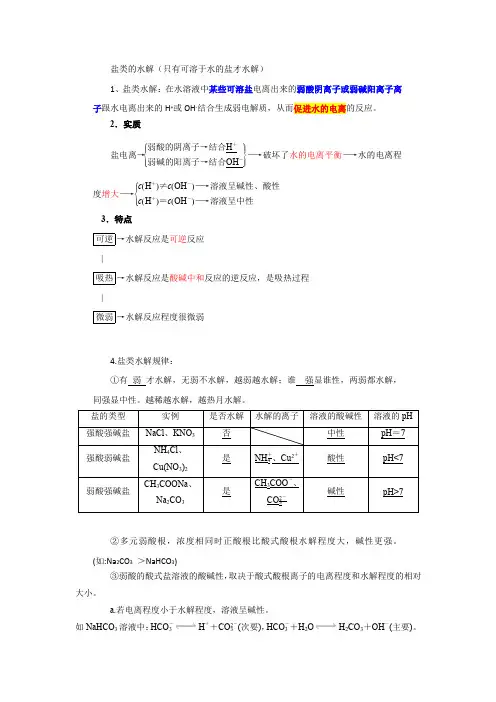
盐类的水解(只有可溶于水的盐才水解)1、盐类水解:在水溶液中某些可溶盐电离出来的弱酸阴离子或弱碱阳离子离子跟水电离出来的H +或OH -结合生成弱电解质,从而促进水的电离的反应。
2.实质盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -―→破坏了水的电离平衡―→水的电离程度增大―→⎩⎪⎨⎪⎧c (H +)≠c (OH -)―→溶液呈碱性、酸性c (H +)=c (OH -)―→溶液呈中性 3.特点可逆→水解反应是可逆反应 |吸热→水解反应是酸碱中和反应的逆反应,是吸热过程 |微弱→水解反应程度很微弱4.盐类水解规律:①有 弱 才水解,无弱不水解,越弱越水解;谁 强显谁性,两弱都水解,同强显中性。
越稀越水解,越热月水解。
②多元弱酸根,浓度相同时正酸根比酸式酸根水解程度大,碱性更强。
(如:Na 2CO 3 >NaHCO 3)③弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。
a.若电离程度小于水解程度,溶液呈碱性。
如NaHCO 3溶液中:HCO -3H ++CO 2-3(次要),HCO -3+H 2O H 2CO 3+OH -(主要)。
b.若电离程度大于水解程度,溶液显酸性。
如NaHSO3溶液中:HSO-3H++SO2-3(主要),HSO-3+H2O H2SO3+OH-(次要)。
(目前必须知道HC2O4-、HSO-3、HPO32—和H2PO4—的电离大于水解)5.表示方法——水解的离子方程式(1)一般盐类水解程度很小,水解产物很少,在书写盐类水解方程式时要用“”号连接。
盐类水解一般不会产生沉淀和气体,所以不用“↓”或“↑”表示水解产物(双水解例外)。
不把产物(如NH3·H2O、H2CO3)写成其分解产物的形式。
如:Cu(NO3)水解的离子方程式为Cu2++2H2O Cu(OH)2+2H+。
NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。


高考总复习《盐类的水解》的解题指导(提高)【考纲要求】1.巩固理解盐类水解的主干知识。
2.认识盐类水解在生产、生活中的应用,理解盐溶液蒸干后所得产物的判断。
3.根据平衡理论知识处理盐类水解的相关问题。
【要点梳理】盐类水解的应用1.根据水解规律判断溶液的酸碱性如NH4Cl溶液显酸性,CH3COONa溶液显碱性等。
2.判断盐溶液中离子的种类及浓度的大小如Na2CO3溶液中存在的微粒有:Na+、CO32―、HCO3―、H2CO3、OH―、H+、H2O,且c (Na+)>2c (CO32―),c (OH―)>c (H+)。
3.配制易水解盐溶液时,要注意抑制水解如配制FeCl3、AlCl3溶液时滴加几滴稀盐酸,配制Na2CO3溶液时滴加几滴NaOH溶液。
配制FeCl2溶液时除滴加几滴稀盐酸抑制Fe2+水解外,还需加铁屑防止Fe2+被氧化。
4.实验室贮存试剂时,要考虑盐的水解如Na2CO3、NaHCO3溶液显碱性,而不能用带玻璃塞的试剂瓶贮存。
要点诠释:盐溶液蒸干时所得产物的判断方法(1)盐溶液水解生成易挥发性酸时,蒸干后一般得对应的弱碱,如AlCl3溶液蒸干后得Al(OH)3。
因为AlCl3溶液中Al3+水解吸热:AlCl3+3H2O Al(OH)3(胶体)+3HCl,加热蒸干HCl挥发,水解平衡右移,得到固体Al(OH)3,再灼烧后Al(OH)3受热分解变成Al2O3。
NaHCO3溶液低温蒸干后可得NaHCO3固体,再灼烧NaHCO3固体后分解变成Na2CO3。
注意:“蒸干”与“蒸干灼烧”的区别,如AlCl3溶液蒸干得Al(OH)3,若为“蒸干灼烧”得Al2O3。
(2)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4溶液蒸干得CuSO4固体。
(3)考虑盐受热时是否分解。
因为Ca(HCO3)2、NaHCO3、KMnO4、NH4Cl固体受热易分解,因此蒸干Ca(HCO3)2溶液得CaCO3固体;蒸干NaHCO3溶液得Na2CO3固体;蒸干KMnO4溶液得K2MnO4和MnO2的混合物;蒸干NH4Cl溶液不能得到固体。

第三节盐类的水解考纲解读考纲内容要求名师解读盐类水解的原理、影响盐类水解程度的主要因素Ⅱ盐类水解知识在高考中的重现率是100%,高考试题对本节的考查以接受、吸收、整合化学信息的能力主,试题难度中等偏上。
热点观测:溶液中离子浓度大小比较既与盐类的水解有关,又与弱电解的电离平衡有关,还注重溶液中的各种守恒,是高考的必考点。
盐类水解的应用Ⅱ基础巩固一、盐类水解的原理1.定义在溶液中盐电离出来的离子跟____________________结合生成_________的反应。
2.实质盐电离→→破坏了_________→水的电离程度______→c(H+)≠c(OH—)→溶液呈碱性或酸性。
3.特点(1)可逆:水解反应绝大多数是反应。
(2)吸热:水解反应是反应的逆反应。
(3)微弱:水解反应程度一般很微弱。
4.盐类水解离子方程式的书写一般情况下盐类水解程度较小,应用表示,水解反应生成的难溶物或挥发性物质。
例如,Al3++3H2O 、HCO3—+H2O多元弱酸根离子分步水解,要分步书写,以第一步为主:如,S2—+H2O ,。
多元弱碱的阳离子水解,习惯一步书写:如Mg2++2H2O ,Fe3++3H2O二、影响盐类水解的因素1.内因:盐本身性质,组成盐的酸根相对应的酸越弱(或阳离子对应的碱越弱),水解程度。
如,同浓度的CO32—水解能力SO32—。
2.外因:受的影响。
(1)温度:盐类水解是吸热反应,因此,升温促进水解;(2)浓度:盐的溶液浓度越小,水解程度越大,这里盐的浓度指水解离子,而不含不水解的离子。
如,氯化铁溶液,Cl—并不影响水解平衡。
(3)外加酸碱:外加酸碱能促进或抑制盐的水解。
下面分析不同条件对氯化铁水解平衡的影响情况如表Fe3++3H2O Fe(OH)3+3H+(正反应为吸热反应)条件移动方向H+数pH Fe3+水解程度现象升温_____________________通氯化氢_____________________加水_____________________加镁粉________________________________________________________________________加NaHCO3(3)条件移动方向H+数pH Fe3+水解程度现象升温向右增降增大变深通氯化氢向左增降减小变浅加水向右增升增大变浅加镁粉向右减升增大红褐色沉淀,无色气体向右减升增大红褐色沉淀,无色气体加NaHCO3实验探究拓展实验:茶水——墨水——茶【原理】因为茶水里含有大量的单宁酸,当单宁酸遇到绿矾里的亚铁离子会立刻生成单宁酸亚铁,它的性质不稳定,很快被氧化生成单宁酸铁的络合物而呈蓝黑色,从而使茶水变成了“墨水”。

第30讲盐类水解目录考情分析网络构建考点一盐类水解原理【夯基·必备基础知识梳理】知识点1 盐类水解知识点2 盐类水解规律知识点3 盐类水解方程式的书写【提升·必考题型归纳】考向1 考查盐类的水解及溶液的酸碱性考向2 考查盐类水解规律及应用考点二盐类水解的影响因素及应用【夯基·必备基础知识梳理】知识点1 影响盐类水解的因素知识点2 盐类水解的应用知识点3 水解常数及应用【提升·必考题型归纳】考向1 考查盐类水解的影响因素考向2 考查盐类水解的应用考向3 考查水解常数的应用与计算考点三水溶液中粒子的数量关系【夯基·必备基础知识梳理】知识点1 电解质溶液中的三大守恒知识点2 电解质溶液中粒子浓度大小比较知识点3 水溶液中函数图像分析【提升·必考题型归纳】考向1 考查单一溶液中粒子浓度大小比较考向2 考查混合溶液中粒子浓度大小比较真题感悟考点一 盐类水解原理知识点1 盐类水解1.定义:在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.条件:可溶性盐必须有弱酸根离子或弱碱阳离子 3.实质:盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
4.特点(1)可逆:水解反应是可逆反应;(2)吸热:水解反应是酸碱中和反应的逆反应; (3)微弱:水解反应程度很微弱。
知识点2 盐类水解规律1. 盐的分类与盐溶液的酸碱性“有弱才水解、无弱不水解、越弱越水解、都弱都水解、越热越水解、越稀越水解、谁强显谁性、同强是中性”。
知识点3 盐类水解方程式的书写1.一般要求水解记三点:①水写分子式,②中间用可逆(),③后无沉气出。
即盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。

高考总复习 《盐类的水解》的核心知识(提高)【考纲要求】1.理解盐类水解的原理。
2.了解影响盐类水解的主要因素。
3.认识盐类水解在生产、生活中的应用。
4.解盐溶液蒸干后所得产物的判断。
【考点梳理】要点一、盐类水的定义和实质 【363384盐类的水解原理】1、定义:在溶液中盐的离子跟水所电离出来的H +或OH -生成弱电解质的过程,叫做盐类的水解。
2、实质:在溶液中盐电离产生的弱酸根离子或弱碱阳离子与水电离产生的H +或OH ―结合生成弱电解质,从而破坏了水的电离平衡,从而促进水的电离平衡的过程。
大多数盐的水解使得溶液中氢离子浓度和氢氧根离子浓度不相等,从而使溶液显示出不同程度的酸碱性。
3、规律:概括为“有弱才水解,越弱越水解,都弱双水解,谁强显谁性”。
要点诠释:即盐的组成中出现弱碱阳离子或弱酸根阴离子,该盐就会水解;这些离子对应的碱或酸越弱,水解程度越大,溶液的pH 变化越大;水解后溶液的酸碱性由构成该盐离子对应的酸和碱相对强弱决定,酸强显酸性,碱强显碱性。
盐类水解可以看成是中和反应的逆反应:盐+水垐垐?噲?水解中和酸+碱4、盐类水解离子方程式的书写(1)一般盐类水解程度很小,水解产物也很少,在书写盐类水解方程式时要写“ ”,产物不标“↑”或“↓”,不把生成物(如NH 3·H 2O 、H 2CO 3等)写成其分解产物的形式。
⑵多元弱酸盐的水解是分步进行的,第一步较易发生,水解时以第一步为主,可用多步水解方程式表示。
如Na 2CO 3溶液的水解可表示为:CO 32-+H 2OHCO 3-+OH -、HCO3-+H2O H2CO3+OH-,不能写成:CO32-+2H2O H2CO3+2OH-。
⑶多元弱碱盐水解也是分步进行的,而高中现阶段不要求分步写,一步完成。
例如:FeCl3水解可写为:Fe3++ 3H2O Fe(OH)3+3H+。
CuSO4水解:Cu2++2H2O Cu(OH)2+2H+(4)能彻底水解的离子组,如NaAlO3溶液与AlCl3溶液混合:3AlO3―+Al3++6H2O==4Al(OH)3↓。


(完整版)盐类的水解知识点总结水解中和盐类的水解1.复习重点1.盐类的水解原理及其应用2.溶液中微粒间的相互关系及守恒原理2.难点聚焦(一)盐的水解实质H2O H+—n当盐AB能电离出弱酸阴离子(B n—)或弱碱阳离子(A n+),即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离.与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但普通以为中和反应程度大,大多以为是彻底以应,但盐类的水解程度小得多,故为万逆反应,真正发生水解的离子仅占极小比例。
(二)水解规律简述为:有弱才水解,无弱别水解越弱越水解,弱弱都水解谁强显谁性,等强显中性具体为: 1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐别一定如 NH4CN CH3CO2NH4 NH4F碱性中性酸性取决于弱酸弱碱相对强弱2.酸式盐①若惟独电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4 H2PO4— HPO42— PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(非常特别,电离大于水解):NaHSO3、NaH2PO4、NaHSO4(三)妨碍水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度别变,浓度越小,水解程度越大.(2)浓度别变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
(四)比较外因对弱电解质电离和盐水解的妨碍.HA H++A——Q A—+H2O HA+OH——Q温度(T)T↑→α↑ T↑→h↑加水平衡正移,α↑促进水解,h↑增大[H+] 抑制电离,α↑促进水解,h↑增大[OH—]促进电离,α↑抑制水解,h↑增大[A—] 抑制电离,α↑水解程度,h↑注:α—电离程度 h—水解程度考虑:①弱酸的电离和弱酸根离子的水解互为可逆吗?②在CH3COOH和CH3COONO2的溶液中分不加入少量冰醋酸,对CH3COOH电离程度和CH3COO—水解程度各有何妨碍?(五)盐类水解原理的应用考点 1.推断或解释盐溶液的酸碱性例如:①正盐KX、KY、KZ的溶液物质的量浓度相同,其pH值分不为7、8、9,则HX、HY、HZ的酸性强弱的顺序是________________②相同条件下,测得①NaHCO3②CH3COONa ③NaAlO2三种溶液的pH值相同。

盐类水解的原理及水解平衡的移动编稿:宋杰审稿:张灿丽【学习目标】1、认识盐类的组成与盐溶液酸碱性的关系,从而理解盐类水解的原理;2、以水的电离平衡为基础,认真分析盐类电离出的阴、阳离子与水电离出的H+或OH-结合生成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质;3、掌握盐类水解的离子方程式与化学方程式的书写;4、认识内因对盐类水解程度的影响;5、掌握外因对盐类水解程度的具体影响。
【要点梳理】要点一、盐类水解的实质1.定义【高清课堂:探究盐溶液的酸碱性#盐类的水解】⑴以CH3COONa为例探究盐类的水解CH3COONa溶于水之后,完全电离————强电解质CH3COONa ═ CH3COO- + Na+………①————(电离出的离子既没有H+,也没有OH-)把CH3COONa溶于水之后,溶液中还存在的电离平衡:H2O H+ + OH-………②————(纯水中c(H+)=c(OH-)=1.0×10-7mol/L,显中性)CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
CH3COO- + H+CH3COOH………③(CH3COONa电离产生的CH3COO-与水电离产生的H+)随着CH3COONa的加入,CH3COO-结合水电离出的H+,破坏了水的电离平衡,使水的电离平衡右移。
溶液中c(OH-)>1.0×10-7mol/L>c(H+),CH3COONa水溶液显碱性。
⑵盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
(在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质(弱酸或弱碱),破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。
2.实质在溶液中盐电离出来的弱酸的阴离子或弱碱的阳离子和水电离出的H+或OH-离子结合生成弱电解质,促进了水的电离。
影响盐类水解的主要因素【学习目标】1、认识内因对盐类水解程度的影响;2、掌握外因对盐类水解程度的具体影响。
【要点梳理】要点一、影响盐类水解的因素 1.内因:主要因素是盐本身的结构和性质,组成盐的酸根对应的酸越弱或阳离子对应的碱越弱,水解程度就越大(越弱越水解)。
例如:酸性HF >CH 3COOH 水解程度NaF <CH 3COONa多元弱酸正盐的水解,水解反应第一步远远大于第二步,原因是第一步水解产生的OH ―对第二步水解的抑制作用,并且正盐阴离子与H +结合能力比酸式盐阴离子结合能力强。
例如:Na 2CO 3溶液中23233223CO +H O HCO OH ()HCO H O H CO OH ()-----⎧+⎪⎨++⎪⎩ƒƒ主要次要 2.外因①温度:水解过程一般是吸热过程,故升温使水解程度增大,反之则减小。
②浓度:盐的浓度越小,电解质离子相互碰撞结合成电解质分子的几率越小,水解程度越大。
3.溶液的酸碱性组成盐的离子能与水发生水解反应。
向盐溶液中加入H +,可抑制阳离子水解,促进阴离子水解;向盐溶液中加入OH ―,能抑制阴离子水解,促进阳离子水解。
【规律总结】越弱越水解,越热越水解,越稀越水解,加酸碱抑制或促进水解。
4.典型实例:醋酸钠水解平衡的移动:CH 3COO -+H 2O CH 3COOH+OH -要点二、互促水解1.互促水解的定义:弱酸弱碱盐溶液中,盐的阳离子结合水产生的OH -,盐的阴离子结合水产生的H +,相互促进水解,所以水解程度较大。
溶液的酸碱性取决于生成的弱酸和弱碱的相对强弱,若弱碱较强则溶液显碱性;若弱酸较强则溶液显酸性。
2.盐与盐混合时的互促水解问题 盐与盐的反应又分以下几种情况:(1)两种水解情况相同的盐溶液的反应。
①NaHCO 3和Na 2SiO 3的反应,NaSiO 3的水解程度远大于NaHCO 3的水解程度,因而Na 2SiO 3的水解抑制了NaHCO 3的水解而促进了HCO 3-的电离。
盐类水解的应用(一)盐类水解1.盐类水解发生条件以及其原理水有微弱地导电性,表明水是极弱的电解质,可以发生极其微弱的电离,能电离出极少量的H3O+( H+)和OH-,是一个吸热过程。
在溶液中盐的离子跟水所电离出来的H+或OH-生成弱电解质的过程叫做盐类的水解。
首先,盐必须溶于水,其次,盐必须能电离出弱酸根离子或弱碱阳离子。
弱电解质的生成,破坏了水的电离,促进水的电离平衡发生移动。
2.影响盐类水解的因素a.组成盐的酸根及阳离子组成盐的酸根对应的酸越弱,水解程度越大,碱性就越强,pH越大。
组成盐的阳离子对应的碱越弱,水解程度越大,酸性越强,pH越小。
对于弱酸强碱盐和强酸弱碱盐,溶液越稀,其水解程度越大。
对弱酸弱碱盐,其水解度与盐的浓度无关。
盐BA呈水后能否发生水解,主要决定于其电离出的B+或A-对配位水分子影响(极化作用)的大小。
离子极化理论指出:离子极化作用的大小决定于离子的极化力和变形性。
离子使异号离子极化而变形的作用称为该离子的“极化作用”;被异号离子极化而发生离子电子云变形的性能称为该离子的“变形性”。
虽然异号离子之间都可以使对方极化,但因阳离子具有多余的正电荷,半径较小,在外壳上缺少电子,它对相邻的阴离子起诱导作用显著;而阴离子则因半径较大,在外壳上有较多的电子容易变形,容易被诱导产生诱导偶极。
所以,对阳离子来说,极化作用应占主要地位,而对阴离子来说,变形性应占主要地位。
显然,离子具有高电荷和较小半径时,易水解;反之低电荷和较大半径时则不易发生水解。
如:Al2S3、SiCl4遇水都极易水解:Al2S3+6H2O⇌2Al(OH)3+3H2SSiCl4+4H2O⇌H4SiO4+4HCl相反,NaCl、KCl则不发生水解。
说明离子极化力越强,该离子的水解趋势就越大。
对于电荷相同的离子水解程度的大小主要由电子层结构决定。
如Ca2+、Ba2+、Sr2+等离子不易水解;而Zn2+、Cd2+、Hg2+等离子却能水解,这是它们间电子层结构不同。
盐类水解的原理及水解平衡的移动编稿:宋杰审稿:张灿丽【学习目标】1、认识盐类的组成与盐溶液酸碱性的关系,从而理解盐类水解的原理;2、以水的电离平衡为基础,认真分析盐类电离出的阴、阳离子与水电离出的H+或OH-结合生成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质;3、掌握盐类水解的离子方程式与化学方程式的书写;4、认识内因对盐类水解程度的影响;5、掌握外因对盐类水解程度的具体影响。
【要点梳理】要点一、盐类水解的实质1.定义【高清课堂:探究盐溶液的酸碱性#盐类的水解】⑴以CH3COONa为例探究盐类的水解CH3COONa溶于水之后,完全电离————强电解质CH3COONa ═ CH3COO- + Na+………①————(电离出的离子既没有H+,也没有OH-)把CH3COONa溶于水之后,溶液中还存在的电离平衡:H 2O H+ + OH-………②————(纯水中c(H+)=c(OH-)=1.0×10-7mol/L,显中性)CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
CH3COO- + H+CH3COOH………③(CH3COONa电离产生的CH3COO-与水电离产生的H+)随着CH3COONa的加入,CH3COO-结合水电离出的H+,破坏了水的电离平衡,使水的电离平衡右移。
溶液中c(OH-)>1.0×10-7mol/L>c(H+),CH3COONa水溶液显碱性。
⑵盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
(在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质(弱酸或弱碱),破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。
2.实质在溶液中盐电离出来的弱酸的阴离子或弱碱的阳离子和水电离出的H+或OH-离子结合生成弱电解质,促进了水的电离。
盐类水解的原理及水解平衡的移动编稿:宋杰审稿:张灿丽【学习目标】1、认识盐类的组成与盐溶液酸碱性的关系,从而理解盐类水解的原理;2、以水的电离平衡为基础,认真分析盐类电离出的阴、阳离子与水电离出的H+或OH-结合生成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质;3、掌握盐类水解的离子方程式与化学方程式的书写;4、认识内因对盐类水解程度的影响;5、掌握外因对盐类水解程度的具体影响。
【要点梳理】要点一、盐类水解的实质1.定义【高清课堂:探究盐溶液的酸碱性#盐类的水解】⑴以CH3COONa为例探究盐类的水解CH3COONa溶于水之后,完全电离————强电解质CH3COONa ═ CH3COO- + Na+………①————(电离出的离子既没有H+,也没有OH-)把CH3COONa溶于水之后,溶液中还存在的电离平衡:H2O H+ + OH-………②————(纯水中c(H+)=c(OH-)=1.0×10-7mol/L,显中性)CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
CH3COO- + H+CH3COOH………③(CH3COONa电离产生的CH3COO-与水电离产生的H+)随着CH3COONa的加入,CH3COO-结合水电离出的H+,破坏了水的电离平衡,使水的电离平衡右移。
溶液中c(OH-)>1.0×10-7mol/L>c(H+),CH3COONa水溶液显碱性。
⑵盐类水解的定义在溶液中盐电离出来的离子跟水所电离出来的H+ 或OH-结合生成弱电解质的反应,叫做盐类的水解。
(在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质(弱酸或弱碱),破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。
2.实质在溶液中盐电离出来的弱酸的阴离子或弱碱的阳离子和水电离出的H+或OH-离子结合生成弱电解质,促进了水的电离。
注意:①只有弱酸的阴离子或弱碱的阳离子才能与H+或OH-结合生成弱电解质。
②盐类水解使水的电离平衡发生移动,促进水的电离,使水电离出的c(OH-)≠c(H+)并使溶液呈酸性或碱性。
③盐类水解反应是酸碱中和反应的逆反应。
水解程度很小,故水解产物极少,盐溶液的酸碱性极弱。
3.水解特征可逆:盐类水解和酸碱中和反应互为可逆反应。
微弱:盐类水解非常微弱,进行程度小,一般无沉淀、气体产生。
吸热:中和反应是放热反应,盐类的水解是吸热反应。
要点诠释:盐类水解的条件:(1)必须有“弱根”离子(弱酸酸根阴离子、弱碱阳离子)。
(2)盐必须易溶于水(如CaCO3难溶于水,可以不考虑盐类的水解)。
要点二、盐类水解的规律1.盐类水解规律。
盐类水解规律可概括为“有弱才水解,无弱不水解,越弱越水解,都弱双水解,谁强显谁性”。
具体理解如下:(1)“有弱才水解,无弱不水解”是指盐中有弱酸酸根离子或者是弱碱阳离子,才能水解;若没有,则是强酸强碱盐,不发生水解反应。
(2)“越弱越水解”指的是弱酸酸根离子对应的酸越弱,就越容易水解;弱碱阳离子对应的碱越弱,就越容易水解。
(3)“都弱双水解”是指弱酸弱碱盐电离出的弱酸酸根离子和弱碱阳离子都发生水解,且相互促进。
(4)“谁强显谁性”是指当盐中的弱酸酸根离子对应的酸比弱碱阳离子对应的碱更容易电离时,则水解后盐溶液显酸性;反之,就显碱性。
以上规律可用表格表示如下:盐的类型实例是否水解水解离子溶液的pH 对水的电离的影响强酸强碱盐NaCl、K2SO4不水解无pH=7 无强酸弱碱盐NH4Cl、CuSO4、FeCl3水解NH4+、Cu2+、Fe3+pH<7促进水的电离强碱弱酸盐Na2S、Na2CO3、NaHCO3水解S2-、CO32―、HCO3―pH>7弱酸弱碱盐CH3COONH4、(NH4)2S水解CH3COO―、NH4+、S2―——要点诠释:酸式盐是显酸性还是显碱性,要看其电离和水解的相对强弱。
若电离能力比水解能力强(如NaHSO4、NaH2PO4),则水溶液呈酸性,NaHSO4只电离不水解也显酸性。
若水解能力超过电离能力(如NaHCO3、Na2HPO4),则水溶液显碱性。
要点三、盐类水解离子方程式的书写1、一般盐类水解程度很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此盐类水解的离子方程式中不标“↑”或“↓”,也不把生成物(如NH3·H2O、H2CO3等)写成其分解产物的形式。
2、盐类水解是可逆反应,是中和反应的逆反应,而中和反应是趋于完全的反应,所以盐类的水解反应是微弱的。
盐类水解的离子方程式一般不写“=”而写“”。
3、多元弱酸酸根离子的水解离子方程式应分步书写,且以第一步水解为主,如CO32-水解的离子方程式为:CO32-+H2O HCO3-+OH-(主要)HCO3-+H2O H2CO3+OH-(次要)若写成CO32-+2H2O H2CO3+2OH-或CO32-+H2O CO2+2OH-等,则都是错误的。
4、多元弱碱的阳离子水解的离子方程式较复杂,中学阶段只要求一步写到底即可。
值得注意的是,其最终生成的弱碱即使是难溶物也不标“↓”状态符号,因其水解生成的量极少,不会生成沉淀(但可形成胶体),如Al3+水解的离子方程式常写成:Al3++3H2O Al(OH)3+3H+。
要点诠释:(1)盐类水解的离子方程式同样遵循质量守恒定律和电荷守恒定律。
(2)要将盐的电离方程式与盐类水解的离子方程式区别开来。
如HS-+H2O S2-+H3O+是HS-的电离方程式,而HS-+H2O H2S+OH-则是HS-水解的离子方程式。
(3)实验室制Fe(OH)3胶体时,因水解较彻底用“=”,Fe3++3H2O △Fe(OH)3+3H+。
要点四、影响盐类水解的因素1.内因:主要因素是盐本身的结构和性质,组成盐的酸根对应的酸越弱或阳离子对应的碱越弱,水解程度就越大(越弱越水解)。
例如:酸性HF>CH3COOH 水解程度NaF<CH3COONa多元弱酸正盐的水解,水解反应第一步远远大于第二步,原因是第一步水解产生的OH―对第二步水解的抑制作用,并且正盐阴离子与H+结合能力比酸式盐阴离子结合能力强。
例如:Na2CO3溶液中2.外因①温度:水解过程一般是吸热过程,故升温使水解程度增大,反之则减小。
②浓度:盐的浓度越小,电解质离子相互碰撞结合成电解质分子的几率越小,水解程度越大。
3.溶液的酸碱性组成盐的离子能与水发生水解反应。
向盐溶液中加入H+,可抑制阳离子水解,促进阴离子水解;向盐溶液中加入OH―,能抑制阴离子水解,促进阳离子水解。
【规律总结】越弱越水解,越热越水解,越稀越水解,加酸碱抑制或促进水解。
4.典型实例:【高清课堂:影响盐类水解的主要因素#水解平衡的移动】醋酸钠水解平衡的移动:CH3COO-+H2O CH3COOH+OH-要点五、互促水解1.互促水解的定义:弱酸弱碱盐溶液中,盐的阳离子结合水产生的OH-,盐的阴离子结合水产生的H+,相互促进水解,所以水解程度较大。
溶液的酸碱性取决于生成的弱酸和弱碱的相对强弱,若弱碱较强则溶液显碱性;若弱酸较强则溶液显酸性。
2.盐与盐混合时的互促水解问题盐与盐的反应又分以下几种情况:(1)两种水解情况相同的盐溶液的反应。
①NaHCO3和Na2SiO3的反应,Na2SiO3的水解程度远大于NaHCO3的水解程度,因而Na2SiO3的水解抑制了NaHCO3的水解而促进了HCO3-的电离。
HCO3-H++CO32-,HCO3-的电离反过来又促进了SiO32-的水解,其反应为:Na2SiO3+2NaHCO3=H2SiO3↓+2Na2CO3②硝酸银与氯化铝的反应,因两者水解都显酸性,相互抑制,不利于水解的进行,发生复分解反应生成难溶物(AgCl),因此发生的反应为3AgNO3+AlCl3=3AgCl↓+Al(NO3)3。
(2)两种水解情况相反的盐溶液的反应,主要有如下几种情况:①“双水解”反应趋于完全,其离子方程式中应用“=”连接,并应标明产物的状态符号“↑”“↓”。
如泡沫灭火器的反应原理可表示为Al3++3HCO3-=A1(OH)3↓+3CO2↑。
如Na2S与Al2(SO4)3之间的反应:S2-+H2O HS-+OH-Al3++3H2O Al(OH)3+3H+两离子的水解相互促进,其反应式为3S2-+2Al3++6H2O=2Al(OH)3↓+3H2S↑。
②发生复分解反应。
当发生复分解反应生成沉淀比水解反应生成的沉淀更难溶时,物质之间发生复分解反应,如Na2S溶液和CuSO4溶液混合,其反应式为S2-+Cu2+=CuS↓。
③发生氧化还原反应。
物质之间能发生氧化还原反应,也能发生水解反应,通常是以氧化还原反应为主。
如Na2S 溶液与FeCl3溶液混合,其反应式为S2-+2Fe3+=S↓+2Fe2+。
3.互促水解离子方程式的书写:(1)弱酸弱碱盐中阴、阳离子相互促进水解。
如NH4+与S2-、HCO3-、CO32-、CH3COO-等虽然相互促进,却仍是部分水解(离子间能在溶液中大量共存),此双水解仍用“”表示。
NH4++CH3COO-H2O+ NH3·H2O。
(2)完全双水解反应:某些盐溶液在混合时,一种盐的阳离子和另一种盐的阴离子一起都发生水解,相互促进对方的水解,使两种离子的水解趋于完全。
常见的能发生相互促进水解的离子有:Al3+与S2-、HS-、CO32-、HCO3-、[Al(OH)4]-;Fe3+与[Al(OH)4]-、CO32-、HCO3-等。
书写双水解反应的离子方程式时,一般要根据水解特征、水解生成的酸和碱的特点确定反应物和生成物,以离子的电荷守恒和质量守恒相结合的方法进行配平。
例如:2Al3++3CO32―+3H2O=2Al(OH)3↓+3CO2↑Al3++3HCO3-=Al(OH)3↓+3CO2↑Al3++3AlO2―+6H2O=4Al(OH)3↓【典型例题】类型一、盐类水解的实质及水解规律例1.由一价离子组成的四种盐:AC、BD、AD、BC的1 mol/L的溶液,在室温下前两种溶液的pH=7,第【思路点拨】只有弱酸的阴离子或者弱碱的阳离子才会与水电离出的氢离子或者氢氧根结合,并且弱酸(或弱碱)越弱,其对应离子的水解程度越大。
【答案】A【解析】由AD溶液的pH>7,可知AOH的电离程度大于HD,由BC溶液的pH<7,可知BOH的电离程度小于HC,同理由AC、BD溶液的pH=7,可知AOH与HC、BOH与HD的电离程度相同。
故有电离程度HC=AOH >HD=BOH,即HC的酸性大于HD,AOH的碱性大于BOH。
【总结升华】物质的结构决定着物质的性质,盐能否水解,怎样水解,必须首先从物质结构入手加以分析,从而发现并掌握盐类水解规律。