课时跟踪检测(十九) 原电池 化学电源
- 格式:doc
- 大小:294.00 KB
- 文档页数:7

姓名,年级:时间:课时跟踪检测(九)化学能与电能A——基础过关练1.如图是铜片和锌片用导线连接后插入稀硫酸中形成的原电池,则锌片是( )A.阴极:得到电子,发生氧化反应B.正极:得到电子,发生还原反应C.阳极:失去电子,发生还原反应D.负极:失去电子,发生氧化反应解析:选D 原电池的两极是以正、负极命名;在酸性溶液中比较活泼的一极是负极,所以锌片是负极,负极失去电子发生氧化反应。
2.下列关于原电池的叙述正确的是()A.构成原电池的正极和负极必须是两种不同的金属B.原电池是将化学能转变为电能的装置C.在原电池中,电子流出的一极是负极,该电极被还原D.原电池放电时,电流的方向是从负极到正极解析:选B A项,原电池的正极可用导电的非金属材料作电极,错误;B项,原电池是将化学能转变为电能的装置,正确;C项,在原电池中,电子流出的一极是负极,该电极被氧化,错误;D项,原电池放电时,电流的方向是从正极到负极,错误。
3.已知空气锌电池的电极反应如下:锌电极:Zn+2OH--2e-===ZnO+H2O;石墨电极:错误!O2+H2O+2e-===2OH-。
可以判断石墨电极是( )A.负极,发生还原反应B.正极,发生氧化反应C.负极,发生氧化反应 D.正极,发生还原反应解析:选 D 空气锌电池中,失去电子的一极是负极,发生氧化反应,得到电子的一极是正极,发生还原反应,由此可知,石墨电极作正极,发生还原反应。
4.如图所示,把锌片和铜片用导线相连后插入稀硫酸溶液中构成原电池。
下列叙述正确的是()A.电流从铜片经导线流向锌片B.该装置将电能转变为化学能C.一段时间后,铜片质量减轻D.锌片发生还原反应解析:选 A 题给装置为原电池,把化学能转化为电能,锌作负极失去电子发生氧化反应,铜作正极,H+在Cu电极上得电子生成氢气,Cu质量不变,电流从正极Cu沿导线流向负极Zn。
5.两种金属A、B与稀硫酸组成原电池时,A是正极。
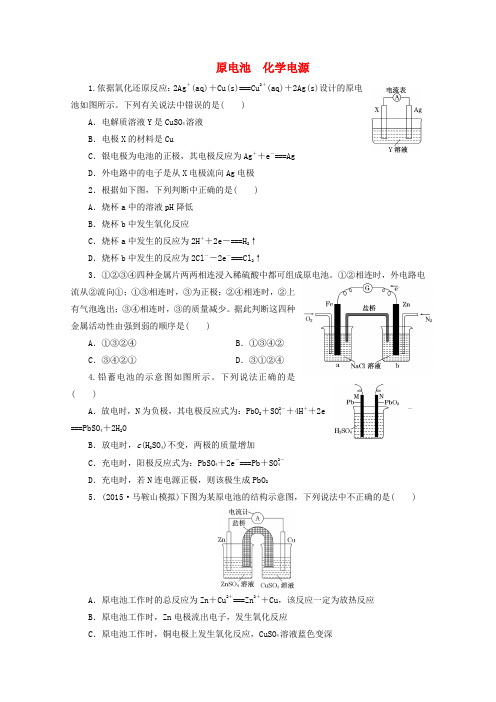
原电池化学电源1.依据氧化还原反应:2Ag+(aq)+Cu(s)===Cu2+(aq)+2Ag(s)设计的原电池如图所示。
下列有关说法中错误的是( )A.电解质溶液Y是CuSO4溶液B.电极X的材料是CuC.银电极为电池的正极,其电极反应为Ag++e-===AgD.外电路中的电子是从X电极流向Ag电极2.根据如下图,下列判断中正确的是( )A.烧杯a中的溶液pH降低B.烧杯b中发生氧化反应C.烧杯a中发生的反应为2H++2e-===H2↑D.烧杯b中发生的反应为2Cl--2e-===Cl2↑3.①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池。
①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。
据此判断这四种金属活动性由强到弱的顺序是( )A.①③②④B.①③④②C.③④②① D.③①②④4.铅蓄电池的示意图如图所示。
下列说法正确的是( )A.放电时,N为负极,其电极反应式为:PbO2+SO2-4+4H++2e-===PbSO4+2H2OB.放电时,c(H2SO4)不变,两极的质量增加C.充电时,阳极反应式为:PbSO4+2e-===Pb+SO2-4D.充电时,若N连电源正极,则该极生成PbO25.(2015·马鞍山模拟)下图为某原电池的结构示意图,下列说法中不正确的是( )A.原电池工作时的总反应为Zn+Cu2+===Zn2++Cu,该反应一定为放热反应B.原电池工作时,Zn电极流出电子,发生氧化反应C.原电池工作时,铜电极上发生氧化反应,CuSO4溶液蓝色变深D.如果将Cu电极改为Fe电极,Zn电极依然作负极6.(2014·全国卷Ⅱ)2013年3月我国科学家报道了如图所示的水溶液锂离子电池体系。
下列叙述错误的是( )A.a为电池的正极B.电池充电反应为LiMn2O4===Li1-x Mn2O4+x LiC.放电时,a极锂的化合价发生变化D.放电时,溶液中Li+从b向a迁移7.(2015·江门质检)LiSO2电池具有输出功率高且低温性能好的特点,其电解质为LiBr,溶剂是碳酸丙烯酯和乙腈,Li+可在其中移动。

课时跟踪检测(十七)原电池化学电源1.一种突破传统电池设计理念的镁-锑液态金属储能电池的工作原理如图所示,该电池所用液体密度不同,在重力作用下分为三层,工作时中间层熔融盐的组成及浓度不变。
下列说法不正确的是()A.放电时,Mg(液)层的质量减小B.放电时,正极反应式为Mg2++2e-===MgC.该电池充电时,Mg-Sb(液)层发生还原反应D.该电池充电时,Cl-向下移动解析:选C根据电流方向可知上为负极,下为正极。
放电时负极为Mg-2e-===Mg2+,正极:Mg2++2e-===Mg。
充电时下为阳极,上为阴极,故Mg-Sb(液)作阳极发生氧化反应。
2.根据甲醇在酸性电解质溶液中与氧气生成二氧化碳和水的反应,设计一种燃料电池。
该燃料电池工作时,负极上发生的反应为()A.CH3OH+O2-2e-===H2O+CO2+2H+B.O2+4H++4e-===2H2OC.CH3OH-6e-+H2O===CO2↑+6H+D.4OH--4e-===O2↑+2H2O答案:C3.锂-空气电池是一种可充放电电池,电池反应为2Li+O2===Li2O2,某锂-空气电池的构造原理如图。
下列说法正确的是()A.可选用有机电解液或水性电解液B.含催化剂的多孔材料为电池的负极C.放电时正极的电极反应式为O2+2Li++2e-===Li2O2D.充电时锂电极应连接外接电源的正极解析:选C在锂-空气电池中,锂失电子作负极,反应式为Li-e-===Li+,以空气中的氧气作为正极反应物,氧气得电子生成Li2O2,正极反应为O2+2Li++2e-===Li2O2,总反应为2Li+O2===Li2O2。
选项A,可选用有机电解液,水性电解液会与Li直接反应,错误;选项B,含催化剂的多孔材料为电池的正极,错误;选项C,放电时正极的电极反应式为O2+2Li++2e-===Li2O2,正确;选项D,充电时锂电极应连接外接电源的负极,电极反应式为Li++e-===Li,错误。

2020版高考新创新一轮复习化学新课改省份专用:跟踪检测(十九)原电池化学电源跟踪检测(九)原电池化学电源1.下列关于原电池的叙述中正确的是( )A.正极和负极必须是金属B.原电池是把化学能转化成电能的装置C.原电池工作时,正极和负极上发生的都是氧化还原反应D.锌.铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上就有0.1 g氢气生成解析:选B 一般普通原电池中负极必须是金属,正极可以是金属或非金属导体,A 错误;原电池工作时,正极上发生还原反应,负极上发生氧化反应,C错误;锌.铜和盐酸构成的原电池工作时,锌片上有6.5 g锌溶解,正极上有0.2 g氢气生成,D错误。
2. (xx·厦门模拟)将反应2Fe3++2I-2Fe2++I2设计成如图所示的原电池。
下列说法不正确的是( )A.盐桥中的K+移向FeCl3溶液B.反应开始时,乙中石墨电极上发生氧化反应C.电流计读数为零时,反应达到化学平衡状态D.电流计读数为零后,在甲中溶入FeCl2固体,乙中石墨电极为负极解析:选D A项,甲池中石墨电极为正极,乙池中石墨电极为负极,盐桥中阳离子向正极移动,所以向FeCl3溶液迁移,正确;B项,反应开始时,乙中I-失去电子,发生氧化反应,正确;C项,当电流计读数为零时,说明没有电子发生转移,反应达到平衡,正确;D项,当加入Fe2+,导致平衡逆向移动,则Fe2+失去电子生成Fe3+,甲中石墨作为负极,而乙中石墨成为正极,错误。
3.某同学做了如下实验,下列说法中正确的是( )装置现象电流计指针未发生偏转电流计指针发生偏转A.加热铁片Ⅰ所在烧杯,电流计指针会发生偏转B.用KSCN溶液检验铁片Ⅲ.Ⅳ附近溶液,可判断电池的正.负极C.铁片Ⅰ.Ⅲ的腐蚀速率相等D.“电流计指针未发生偏转”说明铁片Ⅰ.铁片Ⅱ均未被腐蚀解析:选A 温度不同,反应速率不等,两烧杯中存在电势差,能够产生电流,电流表指针会发生偏转,故A正确;两烧杯中溶液的浓度不同,发生离子的定向移动,产生电流,铁失去电子发生氧化反应,生成Fe2+,与KSCN溶液无明显现象,不能判断电池的正.负极,故B错误;铁片Ⅰ与铁片Ⅱ未构成原电池,铁片Ⅲ与铁片Ⅳ构成了原电池,腐蚀速率一定不相等,故C错误;“电流计指针未发生偏转”说明铁片Ⅰ.铁片Ⅱ未构成原电池,但铁片表面均会发生吸氧腐蚀,故D错误。

2021年高考化学大一轮复习原电池和化学电源课时跟踪监测试题1.(xx·海安中学模拟)下列叙述正确的是( )①原电池是把化学能转化成电能的一种装置②原电池的正极发生氧化反应,负极发生还原反应③不能自发进行的氧化还原反应,通过原电池的装置均可实现④碳棒不能用来作原电池的正极⑤反应Cu+2Ag+===2Ag+Cu2+,能以原电池的形式来实现A.①⑤B.①④⑤C.②③④ D.②⑤2.(xx·连云港市高三摸底)研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。
电池以金属锂和钢板为电极材料,LiOH为电解质,使用时加入水即可放电。
关于该电池的说法正确的是( )A.钢板为正极,发生还原反应B.放电时电子的流向:正极→导线→负极C.放电时OH-向正极移动D.总反应为:2Li+2H+===2Li++H2↑3.(xx·丹阳中学模拟)我国科学家发明的一种可控锂水电池的工作原理如图所示。
下列有关说法不正确的是( )A.电池工作时,锂离子向正极移动B.有机电解质可用水溶液代替C.电池总反应为2Li+2H2O===2LiOH+H2↑D.该装置不仅可提供电能,还可得到清洁的氢气4.(xx·射阳中学模拟)纽扣式银锌电池的构造示意图如右图所示,电池的总反应为:Zn+Ag2O+H2O===Zn(OH)2+2Ag下列说法不正确的是( )A.Zn作负极B.电子经外电路流向Ag2O极C.K+向Zn极移动D.正极反应: Ag2O+H2O+2e-===2Ag+2OH-5.(xx·徐州一中模拟)下图是将SO2转化为重要的化工原料H2SO4的原理示意图,下列说法不正确的是( )A.该装置将化学能转化为电能B.催化剂b表面O2发生还原反应,其附近酸性增强C.催化剂a表面的反应是:SO2+2H2O-2e-===SO2-4+4H+D.若得到的硫酸浓度仍为49%,则理论上参加反应的SO2与加入的H2O的质量比为8∶15 6.[双选题](xx·海门市高三第一调研)高铁电池是一种新型可充电电池,与普通高能电池相比,该电池长时间保持稳定的放电电压。

冠夺市安全阳光实验学校课时跟踪检测(十九) 原电池化学电源1.(2013·北京高考)下列设备工作时,将化学能转化为热能的是( )A B C D硅太阳能电池锂离子电池太阳能集热器燃气灶2.某一同学根据离子反应方程式2Fe3++Fe===3Fe2+来设计原电池。
下列设计方案中可行的是( )A.电极材料为铁和锌,电解质溶液为FeCl3溶液B.电极材料为铁和铜,电解质溶液为Fe(NO3)3溶液C.电极材料为铁和石墨,电解质溶液为FeCl2溶液D.电极材料为石墨,电解质溶液为FeCl3溶液3.(2014·兰州模拟)有关下列四个常用电化学装置的叙述中,正确的是( )图Ⅰ碱性锌锰电池图Ⅱ铅-硫酸蓄电池图Ⅲ电解精炼铜图Ⅳ银锌纽扣电池A.图Ⅰ所示电池中,MnO2的作用是催化剂B.图Ⅱ所示电池放电过程中,硫酸浓度不断增大C.图Ⅲ所示装置工作过程中,电解质溶液中Cu2+浓度始终不变D.图Ⅳ所示电池中,Ag2O是氧化剂,电池工作过程中还原为Ag4.电子表所用的纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液,其电极反应式是:Zn+2OH--2e-===ZnO+H2O;Ag2O+H2O+2e-===2Ag+2OH -。
总反应式为:Ag2O+Zn===2Ag+ZnO,下列说法正确的是( )A.Zn为正极,Ag2O为负极B.Zn为负极,Ag2O为正极C.原电池工作时,正极区溶液pH值减小D.原电池工作时,负极区溶液pH值增大5.控制适合的条件,将反应Fe3++Ag Fe2++Ag+设计成如图所示的原电池(盐桥装有琼脂-硝酸钾溶液;灵敏电流计的0刻度居中,左右均有刻度)。
已知,接通后,观察到电流计指针向右偏转。
下列判断正确的是( )A.在外电路中,电子从石墨电极流向银电极B.盐桥中的K+移向乙烧杯C.一段时间后,电流计指针反向偏转,越过0刻度,向左边偏转D.电流计指针居中后,往甲烧杯中加入一定量的铁粉,电流计指针将向左偏转6.把a、b、c、d四块金属浸入稀硫酸中,用导线两两连接组成多个原电池,若a、b相连, a为负极;c、d相连,d上有气泡逸出;a、c相连,a极减轻;b、d相连,b为正极。
跟踪检测(十八)原电池化学电源1.原电池中,B极逐渐变粗,A极逐渐变细,C为电解质溶液,则A、B、C应是下列各组中的()A.A是Zn,B是Cu,C为稀硫酸B.A是Cu,B是Zn,C为稀硫酸C.A是Fe,B是Ag,C为稀AgNO3溶液D.A是Ag,B是Fe,C为稀AgNO3溶液解析:选C在原电池中,一般活泼金属作负极,失去电子发生氧化反应(金属被氧化)而逐渐溶解(或质量减轻);不活泼金属(或导电的非金属)作正极,发生还原反应有金属析出(质量增加)或有气体放出;依据题意可知A为负极、B为正极,即活泼性A大于B,且A 能从电解质溶液中置换出金属单质。
所以,只有C选项符合题意。
2.镁-次氯酸盐燃料电池,具有比能量高、安全方便等优点。
该电池的正极反应式为ClO-+H2O+2e-===Cl-+2OH-,关于该电池的叙述正确的是()A.该电池中镁为负极,发生还原反应B.电池工作时,OH-向正极移动C.该电池的总反应为Mg+ClO-+H2O===Mg(OH)2↓+Cl-D.电池工作时,正极周围溶液的pH将不断变小解析:选C次氯酸盐在正极发生反应,则Mg为负极,发生氧化反应,A项错误;电池工作时,阴离子向负极移动,B项错误;负极反应式为Mg-2e-+2OH-===Mg(OH)2↓,将正、负极反应式相加可得总反应,C项正确;根据正极反应式可知,电池工作时,正极周围溶液的c(OH-)增大,pH将增大,D项错误。
3.由于具有超低耗电量、寿命长的特点,LED产品越来越受人欢迎。
下图是氢氧燃料电池驱动LED发光的装置。
下列有关叙述正确的是()A.a处通入氧气,b处通入氢气B.该装置中只涉及两种形式的能量转化C.电池正极电极反应式为O2+2H2O+4e-===4OH-D.P-型半导体连接的是电池负极解析:选C根据电子移向,a处应通H2,b处应通O2,A错误;在该装置中化学能转化为电能,电能转化为光能、热能等,B错误;P-型半导体连接的是电池正极,D错误。
跟踪检测(十七)原电池化学电源[本节过关达标练]1.某原电池总反应为Cu+2Fe3+===Cu2++2Fe2+,下列能实现该反应的原电池是()解析:选D由题意知,Cu为负极材料,正极材料的金属活动性必须弱于Cu,其中B、D项符合该条件;由Fe3+得电子生成Fe2+知,电解质溶液中必须含有Fe3+,同时符合上述两条件的只有D项。
2.一定量的稀盐酸跟过量锌粉反应时,为了加快反应速率又不影响生成H2的总量,可采取的措施是()A.加入少量稀NaOH溶液B.加入少量CH3COONa固体C.加入少量NH4HSO4固体D.加入少量CuSO4溶液解析:选D A中加入NaOH溶液,消耗盐酸,氢气的生成量减少,错误;B中加入CH3COONa,CH3COO-会结合H+,生成醋酸,减慢反应速率,错误;C中加入NH4HSO4固体,增加了H+的量,生成的氢气增多,错误;D中加入少量CuSO4溶液,Zn置换出少量Cu附着在锌表面,形成原电池可以加快反应速率,并且没有影响氢气的生成量,正确。
3.(2017·聊城模拟)将镁片、铝片平行插入一定浓度的NaOH溶液中,用导线连接成闭合回路,该装置在工作时,下列叙述正确的是()A.镁比铝活泼,镁失去电子被氧化成Mg2+B.铝是电池负极,开始工作时溶液中会立即有白色沉淀生成C.该装置的内、外电路中,均是电子的定向移动形成电流D.该装置开始工作时,铝片表面的氧化膜可以不必处理解析:选D铝、镁在NaOH溶液中构成原电池,Mg不反应,铝与NaOH溶液反应,镁为正极,铝为负极,负极反应Al-3e-+4OH-===AlO-2+2H2O,开始工作时溶液中没有白色沉淀生成,A、B错误;电子从铝极流出经导线流向镁极,溶液中阴离子移向负极,阳离子向正极移动,C错误;氧化铝溶于氢氧化钠溶液,D正确。
SO4的烧杯中放入用导线连接的电4.(2017·开封模拟)如图,在盛有稀H极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是() A.溶液中的SO2-4向Y极移动B.若两电极分别为铁和碳棒,则X为碳棒,Y为铁C.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性顺序为X>Y解析:选D A项,根据电子流向知,X是负极、Y是正极,溶液中的SO2-4移向负极,即X极,错误;B项,因为X是负极、Y是正极,所以若两电极分别为铁和碳棒,则X为铁,Y为碳棒,错误;C项,负极X上发生氧化反应、正极Y上发生还原反应,错误;D 项,原电池中,活泼的金属作负极,若两电极都是金属,则它们的活动性顺序为X>Y,正确。
高考一轮复习课时跟踪检测(二十一)原电池化学电源课时跟踪检测(二十一) 原电池化学电源1.M、N、P、E四种金属,已知:①M+N2===N+M2;②M、P用导线连接放入++硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2+2e===E,N-2e===N2。
则这四种金属的还原性由强到弱的顺序是( )+--+A.P>M>N>E C.P>N>M>EB.E>N>M>P D.E>P>M>N解析:选A 由①知,金属还原性:M>N;M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出,说明M作原电池的正极,故金属还原性:P>M;N、E构成的原电池中,N作负极,故金属还原性:N>E。
2.(2021・深圳模拟)如图是课外活动小组设计的用化学电源使LED灯发光的装置。
下列说法错误的是( )A.铜片表面有气泡生成B.装置中存在“化学能→电能→光能”的转换 C.如果将硫酸换成柠檬汁,导线中不会有电子流动 D.如果将锌片换成铁片,电路中的电流方向不变解析:选C 铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,故A正确;原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故B正确;柠檬汁显酸性也能作电解质溶液,所以将硫酸换成柠檬汁,仍然构成原电池,所以导线中有电子流动,故C错误;金属性Cu比Zn、Fe弱,Cu作正极,所以电路中的电流方向不变,仍然由Cu流向负极,故D正确。
3.可用于电动汽车的铝―空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。
下列说法正确的是( )A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为O2+2H2O+4e===4OH--B.以NaOH溶液为电解质溶液时,负极反应为Al+3OH-3e===Al(OH)3↓ C.以NaOH 溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保持不变 D.电池工作时,电子通过外电路从正极流向负极解析:选A 正极O2得电子,溶液显碱性或中性时,正极反应都为O2+2H2O+4e---===4OH-,A项正确;铝作负极,铝失电子,碱性溶液(NaOH)中的负极反应为Al+4OH--+2HO,-3e-===AlO2B项错误;在碱性时总的电池反应式为4Al+3O2+4OH-===4AlO-22+2H2O,溶液pH降低,C项错误;电池工作时,电子从负极流向正极,D项错误。
第2节原电池化学电源课时跟踪练一、选择题1.课堂学习中,同学们利用铝条、锌片、铜片、导线、电流计、橙汁、烧杯等用品探究原电池的组成。
下列结论错误的是( )A.原电池是将化学能转化成电能的装置B.原电池由电极、电解质溶液和导线等组成C.图中a极为铝条、b极为锌片时,导线中会产生电流D.图中a极为锌片、b极为铜片时,电子由铜片通过导线流向锌片解析:原电池是将化学能转化成电能的装置,A正确;原电池由电极、电解质溶液和导线等组成,B正确;图中a极为铝条、b极为锌片时,构成原电池,导线中会产生电流,C 正确;图中a极为锌片、b极为铜片时锌片作负极,电子由锌片通过导线流向铜片,D错误。
答案:D2.(2016·上海卷)图1是铜锌原电池示意图。
图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )图1 图2A.铜棒的质量B.c(Zn2+)C.c(H+) D.c(SO2-4)解析:该装置构成原电池,Zn是负极,Cu是正极。
A项,在正极Cu上溶液中的H+获得电子变为氢气,Cu棒的质量不变,错误;B项,由于Zn是负极,不断发生反应Zn-2e-===Zn2+,所以溶液中c(Zn2+)增大,错误;C项,由于反应不断消耗H+,所以溶液的c(H+)逐渐降低,正确;D项,SO2-4不参加反应,其浓度不变,错误。
答案:C3.如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )A.外电路的电流方向为X→外电路→YB.若两电极分别为铁和碳棒,则X为碳棒,Y为铁C.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性强弱为X>Y解析:外电路电子流向为X→外电路→Y,电流方向与其相反;X极失电子,作负极,Y 极发生的是还原反应,X极发生的是氧化反应;若两电极分别为铁和碳棒,则Y为碳棒,X 为铁。
答案:D4.(2016·全国卷Ⅲ)锌空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH 溶液,反应为2Zn+O2+4OH-+2H2O===2Zn(OH)2-4。
课时跟踪检测(十九)原电池化学电源1.M、N、P、E四种金属,已知:①M+N2+===N+M2+;②M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出;③N、E用导线连接放入E的硫酸盐溶液中,电极反应为E2++2e-===E,N-2e-===N2+。
则这四种金属的还原性由强到弱的顺序是() A.P>M>N>E B.E>N>M>PC.P>N>M>E D.E>P>M>N解析:选A由①知,金属还原性:M>N;M、P用导线连接放入硫酸氢钠溶液中,M表面有大量气泡逸出,说明M作原电池的正极,故金属还原性:P>M;N、E构成的原电池中,N作负极,故金属还原性:N>E。
2.(2016·深圳模拟)如图是课外活动小组设计的用化学电源使LED灯发光的装置。
下列说法错误的是()A.铜片表面有气泡生成B.装置中存在“化学能→电能→光能”的转换C.如果将硫酸换成柠檬汁,导线中不会有电子流动D.如果将锌片换成铁片,电路中的电流方向不变解析:选C铜锌原电池中,Cu作正极,溶液中的氢离子在正极上得电子生成氢气,所以Cu上有气泡生成,故A正确;原电池中化学能转化为电能,LED灯发光时,电能转化为光能,故B正确;柠檬汁显酸性也能作电解质溶液,所以将硫酸换成柠檬汁,仍然构成原电池,所以导线中有电子流动,故C错误;金属性Cu比Zn、Fe弱,Cu作正极,所以电路中的电流方向不变,仍然由Cu流向负极,故D正确。
3.可用于电动汽车的铝—空气燃料电池,通常以NaCl溶液或NaOH溶液为电解质溶液,铝合金为负极,空气电极为正极。
下列说法正确的是()A.以NaCl溶液或NaOH溶液为电解质溶液时,正极反应都为O2+2H2O+4e-===4OH -B.以NaOH溶液为电解质溶液时,负极反应为Al+3OH--3e-===Al(OH)3↓C.以NaOH溶液为电解质溶液时,电池在工作过程中电解质溶液的pH保持不变D.电池工作时,电子通过外电路从正极流向负极解析:选A正极O2得电子,溶液显碱性或中性时,正极反应都为O2+2H2O+4e-===4OH-,A项正确;铝作负极,铝失电子,碱性溶液(NaOH)中的负极反应为Al+4OH--3e-===AlO-2+2H2O,B项错误;在碱性时总的电池反应式为4Al+3O2+4OH-===4AlO-2+2H2O,溶液pH降低,C项错误;电池工作时,电子从负极流向正极,D项错误。
4.根据右图,下列判断中正确的是()A.烧杯a中的溶液pH降低B.烧杯b中发生氧化反应C.烧杯a中发生的反应为2H++2e-===H2↑D.烧杯b中发生的反应为2Cl--2e-===Cl2↑解析:选B Zn比Fe活泼,所以Zn作负极,发生氧化反应,电极反应式为Zn-2e-===Zn2+;Fe作正极,氧气在该电极上发生还原反应,电极反应式为2H2O+O2+4e-===4OH -,反应后溶液pH升高。
5.(2016·广州二模)某小组为研究原电池原理,设计如图装置,下列叙述正确的是()A.若X为Fe,Y为Cu,铁为正极B.若X为Fe,Y为Cu,电子由铜片流向铁片C.若X为Fe,Y为C,碳棒上有红色固体析出D.若X为Cu,Y为Zn,锌片发生还原反应解析:选C Fe比Cu活泼,Fe作负极,电子从Fe流向Cu,故A、B两项错误;若X为Fe,Y为C,电解质溶液为硫酸铜,则正极C上析出Cu,故C正确;Zn比Cu活泼,Zn作负极发生氧化反应,故D错误。
6.(2016·潍坊二模)某兴趣小组同学利用氧化还原反应:2KMnO4+10FeSO4+8H2SO4===2MnSO4+5Fe2(SO4)3+K2SO4+8H2O设计如下原电池,盐桥中装有饱和K2SO4溶液。
下列说法正确的是()A.b电极上发生还原反应B.外电路电子的流向是从a到bC.电池工作时,盐桥中的SO2-4移向甲烧杯D.a电极上发生的反应为MnO-4+8H++5e-===Mn2++4H2O解析:选D根据反应方程式判断b极是FeSO4发生氧化反应,为负极,A错误;由上述分析可知,a为正极,电子由负极流向正极,即从b流向a,B错误;原电池中阴离子向负极移动,则盐桥中的SO2-4移向乙烧杯中,C错误;甲烧杯中发生还原反应,Mn元素的化合价降低,电极反应为MnO-4+8H++5e-===Mn2++4H2O,D正确。
7.(2016·漳州模拟)一种微生物燃料电池的结构示意图如右所示,关于该电池的叙述正确的是()A.电池工作时,电子由a流向bB.微生物所在电极区放电时发生还原反应C.放电过程中,H+从正极区移向负极区D.正极反应式为MnO2+4H++2e-===Mn2++2H2O解析:选D因为右侧产生CO2,说明微生物所在的电极区C m(H2O)n失电子生成CO2,所以电池工作时电子由b经外电路流向a极,A项错误;微生物所在电极区放电时发生氧化反应,B项错误;放电时阳离子向正极移动,C项错误;放电时正极发生还原反应,D项正确。
8.(2016·松江区模拟)电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如下。
下列说法不正确的是()A.O2在电极b上发生还原反应B.溶液中OH-向电极a移动C.反应消耗的NH3与O2的物质的量之比为4∶5D.负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O解析:选C构成的原电池中,通入氧气的电极是正极,发生还原反应,A正确;溶液中阴离子氢氧根离子移向负极a极,B正确;1 mol NH3反应生成氮气转移3 mol电子,1 mol O2反应转移4 mol电子,根据电子转移守恒,消耗的NH3与O2的物质的量之比为4∶3,C错误;负极的电极反应式为2NH3-6e-+6OH-===N2+6H2O,D正确。
9.(2016·绍兴模拟)利用反应6NO2+8NH3===7N2+12H2O构成电池的装置如图所示。
此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能。
下列说法正确的是()A.电流从左侧电极经过负载后流向右侧电极B.为使电池持续放电,离子交换膜需选用阴离子交换膜C.电极A极反应式为2NH3-6e-===N2+6H+D.当有4.48 L NO2被处理时,转移电子数为0.8N A解析:选B该反应中,二氧化氮中N元素化合价由+4价变为0价、氨气中N元素化合价由-3价变为0价,所以通入二氧化氮的电极是正极、通入氨气的电极是负极,放电时,电流从正极沿导线流向负极,所以电流从右侧电极经过负载后流向左侧电极,故A错误;原电池工作时,阴离子向负极移动,为使电池持续放电,离子交换膜需选用阴离子交换膜,防止二氧化氮反应生成硝酸盐和亚硝酸盐,导致原电池不能正常工作,故B正确;电解质溶液呈碱性,则负极电极方程式为2NH3-6e-+6OH-===N2+6H2O,故C错误;气体摩尔体积受温度和压强影响,温度和压强未知导致气体摩尔体积未知,所以无法计算,故D错误。
10.(2016·张家界模拟)液流电池是一种新的蓄电池,是利用正负极电解液分开,各自循环的一种高性能蓄电池,具有容量高、使用领域(环境)广、循环使用寿命长的特点。
如图是一种锌溴液流电池,电解液为溴化锌的水溶液。
下列说法正确的是()A.充电时阳极的电极反应式:Zn-2e-===Zn2+B.充电时电极a为外接电源的负极C.放电时Br-向右侧电极移动D.放电时左右两侧电解质储罐中的离子总浓度均增大解析:选D如图是一种锌溴液流电池,电解液为溴化锌的水溶液,所以该电池的负极为锌,电极反应式为Zn-2e-===Zn2+,溴为原电池的正极,电极反应式为Br2+2e-===2Br -,充电时阳极的电极反应式与正极的电极反应式相反,所以充电时阳极的电极反应式为2Br --2e-===Br,故A错;在充电时,原电池的正极连接电源的正极,是电解池的阳极,而2原电池的负极连接电源的负极,所以充电时电极a为外接电源的正极,故B错;放电时为原电池,在原电池中间隔着一个阳离子交换膜,所以Br-不能向右侧电极移动,故C错;放电时左侧生成溴离子,右侧生成锌离子,所以放电时左右两侧电解质储罐中的离子总浓度均增大,故D正确。
11.(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是________(填字母,下同)。
a.C(s)+H2O(g)===CO(g)+H2(g)ΔH>0b.2H2(g)+O2(g)===2H2O(l)ΔH<0c.NaOH(aq)+HCl(aq)===NaCl(aq)+H2O(l)ΔH<0若以KOH溶液为电解质溶液,依据所选反应设计一个原电池,其正极的电极反应为______________________。
(2)某同学用铜片、银片、Cu(NO3)2溶液、AgNO3溶液、导线和盐桥(装有琼脂-KNO3的U形管)设计成一个原电池,如图所示,下列判断中正确的是________。
a.实验过程中,左侧烧杯中NO-3浓度不变b.实验过程中取出盐桥,原电池能继续工作c.若开始时用U形铜代替盐桥,装置中无电流产生d.若开始时用U形铜代替盐桥,U形铜的质量不变解析:(1)根据题中信息,设计成原电池的反应通常是放热反应,排除a,根据已学知识,原电池反应必是自发进行的氧化还原反应,排除c。
原电池正极发生还原反应,由于是碱性介质,则电极反应中不应出现H+,故正极的电极反应为O2+4e-+2H2O===4OH-。
(2)该原电池的工作原理是Cu+2Ag+===2Ag+Cu2+,盐桥起形成闭合回路和平衡电荷的作用,因此当电池工作时,盐桥中的NO-3向负极移动,因此左侧烧杯中NO-3的浓度将增大,a错误。
当取出盐桥,不能形成闭合回路,电池处于断路状态,不能继续工作,b错误。
若开始时用U形铜代替盐桥,则左侧烧杯相当于电解装置,而右侧烧杯相当于原电池装置,电极反应从左往右依次为阳极:4OH--4e-===2H2O+O2↑,阴极:Cu2++2e-===Cu,负极:Cu-2e-===Cu2+,正极Ag++e-===Ag,由此可知c错误、d正确。
答案:(1)b O2+2H2O+4e-===4OH-(2)d12.(2016·深圳模拟)如图所示,是原电池的装置图。
请回答:(1)若C为稀H2SO4溶液,电流表指针发生偏转,B电极材料为Fe且做负极,则A电极上发生的电极反应式为____________________;反应进行一段时间后溶液C的pH将________(填“升高”“降低”或“基本不变”)。