生长激素(GH)测定试剂盒(化学发光法)产品技术要求新产业
- 格式:docx
- 大小:15.71 KB
- 文档页数:2
![一种检测人生长激素化学发光免疫分析测定试剂盒及其制备方法[发明专利]](https://uimg.taocdn.com/bf5395df112de2bd960590c69ec3d5bbfd0adacb.webp)
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 201810941310.1(22)申请日 2018.08.17(71)申请人 迪瑞医疗科技股份有限公司地址 130000 吉林省长春市高新区宜居路3333号(72)发明人 翟涛 刘杨 何浩会 高威 孙成艳 (74)专利代理机构 长春众邦菁华知识产权代理有限公司 22214代理人 李外(51)Int.Cl.G01N 33/74(2006.01)(54)发明名称一种检测人生长激素化学发光免疫分析测定试剂盒及其制备方法(57)摘要本发明提供一种检测人生长激素化学发光免疫分析测定试剂盒及其制备方法,属于免疫分析技术领域。
该试剂盒包括:包被有链霉亲和素的磁珠悬浮液、吖啶酯标记的GH抗体和生物素标记的GH抗体。
本发明还提供一种检测人生长激素化学发光免疫分析测定试剂盒的制备方法。
该试剂盒采用夹心法原理定量测定血清或血浆中的GH,在链霉亲和素-磁微粒悬浮液中加入生物素-GH抗体复合物,通过生物素和链霉亲和素的亲和反应,形成磁微球-亲和素-生物素-GH复合物,通过抗原抗体反应,形成抗原抗体复合物形成磁微粒-生物素-GH抗体-GH -GH抗体-吖啶酯,该检测方法具有灵敏度高、特异性强、重复性好、检测范围广、成本相对较低的优点,可广泛用于临床检测。
权利要求书1页 说明书9页 附图1页CN 108776232 A 2018.11.09C N 108776232A1.一种检测人生长激素化学发光免疫分析测定试剂盒,其特征在于,该试剂盒包括:包被有链霉亲和素的磁珠悬浮液吖啶酯标记的GH抗体生物素标记的GH抗体。
2.根据权利要求1所述的一种检测人生长激素化学发光免疫分析测定试剂盒,其特征在于,所述的包被有链霉亲和素的磁珠悬浮液中,包被有链霉亲和素的磁珠的粒径为1-3μm。
3.根据权利要求1所述的一种检测人生长激素化学发光免疫分析测定试剂盒,其特征在于,所述的吖啶酯标记的GH抗体中,吖啶酯与GH抗体的摩尔比为(3-15):1。
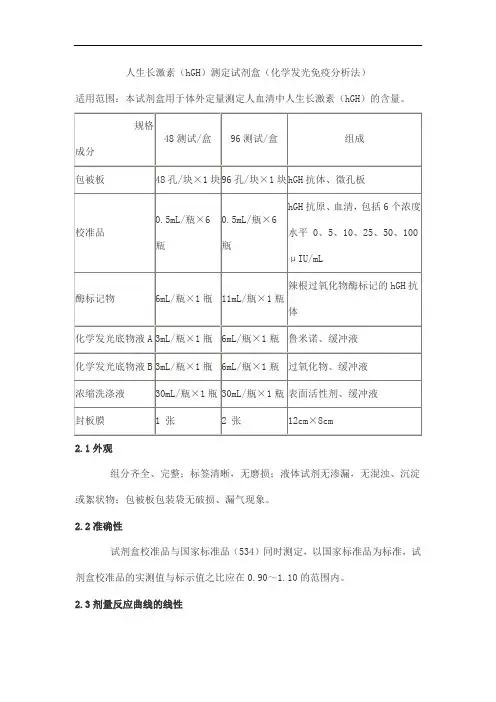
人生长激素(hGH)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人血清中人生长激素(hGH)的含量。
2.1外观
组分齐全、完整;标签清晰,无磨损;液体试剂无渗漏,无混浊、沉淀或絮状物;包被板包装袋无破损、漏气现象。
2.2准确性
试剂盒校准品与国家标准品(534)同时测定,以国家标准品为标准,试剂盒校准品的实测值与标示值之比应在0.90~1.10的范围内。
2.3剂量反应曲线的线性
用双对数数学模型拟合,在校准浓度范围(5~100mIU/mL)内,剂量反应曲线的相关系数r(绝对值)应不小于0.9900。
2.4 空白检出限
不大于0.5mIU /mL。
2.5 重复性
用低、高两个浓度水平的质控血清,各重复检测10次,其变异系数(CV)应满足:仪器自动操作法应不大于10.0%,手工操作法应不大于15.0%。
2.6 批间差
用三个批号试剂盒,分别检测同一质控血清,三个批号试剂盒之间的变异系数(CV)应不大于15.0%。
2.7质控血清测定值
质控血清测值应在允许的质控范围内(±2SD)。
2.8 稳定性
2℃~8℃保存,有效期12个月。

生长激素定量标记免疫分析试剂盒行业标准的验证于婷;曲守方;黄杰【期刊名称】《中国医学装备》【年(卷),期】2017(014)002【摘要】目的:制订生长激素(GH)定量标记免疫分析试剂盒行业标准,并采用该标准适用的化学发光标记、时间分辨荧光标记方法进行验证。
方法:选择GH磁微粒化学发光法、电化学发光法、化学发光法和时间分辨荧光分析法试剂盒,按照拟定的行业标准规定,对空白限、线性、准确度、精密度、特异性和稳定性项目进行验证。
结果:除部分试剂盒的准确度结果不能满足预期要求的±10%外,其余验证结果均能满足拟定行业标准中的要求。
结论:根据验证情况,将准确度要求调整至±15%,其余项目要求不变,最终确定GH定量标记免疫分析试剂盒行业标准。
该标准的制定,有助于统一GH定量标记免疫分析试剂盒的质量标准,为该类产品的研制、检验及上市后的监督管理提供依据。
【总页数】5页(P18-22)【作者】于婷;曲守方;黄杰【作者单位】中国食品药品检定研究院非传染病诊断试剂室卫生部生物技术产品检定方法及其标准化重点实验室北京 100050;中国食品药品检定研究院非传染病诊断试剂室卫生部生物技术产品检定方法及其标准化重点实验室北京 100050;中国食品药品检定研究院非传染病诊断试剂室卫生部生物技术产品检定方法及其标准化重点实验室北京 100050【正文语种】中文【中图分类】R446.62【相关文献】1.促甲状腺素定量标记免疫分析试剂盒行业标准的建立和验证 [J], 黄颖;于婷;李丽莉;高尚先2.总前列腺特异性抗原定量测定试剂盒(化学发光免疫分析法)的性能验证 [J], 方婉仙;李志雄;董志宁;李明;吴英松3.总Ig E定量标记免疫分析试剂盒行业标准的验证 [J], 孙楠;于婷;刘艳;王玉梅;高尚先4.游离β-HCG定量标记免疫分析试剂盒行业标准的建立和验证 [J], 于婷;孙楠;刘艳;王玉梅;黄杰;曲守方;黄颖5.胰岛素定量标记免疫分析试剂盒行业标准的建立和验证 [J], 于婷;沈舒;张春涛;黄颖因版权原因,仅展示原文概要,查看原文内容请购买。

马生长激素(GH)酶联免疫分析试剂盒使用说明书本试剂盒仅供研究使用预期应用ELISA法定量测定马血清、血浆或其它相关液体中生长激素(GH)含量。
实验原理本试剂盒应用双抗体夹心酶标免疫分析法测定标本中GH水平。
用纯化的抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入GH抗原、生物素化的抗马GH抗体、HRP 标记的亲和素,经过彻底洗涤后用底物TMB显色。
TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的GH呈正相关。
用酶标仪在450nm波长下测定吸光度(OD值),计算样品浓度。
试剂盒组成及试剂配制1.酶联板:一块(96孔)2.标准品(冻干品):2瓶,每瓶临用前以样品稀释液稀释至1ml,盖好后静置10分钟以上,然后反复颠倒/搓动以助溶解,其浓度为50ng/ml,做系列倍比稀释后,分别稀释50ng/ml,25ng/ml,12.5ng/ml,6.25ng/ml,3.12ng/ml,1.56ng/ml,0.78ng/ml,样品稀释液直接作为标准浓度0ng/ml,临用前15分钟内配制。
如配制25ng/ml标准品:取0.5ml50ng/ml的上述标准品加入含有0.5ml样品稀释液的Eppendorf管中,混匀即可,其余浓度以此类推。
3.样品稀释液:1×20ml/瓶。
4.检测稀释液A:1×10ml/瓶。
5.检测稀释液B:1×10ml/瓶。
6.检测溶液A:1×120ul/瓶(1:100)临用前以检测稀释液A1:100稀释,稀释前根据预先计算好的每次实验所需的总量配制(每孔100ul),实际配制时应多配制0.1-0.2ml。
如1ul检测溶液A加99ul检测稀释液A的比例配制,轻轻混匀,在使用前一小时内配制。
7.检测溶液B:1×120ul/瓶(1:100)临用前以检测稀释液B1:100稀释。
稀释方法同检测溶液A。
8.底物溶液:1×10ml/瓶。
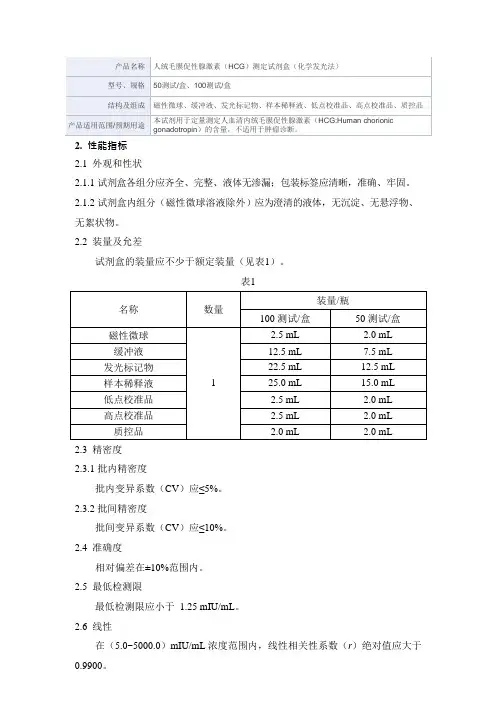

2. 性能指标
2.1 外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2 批内精密度
批内变异系数(CV)应≤8%。
2.3 批间精密度
批间变异系数(CV)应≤15%。
2.4 准确度
回收率应在(90.0%~110.0%)范围内。
2.5 空白限
空白限应≤0.020 ng/mL。
2.6 线性
在(0.100~25.0)ng/mL浓度区间内,线性相关性系数(r)绝对值应≥0.9900。
2.7 校准品均一性
校准品均一性(CV)应≤8%。
2.8 质控品测量准确度
质控品1测定结果应在[2.80~5.20] ng/mL范围内,质控品2测定结果应在[11.2~20.8]ng/mL范围内。
2.9 质控品均一性
质控品均一性(CV)应≤8%。
2.10 溯源性
本试剂盒校准品可以溯源至企业内部校准品。
第1页共1页。

化学发光免疫类体外诊断试剂(盒)产品技术审评规范(2017 版)本规范旨在指导注册申请人对化学发光免疫类体外诊断试剂(盒)产品注册申报资料的准备及撰写,同时也为技术审评部门对注册申报资料的技术审评提供参考。
本规范是对化学发光免疫类体外诊断试剂(盒)产品的一般要求,申请人应依据具体产品的特性对注册申报资料的内容进行充实和细化,并依据产品特性确定其中的具体内容是否适用。
本规范是对申请人和审查人员的指导性文件,但不包括注册审批所涉及的行政事项,亦不作为法规强制执行,如果有能够满足相关法规要求的其他方法,也可以采用,但需要提供详细的研究资料和验证资料。
应在遵循相关法规的前提下使用本规范。
本规范是在现行法规和标准体系以及当前认知水平下制定的,随着法规和标准的不断完善,以及科学技术的不断发展,本规范相关内容也将进行适时调整。
一、适用范围本规范适用于利用化学发光免疫分析技术对被测物质进行定量检测的第二类体外诊断试剂(包括以微孔板、管、磁颗粒、微珠和塑料珠等为载体的酶促及非酶促化学发光免疫分析测定试剂)的注册技术审查。
依据《体外诊断试剂注册管理办法》(国家食品药品监督管理总局令第 5 号,以下简称《办法》)、《食品药品监管总局关于印发体外诊断试剂分类子目录的通知》(食药监械管〔2013〕242 号)化学发光免疫类体外诊断试剂(盒)产品分类代号为 6840。
二、注册申报资料要求(一)综述资料综述资料主要包括产品预期用途、临床意义、产品描述、有关生物安全性的说明、研究结果的总结评价以及同类产品上市情况介绍等内容,应符合《办法》和《关于公布体外诊断试剂注册申报资料要求和批准证明文件格式的公告》(国家食品药品监督管理总局公告 2014 年第44 号)的相关要求。
(二)主要原材料研究资料(如需提供)主要原材料(例如各种天然抗原、重组抗原、单克隆抗体、多克隆抗体以及多肽类、激素类等生物原科,辣根过氧化物酶、碱性磷酸酶等标记用酶、磁微粒及其他主要原料)的选择、制备、质量标准及实验验证研究资料;校准品、质控品的原料选择、制备、赋值过程及试验资料;校准品的溯源性文件,包括具体溯源链、实验方法、数据及统计分析等详细资料。

小鼠生长激素(GH)Elisa试剂盒说明书本试剂盒仅供研究使用。
检测范围:96T1μg/L -32μg/L使用目的:本试剂盒用于测定小鼠血清、血浆、脑垂体样本中生长激素(GH)含量。
实验原理小鼠生长激素(GH)Elisa试剂盒说明书本试剂盒应用双抗体夹心法测定标本中小鼠生长激素(GH)水平。
用纯化的小鼠生长激素(GH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入生长激素(GH),再与HRP 标记的生长激素(GH)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的生长激素(GH)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠生长激素(GH)浓度。
试剂盒组成1 30 倍浓缩洗涤液20ml×1 瓶7 终止液6ml×1 瓶2 酶标试剂6ml×1 瓶8 标准品(64μg/L)0.5ml×1 瓶3 酶标包被板12 孔×8 条9 标准品稀释液1.5ml×1 瓶4 样品稀释液6ml×1 瓶10 说明书1 份5 显色剂A 液6ml×1 瓶11 封板膜2 张6 显色剂B 液6ml×1/瓶12 密封袋1 个标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3 的样品,因NaN3 抑制辣根过氧化物酶的(HRP)活性。
3.组织处理:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
离心20 分钟左右(2000-3000 转/分)。
仔细收集上清。
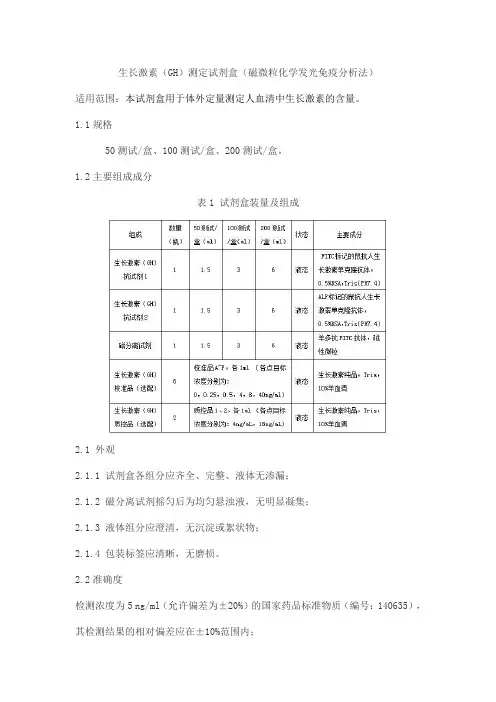
生长激素(GH)测定试剂盒(磁微粒化学发光免疫分析法)适用范围:本试剂盒用于体外定量测定人血清中生长激素的含量。
1.1规格50测试/盒、100测试/盒、200测试/盒。
1.2主要组成成分表1 试剂盒装量及组成2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后为均匀悬浊液,无明显凝集;2.1.3 液体组分应澄清,无沉淀或絮状物;2.1.4 包装标签应清晰,无磨损。
2.2准确度检测浓度为5 ng/ml(允许偏差为±20%)的国家药品标准物质(编号:140635),其检测结果的相对偏差应在±10%范围内;2.3空白检测限应不大于0.01 ng/ml。
2.4线性在(0.05,40)ng/ml的检测范围内,试剂盒的相关系数r应≥0.99。
2.5重复性用两个质控品作为样本各重复检测10次,其变异系数(CV)均应≤10%。
2.6质控品测值质控品检测结果均应在质控范围内。
2.7批间差用三个批号试剂盒分别检测质控品1和质控品2,两个质控品检测结果的批间变异系数(CV)均应≤15.0%。
2.8分析特异性将潜在交叉物质添加到含有18ng/ml(允许偏差为±15%)生长激素(GH)的基础样本中使其达到下表浓度,添加前后检测值偏差在±15%范围内,则认为本试剂盒与该物质没有明显交叉。
表2 潜在交叉物质浓度及交叉率要求2.9溯源性根据GB/T21415-2008及有关规定提供所用生长激素(GH)校准品的来源、赋值过程及测量不确定度等内容,溯源至生长激素(GH)国际参考物质(WHO98/574)。
2.10稳定性试剂盒2℃~8℃储存,避免阳光直射,有效期为12个月,取失效后两个月内的样品进行检测,应符合2.1~2.6的要求。


1 性能指标2.1外观和性状试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物;校准品应为清澈透明液体,无沉淀、无悬浮物、无絮状物。
分装瓶应为透明塑料管,盖有塑料外盖。
2.2装量应不少于试剂的标示装量值。
2.3准确度2.3.1将hGH 国家标准品配成两个浓度水平的样品,用待检试剂盒进行检测,其检测结果与标定靶值的相对偏差在±10%范围内。
2.3.2对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
2.4最低检测限应不大于0.02 ng/mL。
2.5线性试剂盒在0.03 ng/mL~50 ng/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性变异系数CV 应≤ 5%。
2.7批间差变异系数CV 应≤ 10%。
2.8校准品均一性2.8.1校准品瓶内均一性C0的标准差(SD)应不大于0.024ng/mL,C1和C2的变异系数(CV)应不大于8.0%。
2.8.2校准品瓶间均一性C0 的标准差(SD)应不大于0.02 ng/mL,C1 和C2 的变异系数(CV)应不大于5.0%。
2.9生物安全性使用国家权威管理机构认可的、且不低于我国法定用于血源筛查体外诊断试剂灵敏度的检测试剂,对校准品中乙型肝炎病毒表面抗原、人类免疫缺陷病毒抗体(HIV-I 型和HIV-II1型)、丙型肝炎病毒抗体、梅毒螺旋体抗体的检测应为阴性。
2.10稳定性2~8℃避光保存,试剂盒有效期为365 天。
到有效期后90 天内的试剂盒应符合2.1、2.3、2.4、2.5、2.6、2.8 的要求。
2。
生长激素检测标准操作规程一、目的:规范人生长激素测定的标准操作程序,确保人生长激素测定的结果准确有效。
二、适用范围:在AutoLumo A20化学发光检测仪上定量测定人血清中的人生长激素。
三、临床意义HGH是由垂体前叶细胞分泌的一种多肽激素,在人体内可以刺激生长和促进细胞增殖。
它是一个包含191个氨基酸的单链多肽激素,分子量为22124道尔顿。
由脑垂体前叶的生长激素细胞合成,储存和分泌[1]。
HGH病理性增高常见于:(1脑垂体腺瘤、癌或HGH分泌细胞增生;(2)脑垂体以外的组织分泌异源性HGH,如胰腺癌、支气管类癌等癌组织;(3)生长发育期HGH分泌过多导致巨人症,成人HGH分泌过多导致肢端肥大症。
HGH病理性降低常见于:(1冼天性HGH缺乏症,若不能及时治疗,多发展为侏儒症;(2)继发性HGH缺乏症,如肿瘤压迫、感染、手术、外伤等原因损伤下丘脑一垂体及其周围组织,致HGH分泌不足,此症可随发病年龄不同而轻重表现不同;(3)生长激素缺乏症又称垂体性侏儒症2-3]。
检测HGH在血清及血浆中的含量对诊断儿童HGH缺乏导致的生长迟缓,成人HGH过高导致的肢端肥大症具有重要的意义,同时可帮助诊断能引起HGH分泌异常的垂体肿瘤。
四、方法原理本试剂盒采用夹心法原理进行检测。
用HGH抗体包被磁微粒,辣根过氧化物酶标记HGH抗体制备酶结合物。
通过免疫反应形成抗体-抗原-酶标抗体复合物,该复合物催化发光底物发出光子,发光强度与HGH的含量成正比。
五、标本的采集与处理5.1.采用正确医用技术收集血清或血浆样本(血浆样本推荐使用肝素钠抗凝血浆,避免使用枸橼酸钠和EDTA抗凝剂)。
5.2.样本中的沉淀物和悬浮物可能会影响试验结果,应离心除去。
5.3.严重溶血、脂血或浑浊的样本不能用于测定。
5.4.样本收集后在室温放置不可超过8小时;如果不在8小时内检测需将样本放置在28C的冰箱中;若需48小时以上保存或运输,则应冻存于-20C以下,避免反复冻融。
小鼠生长激素(GH)Elisa试剂盒说明书本试剂盒仅供研究使用。
检测范围:96T1μg/L -32μg/L使用目的:本试剂盒用于测定小鼠血清、血浆、脑垂体样本中生长激素(GH)含量。
实验原理小鼠生长激素(GH)Elisa试剂盒说明书本试剂盒应用双抗体夹心法测定标本中小鼠生长激素(GH)水平。
用纯化的小鼠生长激素(GH)抗体包被微孔板,制成固相抗体,往包被单抗的微孔中依次加入生长激素(GH),再与HRP 标记的生长激素(GH)抗体结合,形成抗体-抗原-酶标抗体复合物,经过彻底洗涤后加底物TMB 显色。
TMB 在HRP 酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。
颜色的深浅和样品中的生长激素(GH)呈正相关。
用酶标仪在450nm 波长下测定吸光度(OD 值),通过标准曲线计算样品中小鼠生长激素(GH)浓度。
试剂盒组成1 30 倍浓缩洗涤液20ml×1 瓶7 终止液6ml×1 瓶2 酶标试剂6ml×1 瓶8 标准品(64μg/L)0.5ml×1 瓶3 酶标包被板12 孔×8 条9 标准品稀释液1.5ml×1 瓶4 样品稀释液6ml×1 瓶10 说明书1 份5 显色剂A 液6ml×1 瓶11 封板膜2 张6 显色剂B 液6ml×1/瓶12 密封袋1 个标本要求1.标本采集后尽早进行提取,提取按相关文献进行,提取后应尽快进行实验。
若不能马上进行试验,可将标本放于-20℃保存,但应避免反复冻融2.不能检测含NaN3 的样品,因NaN3 抑制辣根过氧化物酶的(HRP)活性。
3.组织处理:切割标本后,称取重量。
加入一定量的PBS,PH7.4。
用液氮迅速冷冻保存备用。
标本融化后仍然保持2-8℃的温度。
加入一定量的PBS(PH7.4),用手工或匀浆器将标本匀浆充分。
离心20 分钟左右(2000-3000 转/分)。
仔细收集上清。
人体生长激素hGH测定标准操作规程1 检验目的规范本实验室的检验操作,确保人体生长激素(hGH)检测结果及报告的准确性、可靠性和有效性。
2 标本采集与处理2.1 标本采集2.1.1 常规静脉采血约2ml,不抗凝,置普通试管中。
或采用含分离胶的真空采血管。
2.1.2 检验申请单和血标本试管标上统一且唯一的标识符(条码)。
2.1.3 急诊标本采集后,在检验申请单上填写标本采集时间。
2.1.4 标本采集后与检验申请单一起及时运送至检验科。
专人负责标本的接收并记录标本的状态,对不合格标本予以拒收。
2.1.5 下列标本为不合格标本2.1.5.1 标本量不足:少于0.3ml的全血标本,或少于0.1ml的血清或血浆。
2.1.5.2 对于测定和吸样有干扰的标本:如近期使用鼠源性单克隆抗体诊断后采取。
2.1.5.3 无法确认标本与申请单对应关系的。
2.1.5.4 其他如标识涂改、标本试管破裂等。
2.2 标本保存2.2.1 接收标本后在30min内将标本离心分离出血清, 避免溶血。
离心必须达到4000rpm×15min,离心后的血清中不能含有颗粒物或微量纤维蛋白。
2.2.2 标本保存时间:室温(15~25℃)下可稳定8h,普通冰箱中(2~8℃)稳定48h。
需较长时间保存应将血清存放于-20℃。
冰冻标本仅可冻融一次。
2.2.3 已完成测试的标本保持完整的识别号,置2~8℃冰箱内保存7d。
2.3 标本采集的注意事项2.3.1 采血前使受检者保持平静、松弛、避免剧烈活动。
2.3.2 采血后应使血液充分凝固,不建议使用抗凝的血液标本。
3 方法原理一步酶免法(“夹心法” )测定。
将样本与多克隆山羊抗hGH碱性磷酸酶结合物和包被着小鼠单克隆抗hGH 抗体的顺磁性微粒添加到反应管中。
血清或血浆(肝素) hGH和单克隆抗 hGH在固相上结合,而山羊抗hGH碱性磷酸酶结合物和血清或血浆hGH上的不同抗原位点反应。
在反应管内温育完成后,结合在固相上的物质将置于一个磁场内被吸住,而未结合的物质将被冲洗除去。
人生长激素(hGH)测定试剂盒(电化学发光免疫分析法)产品技术要求lianda人生长激素(hGH)测定试剂盒(电化学发光免疫分析法)组成:试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(hGH-Cal)(选配)组成。
组成及含量见下表:适用范围:本试剂盒用于体外定量测定人体血清样本中人生长激素(hGH)的含量。
2.1 外观2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮状物;2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限应不大于0.03 ng/mL。
2.3 准确度用hGH国家标准品(150534)进行检测,其测量结果的相对偏差应在±10%范围内。
2.4 线性在[0.10,50.0]ng/mL范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度2.5.1 重复性在试剂盒的线性范围内,测定高、低两个水平的样品,检测结果的变异系数(CV)应不大于8%。
2.5.2 批间差在试剂盒的线性范围内,用3个批号试剂盒分别检测浓度为高、低两个水平的样品,检测结果的变异系数(CV)应不大于15%。
2.6特异性测定浓度不低于2000mIU/L的泌乳素样本,其测定结果不大于0.5ng/ml。
2.7效期末稳定性本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.8 溯源性依据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》的要求提供人生长激素(hGH)定标品的来源、赋值过程以及测量不确定度等内容,定标品溯源至国家标准品(150534)。
新产业生物肿瘤标记物试剂说明书一、引言本说明书旨在详细介绍新产业生物肿瘤标记物试剂的性质、用途、使用方法以及注意事项等内容,以便用户正确、有效地使用该试剂。
请在使用前仔细阅读本说明书,并按照指导操作,以确保实验结果的准确性和可靠性。
二、产品描述新产业生物肿瘤标记物试剂是一种专为肿瘤标记物检测而设计的试剂,主要用于体外诊断分析。
该试剂具有以下特点:1. 高灵敏度:新产业生物肿瘤标记物试剂能够对微量标记物进行高效检测,提高实验结果的准确性。
2. 特异性:该试剂具有良好的特异性,可以有效区分目标标记物与其他非目标物质,减少误判。
3. 稳定性:新产业生物肿瘤标记物试剂具有较长的保存期限,而且在适当的储存条件下仍能保持较高的活性。
三、使用方法1. 样本准备:准备待检测的肿瘤样本,保证样本的纯度,避免污染或稀释对实验结果产生干扰。
2. 试剂配制:按照说明书中提供的浓度比例,将试剂配制好,注意避免操作过程中的交叉污染。
3. 样本处理:将待检测样本与试剂按照指导操作进行混合,保证充分反应。
4. 实验操作:根据试剂说明书中提供的实验步骤,进行相应的操作,如温度控制、反应时间等。
5. 结果读取:根据试剂说明书中提供的读取方法,使用合适的检测仪器读取实验结果,并记录相应数据。
四、注意事项1. 请在试剂有效期内使用,过期试剂可能影响实验结果的准确性。
2. 操作时请戴好实验手套,避免试剂接触皮肤或被误吸入。
3. 请按照指导操作进行实验,避免操作步骤或条件的随意更改,以免影响结果。
4. 操作结束后,请及时清理实验仪器和试剂,避免交叉污染。
5. 请遵循国家相关法律法规和实验室安全规范,确保实验过程的安全性。
五、结果解读根据实验结果的值与标准值之间的差异,能够判断样本中是否存在目标标记物。
请参考相关文献或专业人士的建议,结合临床信息进行综合分析和解读。
六、保存方法1. 新产业生物肿瘤标记物试剂应在2-8摄氏度下保存,避免阳光直射和高温。