化学发光法-定量试剂盒
- 格式:pdf
- 大小:3.31 MB
- 文档页数:37


化学发光法生物素标记核酸检测试剂盒产品编号 产品名称包装 D3308化学发光法生物素标记核酸检测试剂盒1000cm 2产品简介:化学发光法生物素检测试剂盒(Chemiluminescent Biotin-labeled Nucleic Acid Detection Kit)是一种通过Streptavidin-HRP 及后续的BeyoECL Moon 试剂来实现化学发光检测Biotin 标记核酸的检测试剂盒。
适用于Southern blot 、Northern blot 、ribonuclease protection assay (RPA)或EMSA 等实验中,采用生物素标记的DNA 或RNA 探针时的检测。
本试剂盒不适用于生物素标记蛋白的检测。
本试剂盒同时还提供了封闭液、洗涤液等检测时所需的配套试剂。
本试剂盒采用了高质量的Streptavidin-HRP Conjugate ,HRP 和Streptavidin 共价交联的比例大于3,这样比采用Streptavidin 和Biotin-HRP conjugate 两种试剂进行检测要更方便,并且灵敏度更高。
采用了非特异性结合比avidin 更低的strepatavidin ,使检测结果背景更低灵敏度更高。
本试剂盒没有提供生物素探针标记相关的试剂,生物素标记的DNA 探针或EMSA 探针的制备可以相应地使用碧云天生产的生物素3'末端DNA 标记试剂盒(D3106)或EMSA 探针生物素标记试剂盒(GS008)。
本试剂盒可以用于检测至少10块10×10cm 有生物素标记EMSA 探针的膜,即共1000cm 2。
包装清单:产品编号 产品名称包装 D3308-1 BeyoECL Moon A 液 55ml D3308-2 BeyoECL Moon B 液 55ml D3308-3 Streptavidin-HRP Conjugate100µl D3308-4 封闭液 380ml D3308-5 洗涤液(5X)250ml D3308-6检测平衡液 250ml —说明书1份保存条件:D3308-3 Streptavidin-HRP Conjugate 在-20ºC 保存,其余可4ºC 保存。

动物细胞β-半乳糖苷酶活性化学发光法定量检测试剂盒产品说明书(中文版)主要用途动物细胞β-半乳糖苷酶活性化学发光法定量检测试剂是一种旨在使用化学方法,快速有效地裂解动物细胞,通过高速离心,获得澄清细胞裂解悬液,在β-半乳糖苷酶反应体系里,以人工合成的二恶二酮类化合物作为发光底物,水解所产生的发光产物,通过发光探测仪(Luminometer)测定其相对冷光单位(RLU)的变化,以此进行测算酶活性的权威而经典的技术方法。
该技术经过精心研制、成功实验证明的。
广泛应用于基因组学、蛋白质组学和其它分子生物学研究。
其适用于转基因后的活体细胞外源性以及衰老细胞内源性半乳糖苷酶活性分析。
产品即到即用,性能稳定,参数优化,操作简便、高度敏感。
技术背景大肠杆菌的标志基因Lac Z编码β-半乳糖苷酶(β-galactosidase ;β-gal),在其催化作用下,半乳糖可从乳糖的水解作用中得到。
β-半乳糖苷酶非常稳定,对蛋白水解降解作用抗性强,且容易测试。
因此β-半乳糖苷酶成为目前最常用的报告基因,以评价载体转染的效果。
在衰老细胞内,显示β-半乳糖苷酶活性。
甲氧基二恶二酮氯代金刚烷苯基吡喃半乳糖苷(3- (4-methoxyspiro [1, 2-dioxetane-3, 2'- (5'-chloro) tricyclo [3.3.1.13,7]-decan]-4-yl-phenyl -ß-D-galacto pyranoside),是一种二恶二酮(dioxetane)类发光底物,以替代乳糖,在β-半乳糖苷酶(pH7.8)的催化下,去糖基化后,产生二恶二酮,进而在多聚苯甲基乙烷乙烯基苯甲氯化铵和荧光素钠(poly (benzyldimethylvinylbenzyl) ammonium chloride and sodium fluorescein)的启动反应作用下,同时pH调整到12,由此二恶二酮分解,发出冷光,在冷光仪(475nm波长)下,检测发光信号,来测定β-半乳糖苷酶的活性。

化学发光生产线化学发光法定量测定试剂盒检验方法学验证方案目录1.概述 (3)2.目的 (3)3.职责划分 (3)4.法规和国家标准 (4)5.术语和定义 (4)7.验证过程 (5)7.1相关文件确认 (5)7.2仪器和器具确认 (5)7.3验证项目及质量可接受标准 (5)7.4验证的实施 (5)7.4.1溯源性 (5)7.4.2准确度 (6)7.4.3最低检测限 (6)7.4.4线性 (6)7.4.5重复性 (6)7.4.6批间差 (7)7.5验证结果 (7)8.验证周期 (8)9.偏差处理 (8)10.验证总结果的分析与评价 (8)一、验证方案1.概述化学发光生产线的生产的各定量测定试剂盒的检定内容主要包括:肉眼检查外观;溯源性,准确度,最低检测限,线性,重复性,批间差,稳定性,生物安全性和定标品的均一性。
检定的内容的确定参考了行标《肿瘤标志物定量测定试剂盒(盒)化学发光法》YY/T1175-2010。
在产品的研发过程中,行标中的各项标准构成了研发项目的主要输入输出内容,并经过反复确认(verification)。
按照化学发光生产线验证主计划的要求,在产品进行批量生产时,对产品质检的内容需要再进行一次全面的验证(validation),以建立稳定的产品质量控制体系。
2.目的对化学发光法测定试剂盒产品的检验方法学中各主要检验项目进行验证,包括溯源性,准确度,最低检测限,线性,重复性和批间差。
3.职责划分3.1生产部负责验证方案的制定和方案实施的日程安排,验证方案的具体实施、原始数据的采集和整理。
3.2研发部参与验证方案的编写,参与验证方案的审批及验证结果的评审。
3.3质控部抽调人员参加验证小组,参与验证方案的编写,负责验证过程中检测项目的检定,参与验证方案的审批及验证结果的评审。
3.4质保部抽调人员参加验证小组,参与验证方案的编写,监督验证方案的实施、核对数据、编制验证报告和验证档案的管理,参与验证方案的审批及验证结果的评审。

精子细胞氧化应激活性氧(ROS)鲁米诺化学发光法定量检测试剂盒产品说明书(中文版)主要用途精子细胞氧化应激活性氧(ROS)鲁米诺化学发光法定量检测试剂是一种旨在通过自由基探针鲁米诺和强化剂的参与下,精子细胞中的活性氧族使发光物氧化降解并发光,在化学发光仪(Luminometer)的帮助下定量检测精子细胞活性氧族(过氧化氢)的生成和数量的权威而经典的技术方法。
该技术由大师级科学家精心研制、成功实验证明的。
适用于动物和人体精子细胞的活性氧族的检测。
可以被用于细胞凋亡、衰老、代谢和营养学,以及发育生物学(男性不育)等的研究。
产品严格无菌,即到即用,操作简易,性能稳定,检测敏感。
技术背景超氧自由基阴离子(superoxide radical;O2-)、过氧化氢(hydrogen peroxide;H2O2)、羟自由基或氢氧基(hydroxyl radical;OH-)、过氧化基(peroxyl radical;ROO-)、氢过氧自由基(hydroperoxyl;HOO)、烷氧自由基(alcoxyl radical)、氮氧基(nitric Oxide;NO-)、过氧亚硝基阴离子(peroxynitrite anion;ONOO-)次氯酸(hypochlorous acid;HOCl)、半醌自由基(semiquinone radical)、单线态氧气(singlet oxygen)等细胞内活性氧族(Reactive Oxygen Species;ROS)的产生和增多,甚而导致诸如男性不育、冠心病、风湿性关节炎、肿瘤、退行性病变等各种病理状况。
鲁米诺(luminol),又称氨基邻苯二甲酰肼(luminol;3-aminophthalic hydrazide 5-amino-2,3-dihvdro- 1,4-phthalazinedione),是一种脂溶性的发光剂,氧化后生成鲁米诺自由基而化学发光,具有460nm左右峰值的带状光谱,肉眼可观察到鲜明的紫蓝色。

C肽测定试剂盒(化学发光免疫分析法)适用范围:该产品用于体外定量测定人血清样本中C肽的含量。
1.1包装规格48人份/盒、96人份/盒1.2主要组成成分表1 产品主要组成成分2.1物理性状2.1.1外观试剂盒外观整洁,标识清晰。
试剂盒的各液体组分应澄明,无沉淀或絮状物。
包被抗体微孔板的真空袋,应无破损现象。
2.1.2装量试剂装量不少于标示值。
2.2 准确度试剂盒校准品与C-肽国家标准品同时测定,以国家标准品为对照品,试剂盒校准品的实测值与标示值之比应在0.90~1.10的范围内。
2.3线性在[1,15] ng/ml的范围内, 用双对数模型拟合,线相关系数应不低于0.9900。
2.4 空白限不大于0.3ng/ mL。
2.5精密度2.5.1 分析内精密度(CV)应小于15.0%。
2.5.2批间精密度(CV)应小于20%2.6 分析特异性检测含有干扰物质(详见表2)的阴性样本3次,检测结果应不大于0.3ng/ mL。
表2 被测物常见的交叉反应源2.7溯源性应根据GB/T21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》提供所有校准品的来源、赋值过程以及测量不确定度等内容,校准信息可溯源至本公司工作校准品,工作校准品与已上市试剂盒比对赋值。
2.8稳定性2~8℃保存,有效期6个月。
性能指标符合2.1~2.4、2.5.1、2.6的要求。
2.9冻干品均一性冻干品的瓶间差应小于15.0%。
2.10冻干品的复溶稳定性冻干品复溶后,2~8℃保存,有效期3天,性能符合2.3、2.4、2.6的要求。
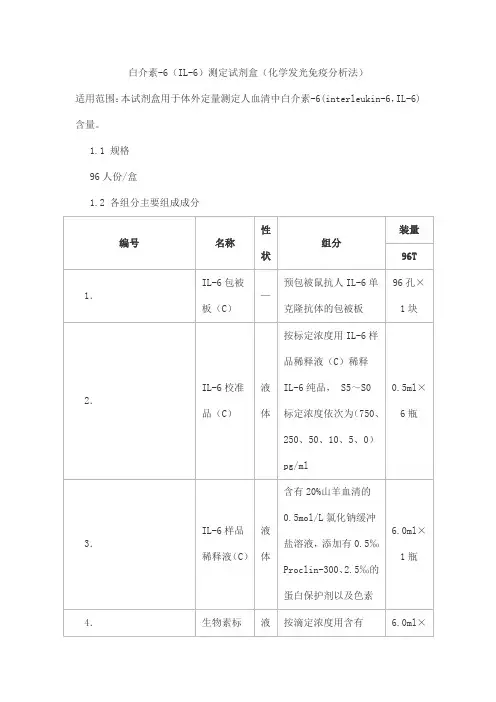
白介素-6(IL-6)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人血清中白介素-6(interleukin-6,IL-6)含量。
1.1 规格
96人份/盒
1.2 各组分主要组成成分
本试剂盒校准品可溯源至NIBSC/WHO IL-6 International Standard。
2.1外观
试剂盒应组分齐全,内外包装均应完整,标签清晰,液体试剂无渗漏。
2.2空白检出限
空白检出限浓度应不高于1.0pg/ml。
2.3线性范围
在[2~1500]pg/ml区间内,线性相关系数(r)应不低于0.9900。
2.4精密度
2.4.1重复性
变异系数CV应不超于10%。
2.4.2 批间差
变异系数CV应不超于15%。
2.5准确度
用NIBSC/WHO IL-6 International Standard标准品对试剂盒进行测试,相对偏差(B)应
不超过20%。
2.6质控品测定值
试剂盒内配备的质控品,其测定结果均值应在试剂盒质控品标识范围内。
2.7分析特异性/干扰
测定按表1所示规定浓度的IL-1α、血红蛋白、甘油三酯的样本,检测结果应不超过
6.4pg/ml。
表1:分析特异性/干扰物质及浓度列表
2.8稳定性
试剂盒在2~8℃储存条件下的有效期为8个月,试剂盒在规定的条件下保存至有效期
末,检验结果应符合2.1、2.2、2.3、2.4.1、2.5、2.6规定。

C肽(C-P)测定试剂盒(化学发光免疫分析法)适用范围:用于体外定量测定人体血清中C肽的含量。
1.1包装规格96人份/盒、48人份/盒。
1.2 产品主要组成成分校准品和质控品浓度具有批特异性,具体浓度见标签。
2.1 外观所有液体组分应齐全、澄清,无沉淀或絮状物;包被抗体微孔板的真空袋,应无破损漏气现象;校准品和质控品均为冻干粉按规定复溶后所得液体应无沉淀和不溶物质;包装完好,液体无渗漏;中文包装标签清晰,无磨损。
2.2 空白限应不高于0.1ng/mL。
2.3准确度用国家标准品(编号:150553)进行检测,其相对偏差应在±15%范围内。
2.4线性在[0.5,15]ng/mL测量范围内,相关系数R≥0.9900。
2.5 重复性变异系数(CV)应不大于10%。
2.6 批内瓶间差批内瓶间差应不大于10%。
2.7 批间差变异系数CV应不大于15%。
2.8特异性2.8.1 含浓度不低于10ng/mL人胰岛素原的零浓度C-P样本,测值应不高于0.1ng/mL;2.8.2 含浓度不低于200μIU/mL人胰岛素的零浓度C-P样本,测值应不高于0.1ng/mL。
2.9 复溶稳定性将校准品、质控品冻干粉复溶后,在4℃的贮存条件下保存5天,对5天后的复溶液用国家标准品(编号:150553)建标曲后进行检测,其浓度偏差应不大于±5%。
2.10 稳定性试剂盒在2℃~8℃的贮存条件下保存至有效期(12个月)后,测定结果应符合2.1~2.6、2.8、2.9项的要求。
2.11校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品可溯源至国家标准品(编号:150553)。
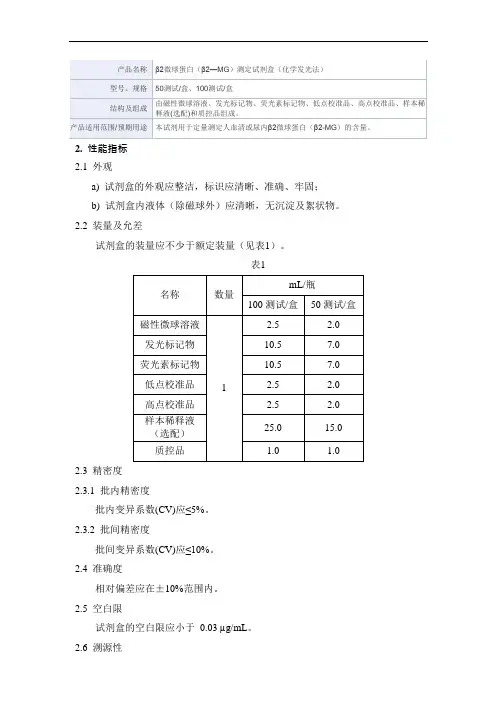

2. 性能指标
2.1 外观和性状
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;试剂盒内组分(磁性微球除外)应为澄清的液体,无沉淀、无悬浮物、无絮状物。
2.2 批内精密度
批内变异系数(CV)应≤8%。
2.3 批间精密度
批间变异系数(CV)应≤15%。
2.4 准确度
回收率应在(90.0%~110.0%)范围内。
2.5 空白限
空白限应≤0.500 pg/mL。
2.6 线性
在(1.500~5000)pg/mL浓度区间内,线性相关性系数(r)绝对值应≥0.9900。
2.7 校准品均一性
校准品均一性(CV
)应≤8%。
均一性
2.8 质控品预期结果
质控品1每次测定结果应在(28.0~52.0)pg/mL范围内,质控品2每次测定结果应在(175~325)pg/mL范围内。
2.9 质控品均一性
质控品均一性(CV
)应≤8%。
均一性。
心肌肌钙蛋白I(cTnI)测定试剂盒(化学发光法)适用范围:本试剂盒用于体外定量测定人血清或血浆中心肌肌钙蛋白I(cTnI)的含量。
分说明1.1 包装规格96人份/盒1.2 主要组成成分表1 主要组成成分备注:校准品溯源至美国国家标准与技术研究院(National Institute of Standards and Technology,NIST)颁布的有证标准参考物质(SRM 2921),校准品(A~F)目标浓度为0、0.5、1.4、4.0、18.0、45.0ng/ml。
2.1 外观组分齐全、完整,液体无渗漏,微孔板包装袋无破损、漏气现象;包装标签应清晰,易识别。
2.2 装量液体装量应不少于标示值。
2.3 准确度在剂量反应曲线检测范围内,用已知浓度的纯品(源自Hytest公司)做回收试验,其回收率应在85~115%范围内。
2.4 线性在线性范围[0.25,45]ng/ml内,剂量反应曲线相关系数(r)的绝对值应不低于0.9900。
2.5 空白限应不大于0.25ng/ml。
2.6 重复性同一次试验中分别重复检测浓度值为1.35±0.33ng/ml、18.83±3.78ng/ml样本10次,其变异系数(CV)应不大于10.0%。
2.7 批间差用3个批号的试剂盒检测浓度值为1.35±0.33ng/ml、18.83±3.78ng/ml样本,3个批号试剂盒之间的批间变异系数(CV)应不大于15.0%。
2.8 分析特异性测定浓度为1000ng/ml 心肌肌钙蛋白C(Cardiac Troponin C,cTnC),交叉反应率小于0.05%。
测定浓度为1000ng/ml 心肌肌钙蛋白T(Cardiac Troponin T,cTnT),交叉反应率小于0.05%。
测定浓度为1000ng/ml 骨骼肌肌钙蛋白I(Skeletal Troponin I,sTnI),交叉反应率小于0.05%。
雌二醇化学发光免疫检测试剂盒使用说明书( 美国DRG 编号: CLA-4664 规格:96T)企业名称:德国DRG诊断设备有限公司地址:德国玛堡市斐恩贝塔思路18号1简介1.1预期用途此DRG 化学发光免疫检测试剂盒可用于血清和血浆中雌二醇的体外定量检测.1.2前言(略)2实验原理此CLIA检测试剂盒采用化学发光免疫检测法,基于竞争法原理.微孔内预先包被有兔抗雌二醇分子特性性结合位点的多克隆抗体.患者样本中内源性雌二醇与辣根过氧化物酶(HRP)标记的雌二醇(酶联物)竞相与预包被的抗体结合。
孵育后,洗板洗去未结合的酶联物.结合的过氧化酶复合物(酶联物)与患者样本中雌二醇的量成反比.加入底物液后,发射光的强度与样本中雌二醇的浓度成反比3注意事项1.试剂盒仅供体外诊断用2.试剂盒相关有害物质的信息请参阅物料安全数据单(MSMD)3.试剂盒中的所有试剂包括人血清/血浆对HIV/II,HbsAg和HCV已检测为阴性,但所有的试剂在使用和处理的过程中都应当作潜在生物有害物质进行处理4.勿用嘴移液,同时避免样品和试剂接触皮肤和试剂.5.实验区内禁止饮食,化妆6.处理试剂和样品时应戴一次性手套。
微生物污染可能会导致结果失败7.按照相应的国家生物安全管理条理进行操作8.不要使用过期的试剂,有效期见试剂标签9.所有试剂的量都应按说明来,使用校正的移液器和发光仪可得到最佳的结果10.发光底物液(试剂A和试剂B)对光感染,应避光瓶装保存.11.不要混合使用不同批次的试剂、板条,即使是同一批次不同板条的也不建议。
试剂盒的运输和贮存环境不同可能会导致结果有轻微的变化12.化学物质、即用试剂或稀释试剂,需根据相关国家生物危害安全条例或规范,视为潜在有害物质处理。
13.产品的物料安全数据单(MSMD)可直接向DRG索取。
物料安全数据单(MSMD)符合EU-Guideline 91/155 EC4试剂盒组成4.1提供的试剂1.微孔板,12x8(可拆),96孔包被有抗雌二醇抗体(兔多抗)2.标准品,(标准品0-5),6瓶,1ml,即用浓度为:0 – 25 – 100 – 250 – 500 - 1000 pg/mL单位换算: 1 pg/mL = 3.67 pmol/L含0.3% Proclin、0.005%硫酸庆大小诺霉素作防腐剂3.酶联物,1瓶, 12 mL,即用辣根过氧化物酶(HRP)标记雌二醇含0.3% Proclin、0.015% BND、0.010% MIT作为防腐剂4.化学发光底物液试剂A,1瓶,2ml,注意:光敏感试剂B,1瓶,2ml,注意:光敏感试剂C,1瓶,3ml见“试剂准备”5.洗涤液,1瓶,30ml,(40倍浓缩)见“试剂准备提示:额外的样品稀释液向DRG公司另购4.1.1实验所需器材(但本试剂盒没有提供)1.化学发光仪2.各种规格的标准精密移液管3.吸水纸4.蒸馏水或去离子水4.2存储条件及稳定性未开封的试剂在2-8℃下可保存至有效期,不要使用过期的试剂打开的试剂必须保存在2-8℃,微孔板也必须保存于2-8℃,一旦打开了微孔板的袋子,需小心地将其重新密封开封的试剂盒如按以上描述的贮存条件可保存2个月4.3试剂准备使用前,将所有试剂和所需微孔板平衡至室温洗涤液加30 mL浓缩洗涤液至1170 mL 去离子水中,制成总体积为1200 mL的稀释洗涤液。
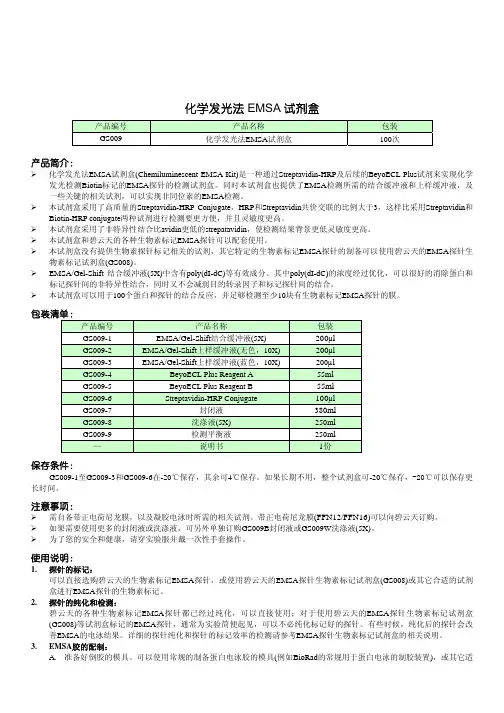
化学发光法 EMSA 检测试剂盒Chemiluminescent EMSA Detection Kit说明书修订日期: 说明书修订日期:2015.12.01 货号:KGS133 保存温度:-20℃ For Research Use Only一、产品简介 本产品是一种通过 Streptavidin-HRP 及 ECL 检测试剂来实现化学发光检测 Biotin 标记的 EMSA 探针 的检测试剂盒。
同时本试剂盒也提供 EMSA 检测所需的结合缓冲液和上样缓冲液, 及一些关键的相关试剂, 可以实现非同位素的 EMSA 检测。
本试剂盒采用了高质量的 Streptavidin-HRP Conjugate,HRP 和 Streptavidin 共价交联的比例大于 3, 这样比采用 Streptavidin 和 Biotin-HRP conjugate 两种试剂进行检测要更方便,并且灵敏度更高。
本试剂盒采用了非特异性结合比 avidin 更低的 strepatavidin,使检测结果背景更低灵敏度更高。
EMSA/Gel-Shift 结合缓冲液(5X)中含有 poly(dI-dC)等有效成分。
其中 poly(dI-dC)的浓度经过优化, 可以很好的消除蛋白和标记探针间的非特异性结合,同时又不会减弱目的转录因子和标记探针间的结合。
本试剂盒可以用于 20 个蛋白和探针的结合反应, 并足够检测至少 2 块有生物素标记 EMSA 探针的膜。
二、组份列表 产品组份 EMSA/Gel-Shift 结合缓冲液(5X) EMSA/Gel-Shift 上样缓冲液(无色,10X) EMSA/Gel-Shift 上样缓冲液(蓝色,10X) ECL Reagent A ECL Reagent B Streptavidin-HRP Conjugate 封闭液 洗涤液(5X) 检测平衡液 规格( 规格(50T) 100µl 100µl 100µl 28ml 28ml 50µl 190ml 125ml 125ml 保存温度 -20℃ -20℃ -20℃ 4℃ 4℃ -20℃ 4℃ 4℃ 4℃注:如果长期不用,整个试剂盒可-20℃保存,-20℃可以保存更长时间。