影响化学平衡移动的因素及图像问题(学案)
- 格式:doc
- 大小:376.87 KB
- 文档页数:11

1. 浓度对平衡的影响
2. 压强对平衡的影响 aA (g) + bB (g) = cC (g) + dD (g)
3.温度对平衡的影响
4、催化剂对平衡的影响 【练习】
增大反应物浓度
增大生成物浓度
减小反应物浓度
减小生成物浓度
生
C 生
平衡向 移动
平衡向 移动
平衡向 移动
平衡向 移动 平衡向 移动
平衡向
移动
平衡向 移动
a+b>c+d
平衡向 移动
a+b<c+d
平衡向 移动
a+b>c+d
平衡向
移动
a+b<c+d
平衡向 移动
a+b=c+d
平衡向
移动
a+b=c+d
增大压强 减小压强
降低温度 放热反应 △H 0
放热反应 △H 0 吸热反应 △H 0
吸热反应 △H 0
加入正催化剂
平衡向 移动
平衡向 移动
0aA (g) + bB (g) = cC (g) + dD (g) △H < 0
且a+b<c+d
123。

影响化学平衡因素一、影响化学平衡因素及v-t图:1、影响化学平衡因素_________ __________ _______ _______2、v-t图: 1)其他条件不变,只改变浓度:增大反应物浓度:υ正瞬时___________,υ逆___________,υ正_____υ逆,一段时间后:υ正____,υ逆____,υ正_____υ逆,平衡向方向移动最终:υ正_____υ逆,达到_________状态。
小结:其他条件不变,增大反应物浓度,平衡将向____ ____方向移动,减小反成物浓度,平衡将向____ ____方向移动。
图像:(v-t)2)其他条件不变,只改变压强:例如:2SO2+ O2≒2SO3,增大压强:υ正瞬时___________,υ逆___________,υ正_____υ逆,一段时间后:υ正_____,υ逆_____,υ正____υ逆,平衡向方向移动最终:υ正_____υ逆,达到_________状态。
小结:其他条件不变,增大压强,平衡将向____ ____方向移动,减小压强,平衡将向____ ____方向移动。
图像:(v-t)若反应前后气体总体积相等图像:(v-t)2(g)+I2(g)3)其他条件不变,只改变温度:例如:2SO2+ O2≒2SO3, (正反应为放热反应)升高温度:υ正瞬时___________,υ逆___________,υ正_____υ逆,一段时间后:υ正_____,υ逆_____,υ正_____υ逆,平衡向方向移动最终:υ正_____υ逆,达到_________状态。
小结:其他条件不变,升高温度,平衡将向____ ____方向移动,降低温度,平衡将向____ ____方向移动。
图像:(v-t)4)其他条件不变,只改变催化剂:催化剂瞬间:υ正瞬时_______,υ逆瞬时_______,程度______υ正_____υ逆,化学平衡_________改变。
小结:其他条件不变,只加催化剂:平衡__ _移动。

化学平衡移动中图像变化分析导学案滦平一中化学组:李春荣教学目标:学会解读图像的方法能力目标:通过本节的学习,提高学生的视图能力复习回顾1、温度改变时,化学平衡怎样移动?升高温度,平衡向方向移动;降低温度,平衡向方向移动。
2、浓度改变时,化学平衡如何移动?若Q<K,化学平衡移动;若Q=K,化学平衡移动若Q>K,化学平衡移动3.压强对化学平衡的影响∆Vg = 0,改变压强,化学平衡不移动∆Vg <0,增大压强,化学平衡向气态物质系数的方向移动∆Vg >0,减小压强,化学平衡向气态物质系数的方向移动适用条件:只适用于有气体参与的反应4、惰性气体对化学平衡的影响充入“惰性气体”: a 恒压当成“”,向气体系数和增大方向移动;b 恒容速率不变,平衡不移动5、催化剂对化学平衡的影响催化剂对正逆反应速率影响的程度是等同的,所以使用催化剂只能影响达到平衡的时间并不能使化学平衡发生移动※有关图象问题,可按以下的方法进行分析:①认清坐标系,搞清纵、横坐标所代表的意义,并与勒夏特列原理挂钩。
②紧扣可逆反应的特征,搞清正反应方向是吸还是放热,体积增大还是减小、不变,有无固体、纯液体物质参加或生成等。
③看清速率的变化及变化量的大小,在条件与变化之间搭桥。
④看清起点、拐点、终点,看清曲线的变化趋势。
⑤先拐先平。
例如,在转化率-时间图上,先出现拐点的曲线先达到平衡,此时逆向推理可得该变化的温度高、浓度大、压强高。
⑥定一议二。
当图象中有三个量时,先确定一个量不变再讨论另外两个量的关系。
一、浓度—时间图:例:(1)写出化学反应方程式:(2)求反应物的转化率:练:(1)写出化学反应方程式:(2)求反应物的转化率:浓度-----时间图像的关键:1、何为反应物、生成物;2、反应物、生成物计量数关系;3、是否为可逆反应例题1.今有正反应放热的可逆反应,若反应开始经t1s后达平衡,在t2s时由于反应条件改变,使平衡破坏,到t3s时又达平衡,如右图所示,(1)该反应的反应物是______(2)该反应的化学方程式为_________________(3)分析从t2到t3时曲线改变的原因是()A.增大了X或Y的浓度B.使用了催化剂C.缩小体积,使体系压强增大D.升高了反应温度二、速度—时间图像:1、已知引起平衡移动的因素,判断反应是吸热或放热,反应前后气体体积的变化。


2.2.2 影响化学平衡的因素(学案)1.掌握浓度、温度、压强等条件对化学平衡移动的影响。
2.能够画出简单的化学反应速率和平衡移动的图形、图表。
3.理解勒夏特列原理的涵义。
1.浓度、温度、压强等条件对化学平衡移动的影响对正逆反应速率影响不同的因素是___________、___________、___________。
一、化学平衡的移动1、定义在一定条件下,可逆反应达到化学平衡状态,如果改变影响平衡的条件(如___________、___________、___________等),化学平衡状态被破坏,直至正、逆反应速率___________,在新的条件下达到新的化学平衡状态。
这种现象称作平衡状态的移动,简称平衡移动。
2、平衡移动的原因化学平衡的根本特征为___________,因此化学平衡移动的根本原因为V(正)≠V(逆),平衡移动的方向根据V(正)、V(逆)的相对大小来决定。
当V(正)>V(逆)时则向___________方向移动V(正)<V(逆)时则向___________方向移动V(正)=V(逆)时则___________平衡移动的结果是Vˋ(正)______Vˋ(逆),达到新的化学平衡。
二、浓度、压强对化学平衡移动的影响1、浓度变化对化学平衡移动的影响规律(1)增大反应物浓度或减小生成物浓度,平衡向___________方向移动。
(2)减小反应物浓度或增大生成物浓度,平衡向___________方向移动。
若其他条件不变,一次性改变浓度对化学平衡的影响如下表所示:、压强变化对化学平衡移动的影响规律(1)针对有气体参加或有气体生成且反应前后气体体积发生变化的可逆反应而言(2若其他条件不变,压强对化学平衡的影响如下表所示:3、温度对化学平衡移动的影响升高温度,平衡向______反应方向移动;降低温度,平衡向______反应方向移动。
4、催化剂对化学平衡的影响a加入催化剂可以大大地加快化学反应速率,是因为它可以降低反应的活化能,从而提高活化分子百分数,从而增大反应速率,但是由于催化剂能够___________地改变正、逆反应速率,因此它对化学平衡移动___________。
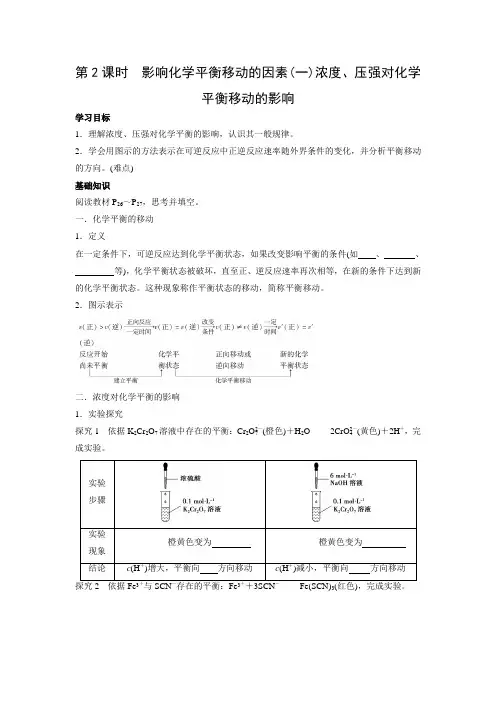
第2课时影响化学平衡移动的因素(一)浓度、压强对化学平衡移动的影响学习目标1.理解浓度、压强对化学平衡的影响,认识其一般规律。
2.学会用图示的方法表示在可逆反应中正逆反应速率随外界条件的变化,并分析平衡移动的方向。
(难点)基础知识阅读教材P26~P27,思考并填空。
一.化学平衡的移动1.定义在一定条件下,可逆反应达到化学平衡状态,如果改变影响平衡的条件(如、、等),化学平衡状态被破坏,直至正、逆反应速率再次相等,在新的条件下达到新的化学平衡状态。
这种现象称作平衡状态的移动,简称平衡移动。
2.图示表示二.浓度对化学平衡的影响1.实验探究探究1依据K2Cr2O7溶液中存在的平衡:Cr2O2-7(橙色)+H2O2CrO2-4(黄色)+2H+,完成实验。
实验步骤实验橙黄色变为橙黄色变为现象结论c(H+)增大,平衡向方向移动c(H+)减小,平衡向方向移动探究2依据Fe3+与SCN-存在的平衡:Fe3++3SCN-Fe(SCN)3(红色),完成实验。
实验(1)步骤现象溶液颜色变溶液颜色变实验(2) 步骤向试管①中滴加0.01 mol·L-1NaOH溶液向试管②中滴加0.01 mol·L-1 NaOH溶液现象溶液颜色变溶液颜色变结论对可逆反应Fe3++3SCN-Fe(SCN)3,分别增大c(Fe3+)和c(SCN-)后,Fe(SCN)3的浓度均,即化学平衡均向方向移动;滴加NaOH溶液,由于3OH-+Fe3+===Fe(OH)3↓,减小了的浓度,Fe(SCN)3的浓度也减小了,即化学平衡向方向移动2.影响规律(1)增大反应物浓度或减小生成物浓度,平衡向方向移动。
(2)增大生成物浓度或减小反应物浓度,平衡向方向移动。
三.压强对化学平衡的影响1.2.对于反应前后气体物质的量不变的反应[如H2(g)+I2(g)2HI(g)],改变压强,化学平衡移动。
自我检测1.判断正误(1)平衡移动的原因是v(正)≠v(逆)。

第三节影响化学平衡移动的因素及图像问题(一)【考纲解读】1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,认识其一般规律。
2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
3.了解等效平衡思想,能够运用于解题。
【复习过程】一、化学平衡移动1.概念2.过程3.平衡移动方向与反应速率的关系(1)v正____v逆,平衡向正反应方向移动。
(2)v正____v逆,平衡不移动。
(3)v正____v逆,平衡向逆反应方向移动。
二、影响化学平衡移动的条件1.影响化学平衡的外界因素若其他条件不变,改变下列条件对平衡的影响如下:条件的改变(其他条件不变) 化学平衡的移动浓度增大反应物浓度或减小生成物浓度向______方向移动减小反应物浓度或增大生成物浓度向______方向移动压强(对有气体存在的反应) 反应前后气体分子数改变增大压强向______________的方向移动减小压强向______________的方向移动反应前后气体分子数不变改变压强温度升高温度向____反应方向移动降低温度向____反应方向移动催化剂使用催化剂2.勒夏特列原理如果改变影响化学平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够____________的方向移动。
注意:该原理适用于化学平衡、电离平衡、溶解平衡、水解平衡等动态平衡。
【例1】恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是( ) A. a>b+c B. a<b+c C. a=b+c D. a=b=c【变式练习1】(2010重庆高考)COCl2(g) CO(g)+Cl2(g)ΔH>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒通入惰性气体,能提高COCl2转化率的是()A.①②④B.①④⑥C.②③⑥D.③⑤⑥【变式练习2】将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是( )A.升高温度,气体颜色加深,则此反应为吸热反应B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅【变式练习3】下列事实不能用勒夏特列原理解释的是()①氯化铁溶液加热蒸干最终得不到氯化铁固体②铁在潮湿的空气中容易生锈③实验室可用排饱和食盐水的方法收集氯气④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5⑤钠与氯化钾共融制备钾:Na(l)+KCl(l)K(g)+NaCl(l)⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深A.①②③B.②⑥C.①③④⑤D.②⑤⑥三、图像问题1.以物质的量(浓度)-时间(n(c)-t)图像【例2】右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是;(2)反应物的转化率是;(3)该反应的化学方程式为.2.以速率----时间图(v-t图像)【例3】已知合成氨的反应为:N2+3H22NH3+92.4KJ在一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率(v)变化的是()【变式练习4】对于达到平衡的可逆反应:X+Y W+Z,增大压强则正、逆反应速率(v)的变化如图所示,分析可知X、Y、Z、W的聚集状态可能是( )A.Z、W为气体,X、Y中之一为气体B.Z、W中之一为气体,X、Y为非气体C.X、Y、Z皆为气体,W为非气体D.X、Y为气体,Z、W中至少有一种为气体【课后反思】第三节化学平衡移动的图像问题(二)1.以物质的量(浓度)-时间(n(c)-t)图像2.以速率----时间图(v-t图像)3.含量—时间—温度(压强)图【例4】在密闭容器中进行如下反应:H2(g) +I2(g)2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示.符合图示的正确判断是()A.T1>T2,ΔH>0B.T1>T2,ΔH<0C.T1<T2,ΔH>0D.T1<T2,ΔH<0【变式练习5】在温度一定时,压强分别为P1,P2的条件下,A(g)+2B(g) nC(g)的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是()A、P1>P2,n<3B、P1<P2,n=3C、P1<P2,n>3D、P1>P2,n>3【变式练习6】反应2X(g)+Y(g)2Z(g),在不同温度(T1和T2)及压强(P1和P2)下,产物Z的物质的量(n z)与反应时间(t)的关系如图所示.下列判断正确的是()A.T1<T2, P1<P2 C.T1>T2,P1>P2B.T1<T2,P1>P2 D.T1>T2,P1<P24.恒压(温)线【例5】、对于反应mA(g)+nB(g) pC(g)+gD(g);△H,改变反应条件时,A的转化率变化情况如图所示,符合题意的是()A、m+n=p+g;H∆<0∆<0 B、m+n<p+g;HC、m+n<p+g;H∆>0∆>0 D、m+n>p+g;H【变式练习7】在可逆反应A2(g)+2B2(g) 2AB2(g)(正反应为放热反应)趋向平衡时,图中符合勒夏特列原理的是()5.其它图像【例6】对于mA(固)+nB(气)pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是()A.m+n<p B.x点的状态是v正>v逆C.n>p D.x点比y点的反应速度慢课堂巩固练习1.如图(Ⅰ)表示反应:mA(g)+nB(g) pC(g)+qD(g);△H。

影响化学平衡移动的因素一、温度对化学平衡的影响1.实验探究温度对化学平衡的影响按表中实验步骤完成实验,观察实验现象,填写下表:实验原理(红棕色)2NO2(g)(无色)N2O4(g)ΔH=-57.2 kJ·mol-1实验步骤实验现象热水中混合气体颜色;冰水中混合气体颜色实验结论混合气体受热颜色,说明NO2浓度,即平衡向方向移动;混合气体被冷却时颜色变,说明NO 2浓度,即平衡向移动2.温度对化学平衡移动的影响规律其他条件不变时,温度升高,平衡向方向移动;温度降低,平衡向方向移动。
改变温度平衡向右移动,反应物转化率一定增大,化学平衡常数一定增大。
例2在某温度下,反应ClF(g)+F2(g)ClF3(g)ΔH=268 kJ·mol-1,在密闭容器中达到平衡,下列说法中正确的是()A.升高温度,平衡常数不变,平衡向正反应方向移动B.升高温度,平衡常数减小C.升高温度,平衡向正反应方向移动,F2的转化率增大D.降低温度,ClF3的产率增大例3在体积一定的密闭容器中,反应Fe(s)+CO2(g)FeO(s)+CO(g)达平衡。
该反应的平衡常数K与温度的关系如下表所示:温度/℃500 700 900K 1.00 1.47 2.40(1)该反应的化学平衡常数表达式是____________。
(2)该反应是________(填“吸热”或“放热”)反应。
(3)若升高温度,CO 2转化率的变化是________(填“增大”“减小”或“不变”)。
二、浓度对化学平衡的影响1.实验探究浓度对化学平衡移动的影响按表中实验要求完成实验,将有关实验现象及其结论填入表中:原理 Fe 3++n SCN -[Fe(SCN)n ]3-n (n =1~6)实验(1)步骤现象溶液颜色变 溶液颜色变 实验(2)步骤试管①中滴加0.01 mol·L -1 NaOH 溶液 试管②中滴加0.01 mol·L -1 NaOH 溶液 现象 溶液颜色 溶液颜色实验结论 增大c (Fe 3+)或c (SCN -)后,[Fe(SCN)n ]3-n 的浓度均 ,即化学平衡均向 方向移动;滴加NaOH 溶液,由于3OH -+Fe 3+===Fe(OH)3↓,使Fe 3+的浓度 ,[Fe(SCN)n ]3-n 的浓度 ,即化学平衡向移动2.浓度对平衡移动的影响规律在其他条件不变的情况下(1)增大反应物浓度或减小生成物浓度时,Q K ,平衡向 移动。

化学平衡移动复习学案 (常见的平衡图像)【学习目标】1.由外界条件引起的变化,分析化学平衡移动方向和各项量的变化。
2.由化学平衡移动方向和各项量的变化,分析外界条件的变化。
3.通过分析、讨论,总结解决图像题的步骤,并运用该步骤解决实际问题。
【学习过程】阅读课本《选修4》26页~28页自主梳理:(课前完成)1. 化学平衡移动研究的对象是2. 化学平衡移动的原因是:条件改变引起v 正 v 逆。
3. 化学平衡移动的方向是:与条件改变后正逆反应速率的相对大小有关。
当v 正 v 逆,平衡向 方向移动; 当v 正 v 逆,平衡向 方向移动; 当v 正 v 逆,平衡向 方向移动。
勒夏特列原理的内容互动交流(课上完成)环节一:解决问题,深化知识(一)由外界条件引起的变化,分析化学平衡移动方向和各项量的变化。
以N 2(g )+3H 2(g ) 2NH 3(g )为例,将浓度、压强、温度、催化剂对平衡的影响在v-t 图上呈现出来。
(二) 由化学平衡移动方向和各项量的变化,分析外界条件的变化。
1.下图表示反应:N 2(g )+3H 2(g ) 2NH 3(g )△H=-92.4kJ/mol 某一时间段中外界条件的改变对反应速率的影响。
t 0 t 0 t 0 t 勒夏特列是一位精力旺盛的法国科学家,在1888年他宣布了一条遐迩闻名的定律,那就是勒夏特列原理。
勒夏特列不仅是一位杰出的化学家,还是一位杰出的爱国者。
当第一次世界大战发生时,法兰西处于危急中,他勇敢地担任起武装部长的职务,为保卫祖国而战斗。
(1)在t 1、t 3、t 4中各是什么原因引起的?2.可逆反应 mA(g) + nB(g) pC(g)+qD(g)A 转化率A 物质的量分数P 1 P 2 ( > = < )T 1 T 2 ( > = < ) m+n p+q ( > = < ) 正反应___热反应3. 可逆反应 mA(g) + nB(g) pC(g) +qD(g)正反应是 反应 (放热、吸热) 正反应是 反应(放热、吸热)m+n p+q ( > = <) m+n p+q ( > = <)环节二:总结要点,提炼方法。

第二章化学反应速率与化学平衡第二节化学平衡第4课时温度、催化剂对化学平衡移动的影响学习目标1.通过实验探究,了解温度对化学平衡状态的影响。
2.能根据温度、催化剂对化学平衡的影响,推测平衡移动的方向及相关物理量的变化。
核心素养宏观辨识与微观探析:从宏观与微观相结合的视角分析外界条件变化对化学平衡的影响,解释或预测化学平衡的移动方向。
科学探究与创新意识:能根据外界条件对化学平衡的影响,设计实验方案,独立完成实验,收集实验证据,基于现象和数据进行分析,并得出结论。
知识梳理活动·探究原理2NO2(g,红棕色)N2O4(g,无色)ΔH=-56.9 kJ·mol-1实验步骤实验现象热水中混合气体颜色;冰水中混合气体颜色。
[思考交流]1.浸泡在热水中的烧瓶内气体红棕色为什么会加深?由此得出的实验结论是什么?2.浸泡在冰水中的烧瓶内气体红棕色为什么会变浅?由此得出的实验结论是什么?归纳·总结1.温度对化学平衡的影响化学平衡a A+b Bc C+d DΔH>0a A+b B c C+d DΔH<0体系温度的变化升高温度降低温度降低温度升高温度反应速率变化v正、v逆同时增大,且v′正>v′逆v正、v逆同时减小,且v′正<v′逆v正、v逆同时减小,且v′正>v′逆v正、v逆同时增大,且v′正<v′逆平衡移动方向正反应方向逆反应方向正反应方向逆反应方向vt图像规律总结在其他条件不变的情况下,升高温度,平衡向吸热反应的方向移动;降低温度,平衡向放热反应的方向移动2.催化剂对化学平衡的影响因为催化剂能同等程度地改变正、逆反应的化学反应速率,所以加入催化剂只能改变化学反应速率,化学平衡不移动。
其图像(vt图)如下:3.勒夏特列原理(又称为化学平衡移动原理)(1)内容:如果改变影响平衡的一个因素(如温度、压强或参加反应的物质的浓度),平衡就向着能够减弱这种改变的方向移动。
(2)适用范围:适用于任何动态平衡体系(如溶解平衡、电离平衡等),非平衡状态不适用。
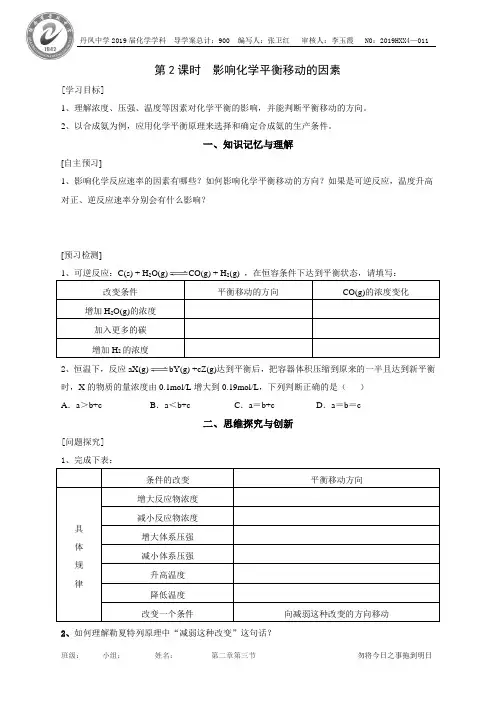
第2课时影响化学平衡移动的因素[学习目标]1、理解浓度、压强、温度等因素对化学平衡的影响,并能判断平衡移动的方向。
2、以合成氨为例,应用化学平衡原理来选择和确定合成氨的生产条件。
一、知识记忆与理解[自主预习]1、影响化学反应速率的因素有哪些?如何影响化学平衡移动的方向?如果是可逆反应,温度升高对正、逆反应速率分别会有什么影响?[预习检测]改变条件平衡移动的方向CO(g)的浓度变化增加H2O(g)的浓度加入更多的碳增加H2的浓度2、恒温下,反应aX(g)bY(g) +cZ(g)达到平衡后,把容器体积压缩到原来的一半且达到新平衡时,X的物质的量浓度由0.1mol/L增大到0.19mol/L,下列判断正确的是()A.a>b+c B.a<b+c C.a=b+c D.a=b=c二、思维探究与创新[问题探究]1、完成下表:条件的改变平衡移动方向具体规律增大反应物浓度减小反应物浓度增大体系压强减小体系压强升高温度降低温度改变一个条件向减弱这种改变的方向移动2、如何理解勒夏特列原理中“减弱这种改变”这句话?三、技能应用与拓展[当堂检测]1、对已达平衡状态的反应:2X(g)+Y(g)2Z(g),减小压强时,下列说法正确的是()A.逆反应速率增大,正反应速率减小,平衡向逆反应方向移动B.逆反应速率减小,正反应速率增大,平衡向正反应方向移动C.正、逆反应速率都减小,平衡向逆反应方向移动D.正、逆反应速率都增大,平衡向正反应方向移动2、在一定条件下,可逆反应:N 2(g)+3H2(g)2NH3(g) △H<0,达到平衡时,当单独改变下列条件后,有关叙述错误的是()A.加催化剂υ(正)、υ(逆)都发生变化且变化的倍数相等B.加压,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数C.降温,υ(正)、υ(逆)都减小,且υ(正)减小倍数小于υ(逆)减小倍数D.在体积不变时加入氩气,υ(正)、υ(逆)都增大,且υ(正)增大倍数大于υ(逆)增大倍数3、对于任何一个平衡体系,采取下列措施后,一定会使平衡移动的是()A.加入一种反应物B.对平衡体系加压C.升高温度D.使用催化剂4、二氧化氮能形成二聚分子:2NO 2(g)N2O4(g),ΔH<0。
第二章化学反应速率与化学平衡实验活动1 探究影响化学平衡移动的因素【实验目的】1. 认识浓度、温度等因素对化学平衡的影响。
2.进一步学习控制变量、对比等科学方法。
【原理梳理】1.检验Fe3+常用KSCN溶液,向FeCl3溶液滴加几滴KSCN溶液时发生反应的离子方程式为:。
2.K2Cr2O7溶液显色,而K2CrO4溶液呈色,K2Cr2O7与K2CrO4在溶液中存在平衡:。
3.氯化铜溶液中存在的平衡为:。
4.NO2气体呈色,而N2O4为色,二者间存在平衡:。
5.勒夏特列原理:改变影响化学平衡的一个因素(如、及参加反应的物质的等),平衡就向着的方向移动。
【实验探究一】浓度对化学平衡的影响1.FeCl3溶液与KSCN溶液的反应3若向上述溶液中滴加较浓的FeCl3溶液或KSCN溶液,溶液的红色将如何变化?为什么?2.在K Cr O溶液中存在如下平衡:Cr O2 + H O⇌2CrO2 + 2H+227。
【实验探究二】温度对化学平衡的影响1.在CuCl2溶液中存在如下平衡[Cu(H2O)4]2+(蓝色)+4Cl-⇌[CuCl4]2-(黄色)+4H2OΔH>0【微思考3】(1)将盛有CuCl2溶液的试管加热,溶液颜色如何变化?。
(2)将(1)中试管置于冷水中,溶液颜色又会如何变化?。
2.在NO2和N2O4的混合气体中存在如下平衡:2NO2⇌N2O4ΔH<0【微思考4】将两个封装有NO2和N2O4混合气体的圆底烧瓶分别浸入热水和冷水中,气体颜色将如何变化?为什么?课后练习1.放热反应2NO(g)+O2(g)⇌2NO2(g)达到平衡后,若分别采取下列措施:①增大压强②减小NO2的浓度③增大O2浓度④升高温度⑤加入催化剂,能使平衡向正反应方向移动的是()A.①②③B.②③④C.③④⑤D.①②⑤2.在水溶液中,CrO24-呈黄色,Cr2O27-呈橙红色,重铬酸钾(K2Cr2O7)在水溶液中存在以下平衡:Cr2O27-+H2O⇌2CrO24-+2H+,下列说法正确的是()A.向该溶液中加入过量浓NaOH溶液后,溶液呈橙红色B.该反应是氧化还原反应C.向该溶液中通入HCl气体,平衡向逆反应方向移动,再次达到平衡后,氢离子浓度比原溶液大D.向体系中加入少量水,平衡逆向移动3.下列事实不能用勒夏特列原理解释的是()A.盛有2mL5%H2O2溶液的试管中加入MnO2作催化剂,试管中迅速产生大量气泡B.工业合成氨中,将氨气液化分离以提高氨气产率C.SO2氧化为SO3,使用过量的空气以提高SO2的利用率D.夏天,打开啤酒瓶时会从瓶口逸出泡沫4.KI和I2在水中存在的平衡:I2+I-3I-(无色),以下判断错误的是A.通入氯气平衡逆向移动B.增加-c(I)可以提高I2在水中的溶解度C.加入少量KI固体,溶液颜色变浅D.滴加AgNO3溶液无沉淀产生5.室温下,向3mL0.1mol/L稀盐酸中加入1mL0.1mol/L氯化钴溶液发生反应:2+-2-2264+6H O ΔH 0[Co(H O)]+4Cl (CoCl )>粉红色蓝色,平衡时溶液呈浅紫色。
第2课时影响化学平衡移动的因素(一)浓度、压强对化学平衡移动的影响学习目标1.会根据速率变化判断化学平衡移动的方向。
2.通过外界条件对可逆反应速率的影响,掌握化学平衡移动的内在因素。
3.会分析浓度、压强变化对化学平衡移动的影响。
新知导学一浓度对化学平衡移动的影响1.浓度变化对化学平衡移动的影响规律(1)增大反应物浓度或减小生成物浓度,平衡向方向移动。
(2)减小反应物浓度或增大生成物浓度,平衡向方向移动。
二压强对化学平衡移动的影响2.压强变化对化学平衡移动的影响规律(1)对有气体参加或有气体生成的可逆反应而言,对于反应前后气体体积发生变化的反应:改变压强平衡移动方向增大压强平衡向气体体积的方向移动减小压强平衡向气体体积的方向移动(2)对于反应前后气体体积没有发生变化的反应,改变压强平衡移动。
自主检测缩小容器容积,增大压强,下列反应所建立的平衡向左移动的是()A.2NO2(g)N2O4B.N2(g)+3H2(g)2NH3(g)C.C(s)+O2(g)2CO(g)D.H2(g)+I2(g)2HI(g)课堂互动探究一浓度对化学平衡的影响实验目的:探究浓度对化学平衡的影响实验记录:实验原理Cr2+H2O2Cr+2H+(橙色)(黄色)实验现象实验原理Fe3++3SCN-Fe(SCN)3(红色)实验现象实验1 橙色加深实验3红色加深实验2 黄色加深实验4红色变浅讨论探究根据上面表格中记录的实验现象,分析浓度改变是如何影响化学平衡的?归纳总结若其他条件不变,改变浓度对化学平衡的影响如下:条件的改变(其他条件不变) 化学平衡的移动浓度增大反应物浓度或减小生成物浓度向正反应方向移动减小反应物浓度或增大生成物浓度向逆反应方向移动例题1在一恒容密闭容器中,反应A(g)+B(g) C(g)达到平衡,若增大A的浓度,使平衡右移,并达到新的平衡,下列说法正确的是()A.A的浓度一定比原平衡小B.A的转化率增大C.C的体积分数一定大于原平衡C的体积分数D.B的转化率一定增大例题2可逆反应FeCl3+3KSCN Fe(SCN)3+3KCl,在一定条件下达到平衡状态,改变下列条件能引起平衡向逆反应方向移动的是()A.增大FeCl3溶液的浓度B.减小FeCl3溶液的浓度C.增大KCl溶液的浓度D.减小KCl溶液的浓度易错提醒分析浓度对化学平衡的影响时需注意的问题:(1)体系中增加固体或纯液体不能改变其浓度,也不能改变速率,所以v(正)仍然等于v(逆),平衡不移动。
化学平衡图像知识目标:1.通过画图以及对图像的分析,使学生进一步理解化学平衡的特征,建立化学平衡的观点。
2.熟悉解决常见有关化学反应速率、化学平衡图像题的一般步骤;使学生加深巩固影响化学反应速率以及化学平衡移动因素的知识。
能力目标:1.提高学生对影响化学反应速率以及化学平衡移动因素知识的理解和应用能力。
2.通过对图像的分析解释,提高学生分析图像的能力,培养学生抽象思维能力。
学习重点:平衡图像的分析知识链接:化学平衡平衡转化率知识梳理:一、有关化学平衡图像的知识规律:(1)对有气体参加的可逆反应,在温度相同的情况下,压强越大,到达平衡所需的时间越短;在压强相同情况下,温度越高,到达平衡所需的时间越短。
(2)使用催化剂,能同等程度地改变正、逆反应速率,改变到达平衡所需时间,但不影响化学平衡移动。
(3)同一反应中未达平衡前,同一段时间间隔内,高温时(其他条件相同)生成物含量总比低温时生成物含量大;高压时(其他条件相同)生成物的含量总比低压时生成物的含量大。
(4)平衡向正反应方向移动,生成物的物质的量增加,但生成物的浓度、质量分数以及反应物的转化率不一定增加。
二、平衡图像的分类研讨:(一)、物质的量(或浓度)—时间图象1.图2表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:(1)该反应的反应物是______;(2)反应物的转化率是______;(3)该反应的化学方程式为___ ___.(二)、速率—时间图此类图象定性地揭示了v正、v逆随时间(含条件改变对速率的影响)而变化的规律,体现了平衡的“动、等、定、变”的基本特征,以及平衡移动的方向.2.对达到平衡状态的可逆反应X+Y Z+W,在其他条件不变的情况下,增大压强,反应速率变化图象如图1所示,则图象中关于X、Y、Z、W四种物质的聚集状态为()A.Z、W均为气体,X、Y中有一种是气体B.Z、W中有一种是气体,X、Y皆非气体C.X、Y、Z、W皆非气体D.X、Y均为气体,Z、W中有一种为气体3. 已知可逆反应:N(g) +3 H2 (g) 2NH3 (g);△H=-92.4 KJ/mol下列各图表示上述可逆反应建立平衡的过程及改变某一条件后建立起新的平衡过程的曲线:(1)加入稀有气体后的平衡图为___________。
第三节影响化学平衡移动的因素及图像问题
【考纲解读】
1.理解外界条件(浓度、温度、压强、催化剂等)对化学平衡的影响,认识其一般规律。
2.了解化学平衡的调控在生活、生产和科学研究领域中的重要作用。
【复习过程】
一、化学平衡移动
1.概念
2.过程
3.平衡移动方向与反应速率的关系
(1)v正____v逆,平衡向正反应方向移动。
(2)v正____v逆,平衡不移动。
(3)v正____v逆,平衡向逆反应方向移动。
二、影响化学平衡移动的条件
1.影响化学平衡的外界因素
若其他条件不变,改变下列条件对平衡的影响如下:
升高温度向____反应方向移动
温度
降低温度向____反应方向移动
催化剂使用催化剂
2.勒夏特列原理
如果改变影响化学平衡的条件之一(如温度、压强,以及参加反应的化学物质的浓度),平衡将向着能够____________的方向移动。
注意:该原理适用于化学平衡、电离平衡、溶解平衡、水解平衡等动态平衡。
【例1】恒温下, 反应aX(g) bY(g) +cZ(g)达到平衡后, 把容器体积压缩到原来的一半且达到新平衡时, X的物质的量浓度由0.1mol/L增大到0.19mol/L, 下列判断正确的是( )
A. a>b+c
B. a<b+c
C. a=b+c
D. a=b=c
【变式练习1】(2010重庆高考)COCl2(g)
CO(g)+Cl2(g)ΔH>0,当反应达到平衡时,下列措施①升温②恒容通入惰性气体③增加CO的浓度④减压⑤加催化剂⑥恒通入惰性气体,能提高COCl2转化率的是()
A.①②④B.①④⑥C.②③⑥D.③⑤⑥
【变式练习2】将NO2装入带活塞的密闭容器中,当反应2NO2(g)N2O4(g)达到平衡后,改变下列一个条件,其中叙述正确的是 ()
A.升高温度,气体颜色加深,则此反应为吸热反应
B.慢慢压缩气体体积,平衡向右移动,混合气体颜色变浅
C.慢慢压缩气体体积,若体积减小一半,压强增大,但小于原来的两倍
D.恒温恒容时,充入惰性气体,压强增大,平衡向右移动,混合气体的颜色变浅
【变式练习3】下列事实不能用勒夏特列原理解释的是()
①氯化铁溶液加热蒸干最终得不到氯化铁固体②铁在潮湿的空气中容易生锈③实验室可用排饱和食盐水的方法收集氯气④常温下,将1 mL pH=3的醋酸加水稀释至100 mL,测得其pH<5⑤钠与氯化钾共融制备钾:Na(l)+KCl(l) K(g)+NaCl(l)⑥二氧化氮与四氧化二氮的平衡体系,加压后颜色加深
A.①②③ B.②⑥C.①③④⑤ D.②⑤⑥
三、图像问题
1.物质的量(浓度)-时间(n(c)-t)图像
【例2】右图表示800℃时A、B、C三种气体物质的浓度随时间的变化情况,t1是到达平衡状态的时间.试回答:
(1)该反应的反应物是;(2)反应物的转化率是;
(3)该反应的化学方程式为.
2.速率----时间图(v-t图像)
【例3】已知合成氨的反应为:N2+3H22NH3+92.4KJ在一定条件下达到化学平衡,现升高温度使平衡发生移动,下列图像中能正确描述正、逆反应速率(v)变化的是()
【变式练习4】对于达到平衡的可逆反应:X+Y
W+Z,增大压强则正、逆反应速率(v)的变化如图所
示,分析可知X、Y、Z、W的聚集状态可能是()
A.Z、W为气体,X、Y中之一为气体
B.Z、W中之一为气体,X、Y为非气体
C.X、Y、Z皆为气体,W为非气体
D.X、Y为气体,Z、W中至少有一种为气体
【课后反思】
附:第三节化学平衡移动的图像问题(二)
1.以物质的量(浓度)-时间(n(c)-t)图像
2.以速率----时间图(v-t图像)
3. 含量—时间—温度(压强)图
【例4】在密闭容器中进行如下反应:H2(g) +
I2(g)2HI(g),在温度T1和T2时,产物的量与
反应时间的关系如下图所示.符合图示的正确判断是()
A.T1>T2,ΔH>0
B.T1>T2,ΔH<0
C.T1<T2,ΔH>0
D.T1<T2,ΔH<0
【变式练习5】在温度一定时,压强分别为P1,P2的
条件下,
A(g)+2B(g) nC(g)的反应体系中,C的分数与时间t,压强P1,P2的关系如图所示,则下列结论正确的是()
A、P1>P2,n<3
B、P1<P2,n=3
C、P1<P2,n>3
D、P1>P2,n>3
【变式练习6】反应2X(g)+Y(g)2Z(g),在不同
温度(T1和T2)
及压强(P1和P2)下,产物Z的物质的量(nz)与反应时间(t)的关系如图所示.下列判断正确的是()
A.T1<T2, P1<P2 C.T1>T2,P1>P2
B.T1<T2,P1>P2 D.T1>T2,P1<P2
4.恒压(温)线
【例5】、对于反应mA(g)+nB(g) pC(g)+gD(g);△H,改变反应条件时,
A的转化率变化情况如图所示,符合题意的是()
A、m+n=p+g;H∆<0
B、m+n<p+g;H∆<0
C、m+n<p+g;H∆>0
D、m+n>p+g;H∆>0
【变式练习7】在可逆反应A2(g)+2B2(g) 2AB2(g)(正反应为放热反应)趋向平衡时,图中符合勒夏特列原理的是()
5.其它图像
【例6】对于mA(固)+nB(气)pC(气)+Q的可逆反应,在一定温度下B的百分含量与压强的关系如图所示,则下列判断正确的是()
A.m+n<p B.x点的状态是v正>v逆
C.n>p D.x点比y点的反应速度慢
课堂巩固练习
1.如图(Ⅰ)表示反应:mA(g)+nB(g) pC(g)+qD(g);△H。
在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系。
图(Ⅱ)表示在一定条件下达到平衡后,t时刻改变影响平衡的另一个条件,重新建立平衡的反应过程。
由此可判断该反应中( )
A、m+n>p+q, H∆<0
B、m+n>p+q, H∆>0
C、m+n<p+q, H∆>0
D、m+n<p+q, H∆<0
2.向某密闭容器中加入4 mol A、1.2 mol C和一定量的B三种气体,一定条件下发生反应,各物质的浓度随时间变化如甲图所示[已知t0~t1阶段保持恒温、恒容,且c(B)未画出]。
乙图为t2时刻后改变反应条件,反应速率随时间的变化情况,已知在t2、t3、t4、t5时刻各改变一种不同的条件,其中t3时刻为使用催化剂。
(1)若t1=15 s,则t0~t1阶段的反应速率为v(C)=。
(2)t4时刻改变的条件为,B的起始物质的量为。
(3)t5时刻改变的条件为,该反应的逆反应为(填“吸热反应”或“放热反应”)。
(4)已知t0~t1阶段该反应放出或吸收的热量为Q kJ(Q为正值),试写出该反应的热化学方程式:____________________________________________________________ _。
(5)图乙中共有Ⅰ~Ⅴ五处平衡,其平衡常数最大的是。