化学平衡移动的图像
- 格式:docx
- 大小:312.91 KB
- 文档页数:4








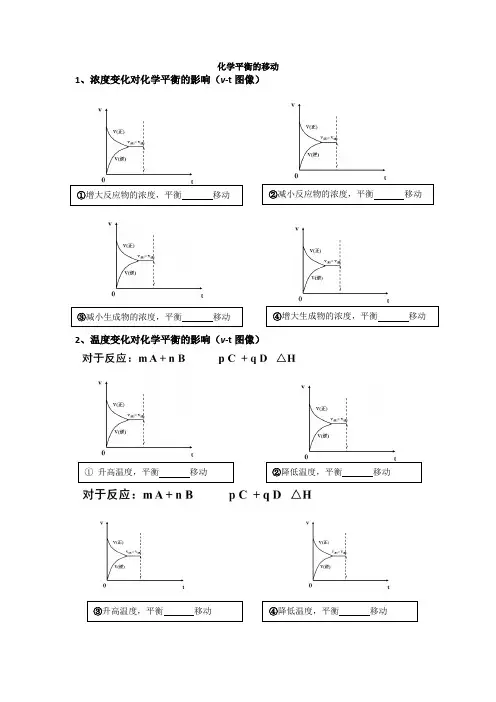
化学平衡的移动1、浓度变化对化学平衡的影响(v-t图像)
2、温度变化对化学平衡的影响(v -t图像)
①增大反应物的浓度,平衡移动②减小反应物的浓度,平衡移动③减小生成物的浓度,平衡移动④增大生成物的浓度,平衡移动
①升高温度,平衡移动②降低温度,平衡移动
③升高温度,平衡移动④降低温度,平衡移动
3、压强变化对化学平衡的影响
(1)当m + n >p + q时:
①增大压强,平衡移动②减小压强,平衡移动(2)当m + n <p + q 时:
③增大压强,平衡移动④减小压强,平衡移动
(3)A(气) + B (气) 2C (气) + D (固)
⑤增大压强,平衡移动⑥减小压强,平衡移动
4、催化剂对化学平衡的影响。

基础知识清单化学平衡的移动(化学平衡图像)一、化学平衡图像1.反应速率图像(vt图)(1)“渐变”类vt图——浓度对化学反应速率的影响图像Ⅰ中,v′(正)突变,而v′(逆)渐变,t1时刻图像中有一条线是连续的,且v′(正)>v′(逆),说明t1时刻改变的条件是增大了反应物的浓度,使v′(正)突变,平衡正向移动。
图像Ⅰ中,v′(正)渐变,v′(逆)突变,t1时刻图像中有一条线是连续的,且v′(正)>v′(逆),说明t1时刻改变的条件是减小了生成物的浓度,使v′(逆)突变,平衡正向移动。
(2)“断点”类vt图——温度(或压强)对化学反应速率的影响图像Ⅰ中,v′(正)、v′(逆)都是突然增大的,t1时刻,图像中出现了“断点”,且v′(正)>v′(逆),平衡正向移动,说明该反应的正反应是吸热反应(或气体分子数减小的反应),改变的外界条件是升高温度(或增大压强)。
图像Ⅰ中,v′(正)、v′(逆)都是突然变小的,t1时刻,图像中出现了“断点”,且v′(正)>v′(逆),平衡正向移动,说明该反应的正反应是放热反应(或气体分子数增大的反应),改变的条件是降低温度(或减小压强)。
(3)“平台”类vt图——催化剂(或压强)对化学反应速率的影响图像中v′(正)、v′(逆)都是突然增大,且增大的程度相同,t1时刻,图像中出现了“平台”,化学平衡不发生移动,改变的条件是使用了催化剂或反应前后气体分子数目不发生变化的反应增大了压强。
(4)速率-温度(压强)图这类图有两种情况:一是不隐含时间因素的速率-时间图,二是隐含时间变化的速率-时间图。
以2SO2(g)+O2(g)2SO3(g)ΔH<0为例,vT(p)图如图:2.物质的量(或浓度)—时间图像[n(或c)t图像]此类图像说明各平衡体系组分(或某一组分)在反应过程中的变化情况。
解题原则:注意各物质曲线的折点(到达平衡的时刻),各物质浓度变化的比例符合化学方程式中的化学计量数关系等情况可以求得某段时间内的平均反应速率。

化学平衡移动的图像一、化学平衡的移动
二、影响化学平衡移动的条件
1、浓度的变化对化学平衡的影响
结论:其它条件不变的情况下,①增大反应物浓度或减小生成物浓度平衡向正方向移动
②增大生成物浓度或减小反应物浓度平衡向逆方向移动
2、温度变化对化学平衡的影响
温度的改变对正逆反应速率都会产生影响,但影响的程度不同,温度的变化对吸热反应的速率比放热反应的速率影响大。
表现在:
升高温度,正、逆反应速率都增大,但增大的倍数不一样,吸热反应增大的倍数大。
降低温度,正、逆反应速率都减小,但降低的倍数不一样,吸热反应降低的倍数大。
结论:在其他条件不变时,温度升高,会使化学平衡向吸热反应的方向移动,温度降低会使化学平衡向放热的方向移动。
注意:温度的变化一定会影响化学平衡,使平衡发生移动
3、压强的变化对化学平衡的影响
对于反应前后气体分子数有变化的体系:
结论:增加压强可使平衡向气体分子数目减小的方向移动;
减小压强可使平衡向气体分子数目增大的方向移动.
对于反应前后气体分子数目不变的反应:
结论:对于反应前后气体分子数目不变的反应,改变压强平衡不移动。
4、使用催化剂对化学平衡的影响
结论:催化剂同等程度的改变正、逆反应速率(V正=V逆)
使用催化剂,对化学平衡无影响。
正催化剂能缩短平衡到达的时间
[总结]改变反应条件时平衡移动的方向
5、化学平衡移动原理——勒夏特列原理
早在1888年,法国科学家勒夏特列就发现了这其中的规律,并总结出著名的勒夏特列原理,也叫化学平衡移动原理:
勒夏特列原理:如果改变影响平衡的一个条件(如浓度、温度、或压强等),平衡就向能够减弱这种改变的方向移动。
注意:
①是“减弱”这种改变,不是“消除”这种改变
②勒夏特列原理适用于任何动态平衡体系(如:溶解平衡、电离平衡、沉淀平衡、水解
平衡等),未平衡状态不能用此来分析
③平衡移动原理只能用来判断平衡移动方向,但不能用来判断建立平衡所需时间。