康为世纪 质粒小提试剂盒
- 格式:pdf
- 大小:302.58 KB
- 文档页数:2

质粒小提试剂盒I简明步骤(PD1211)(详细内容请参考英文说明书)I.实验前准备II.注意事项RNase A: 使用前将提供的所有RNase A瞬时离心后加入Buffer A1, 使用后将Buffer A1/RNase A置于4o C保存。
质粒拷贝数:纯化中低拷贝的质粒时,使用2倍的菌液体积,2倍的Buffer A1,B1,N1, 相同体积的Wash Buffer和Elution Buffer.转化菌:若为-70o C甘油冻存的菌,请先涂布平板培养后,再重新挑选新的单个菌落进行培养。
切勿直接取冻存的菌种进行培养。
DNA Wash Buffer*: 使用前请将8 mL (PD1211-00)或48 mL(PD1211-01)或216 mL (PD1211-02) or 90 mL (PD1211-03) 96-100% 乙醇加入DNA Wash Buffer。
Buffer B1: 在低于室温时会沉淀,请于50o C左右水浴加热至沉淀完全溶解,溶液澄清,使用后保证Buffer B1瓶盖旋紧。
在室温下(22-25o C)进行所有离心操作。
III.操作步骤1.接种新鲜的单个菌落到1-5 mL的LB培养基(含适量抗生素),37o C震荡培养14-16小时。
室温下10,000 x g离心1分钟,收集菌体,并尽可能的吸去上清。
注:残留的液体培养基容易导致菌液裂解不充分,第5步离心后沉淀较松,不能有效吸取上清。
注:本说明书中的操作程序适用于标准LB (Luria Bertani)培养基培养12-16 小时后,OD600(细菌密度)在2.0-3.0之间的菌液。
若采用的是富集培养基,例如TB 或2×YT,请注意保证OD600不超过3.0。
2.加入250 µL Buffer A1(确保已加入RNase A),用移液枪或涡流震荡充分悬浮细菌细胞。
注:细菌细胞如果没有充分悬浮均匀,将导致菌体裂解不完全,从而降低产量。

高纯质粒小量提取试剂盒(柱离心型)(Plasmid Minispin HP Kit Ver.2)产品说明:本试剂盒在常规柱离心质粒提取技术的基础上,改进了硅基质膜材料和试剂配方,使质粒DNA获得高效、专一吸附。
经过两步洗涤,可清除蛋白质、基因组DNA、RNA和其他杂质。
新增基质平衡液处理步骤,可进一步提高硅胶膜的DNA吸附能力,获得稳定的质粒产量。
适合于从1~3 ml培养液中提取质粒DNA。
高拷贝菌液可获得质粒DNA约5~30 μg,可应用于各种常规实验如酶切、PCR、测序、连接、转化和体外转录等操作,并可用于细胞转染工作。
产品内容与储存方法:名称数量保存条件Buffer P1(重悬液)20 ml RTBuffer P2(裂解液)20 ml RTBuffer P3(结合液)30 ml RTBuffer PE(平衡液)30 ml RTBuffer PWT (洗涤液T)* 30 ml RTBuffer PW (洗涤液)** 20 ml RTElution Buffer(洗脱液)10 ml RT离心柱及套管100套RTRNase A 20 mg/ml 0.1 ml -20℃试剂盒可作100次质粒小量提取。
常温运输,室温保存。
RNase A于-20℃保存,首次使用时加入Buffer P1中混匀,置4℃保存。
*Buffer PWT(洗涤液T)在首次使用时加入异丙醇30 ml混匀。
**Buffer PW(洗涤液)在首次使用时加入无水乙醇80 ml混匀。
有效期1年。
所需其它试剂:使用者需准备加入洗涤液的无水乙醇和异丙醇。
操作方法:1)收菌:取过夜培养菌1~3 ml菌液,装入1.5ml 或2ml离心管中,12,000 x g于室温离心2 min沉淀菌体,完全弃除上清。
2)重悬:加入200 µl Buffer P1,充分混悬震荡菌体沉淀10~15 sec,使其完全分散开,至无絮块存在。
3)裂解:加入200 µl Buffer P2,轻轻颠倒离心管3~5次,室温放置2~3 min,使细菌完全裂解,溶液透明。

高纯度质粒小提试剂盒 Pure Mini Plasmid Kit(目录号:HS0103)产品包装试剂盒成分 50 preps Buffer P1 15 ml Buffer P2 15 ml Buffer P3 20 ml Buffer PD 30 ml RNase A(10 mg/ml)150 ul Buffer PW 60 ml Buffer EB 10 ml Spin Columns PA 50个 Collection Tubes (2 ml)50个(注意:使用前将全部RNase A 溶液加到Buffer P1中混合均匀,2 ~ 8℃保存)保存条件本试剂盒在室温(15 ~ 25℃)干燥条件下,可保存12个月;更长时间的保存可置于2 ~ 8℃。
若溶液产生沉淀,应在使用前置于37℃下溶解沉淀。
单独包装的RNase A 在室温可稳定保存12个月。
加入RNase A 后的Buffer P1应置于2 ~ 8℃保存,可稳定保存6个月。
产品简介本试剂盒用于高纯度质粒DNA 的小量制备与纯化。
菌体经碱裂解、高盐、低pH 处理,质粒可从菌体中释放出来,并特异、高效地被离心柱硅胶膜(Spin Columns PA )吸附。
通过去蛋白液(Buffer PD )和漂洗液(Buffer PW )的清洗可去除蛋白及其他杂质,在低盐、高pH 条件下洗脱,最后得到高纯度的质粒DNA 。
北京厚生博泰科技有限公司Beijing Hooseen Biotech Co., Ltd.使用本试剂盒可从1 ~ 5 ml过夜培养的菌液中纯化得到高达20 ug的高纯度质粒DNA,可在30 min之内完成提取任务。
所得质粒可直接用于酶切、转化、PCR、测序、低敏感细胞株的转染等各种常规分子生物学操作。
产品特点1. 快速:步骤少,操作简便,节约时间。
2. 简便:离心吸附柱不需要预平衡,漂洗液Buffer PW 和去蛋白液Buffer PD不需要另加乙醇,即开即用。

DirectAmp Plasmid Kit直接扩增质粒DNA试剂盒Version 03232010‐1.1I 组分说明Catalog no. CW0508Number of preps/amplifications 50DirectAmp MasterMix 1.2 mlDirectAmp PrimerMix 25 μlDirectAmp Positive Control (pUC19,1ng/μl) 50 μlNuclease-Free Water 1.8 mlProtocol 1II 保存条件自收到之日起,该试剂盒-20℃可保存一年。
III 产品简介本试剂盒可从细菌菌落快速扩增获得高质量质粒DNA,试剂盒中提供的引物可结合在E. coli 中的ColE1复制起始区,通过反向PCR得到完整、线性、双链质粒DNA,几乎没有RNA和内毒素的污染。
无需菌液培养,较常规的质粒提取更加快速简便节省时间,可通过扩大反应体系增加产物量。
产物可直接进行下游测序、酶切分析、亚克隆等操作。
IV 注意事项1.一些培养基成分可能会抑制PCR扩增,这里推荐用SOB培养基以减少对PCR扩增反应的抑制。
SOB培养基配方见附表1。
2.使用之前使DirectAmp MasterMix和DirectAmp PrimerMix完全溶解并充分混匀。
3.反应体系配置过程在冰上进行操作。
附表1: SOB培养基配方成分 含量tryptone 2%Yeast extract 0.5%NaCl 10mMKCl 2.5mMMgCl210mMMgSO410mMagar 2%V 操作步骤1.用无菌的Tip头或接菌环挑取固体培养基上的单菌落。
注意:1) 不要将琼脂和菌落一起挑起以免影响后续的PCR反应。
2) 培养时间小于24小时的菌落中的DNA产量最高,不要将菌培养2天以上。
2.取10µl Nuclease-Free Water于一个0.5ml离心管中,将含有菌落的Tip头或接菌环在液体中搅动5秒钟使菌落重悬。

PurePlasmid Midi Kit高纯度质粒中提试剂盒Version 04282010‐2.1I 组分说明Catalog no. CW0502CW0502ANumber of preps. 50 6Buffer P1 30 ml 5 mlBuffer P2 30 ml 5 mlBuffer N3 40 ml 5 mlBuffer PB 30 ml 5 mlBuffer PW(concentrate) 15 ml 2 mlBuffer EB 15 ml 1 mlRNase A(10mg/ml ) 600 μl 100μlSpin Column CL 50 6Collection Tube(2ml) 50 6Protocol 1 1II 保存条件该试剂盒室温干燥条件下(15-25℃)可保存一年,更长的保存时间可置于2-8℃。
若溶液产生沉淀,应在使用前置于37℃下溶解沉淀。
单独包装的RNaseA可室温(15-25℃)保存,更长时间保存置于2-8℃,加入RNaseA后的Buffer P1置于2-8℃保存,可以稳定保存半年。
III 产品简介本试剂盒采用碱裂解法裂解细胞,通过新型离心吸附柱在高盐浓度下高效、专一结合溶液中的DNA,提取率达85%–90%。
本试剂盒提取的质粒纯度高,质量稳定,最大限度的去除杂质蛋白和细菌中其它有机化合物的污染,一次可处理5-15ml菌液。
所得质粒可用于各种常规操作,包括酶切、PCR、测序、连接、转化、文库筛选、体外翻译、转染一些常规的传代细胞等。
IV 注意事项1.Buffer P1 在使用前先加入RNase A(将试剂盒中提供的RNase A 全部加入),混匀,置于2–8℃保存。
2.第一次使用前应按照试剂瓶标签的说明先在Buffer PW中加入无水乙醇。
3.使用前请先检查Buffer P2 和Buffer N3 是否出现浑浊,如有混浊现象,可在37℃水浴中加热几分钟,即可恢复澄清。
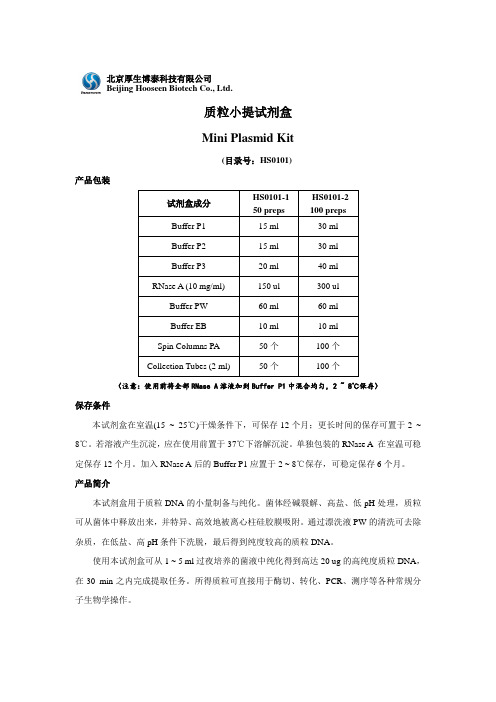
质粒小提试剂盒 Mini Plasmid Kit(目录号:HS0101)产品包装(注意:使用前将全部RNase A 溶液加到Buffer P1中混合均匀,2 ~ 8℃保存)保存条件本试剂盒在室温(15 ~ 25℃)干燥条件下,可保存12个月;更长时间的保存可置于2 ~ 8℃。
若溶液产生沉淀,应在使用前置于37℃下溶解沉淀。
单独包装的RNase A 在室温可稳定保存12个月。
加入RNase A 后的Buffer P1应置于2 ~ 8℃保存,可稳定保存6个月。
产品简介本试剂盒用于质粒DNA 的小量制备与纯化。
菌体经碱裂解、高盐、低pH 处理,质粒可从菌体中释放出来,并特异、高效地被离心柱硅胶膜吸附。
通过漂洗液PW 的清洗可去除杂质,在低盐、高pH 条件下洗脱,最后得到纯度较高的质粒DNA 。
使用本试剂盒可从1 ~ 5 ml 过夜培养的菌液中纯化得到高达20 ug 的高纯度质粒DNA ,在30 min 之内完成提取任务。
所得质粒可直接用于酶切、转化、PCR 、测序等各种常规分子生物学操作。
北京厚生博泰科技有限公司Beijing Hooseen Biotech Co., Ltd.产品特点1. 快速:步骤少,操作简便,节约时间。
2. 简便:离心吸附柱不需要预平衡,漂洗液不需要另加乙醇,即开即用。
3. 高质:OD260/280在1.7 ~ 1.9之间。
4. 稳定:正确保存条件下一年内提取效果不发生变化。
操作步骤1. 取1 ~ 5 ml过夜培养的菌液,室温12,000 rpm离心1 min,尽量将上清去除干净。
(注意:根据菌液的浓度决定取液量,浓度高时取1 ml菌液离心即可,浓度低时可多收集一次)2. 加入250 ul Buffer P1,用枪头充分吹打使菌体重悬均匀。
(注意:是否将RNase A溶液加到Buffer P1中并混合均匀;菌体沉淀是否悬浮充分,如有未彻底悬浮的菌块会影响裂解,导致提取的质粒浓度及纯度降低)3. 加入250 ul Buffer P2,温和颠倒混匀6 ~ 8次,直到溶液变得清亮粘稠。
质粒小量提取试剂盒说明书货号:D1100规格:50T/100T保存:常温保存,复检期一年。
(注:RNase A以附件形式发货,收到未使用前请-20℃保存)试剂盒内容:试剂盒组成D1100-50T D1100-100TRNase A300ul500ul溶液Ⅰ15ml30ml溶液Ⅱ15ml30ml溶液Ⅲ20ml40ml漂洗液15ml15ml×2洗脱液15ml30ml吸附柱50个100个收集管50个100个说明书1份1份产品说明:本试剂盒采用碱裂解法裂解细胞,根据离心吸附柱在高盐状态下特异性地结合溶液中的DNA的原理特异性提取质粒DNA。
离心吸附柱中采用的硅基质材料能高效、专一地吸附DNA,可最大限度去除杂质蛋白及细胞中其他有机化合物。
使用本试剂盒提取的质粒DNA可适用于各种常规操作,包括酶切、PCR、测序、连接和转化等试验。
使用前请先在漂洗液中加入无水乙醇,加入体积请参照瓶体上的标签。
溶液Ⅰ在使用前先加入RNaseA (将试剂盒中提供的RNaseA全部加入),混匀,置于2-8℃保存。
如非指明,所有离心步骤均为使用台式离心机在室温下离心。
操作步骤:1、取1-5ml细菌培养物,12000rpm离心1min,尽量吸除上清(菌液较多时可以通过多次离心将菌体沉淀收集到一个离心管中)。
2、向留有菌体沉淀的离心管中加入250ul溶液Ⅰ(请先检查是否已加入RNaseA),使用移液器或旋涡振荡器彻底悬浮细菌细胞沉淀。
注意:如果菌块未彻底混匀,会影响裂解导致质粒提取量和纯度偏低。
3、向离心管中加入250ul溶液Ⅱ,温和地上下翻转6-8次使菌体充分裂解。
注意:混匀一定要温和,以免污染细菌基因组DNA,此时菌液应变得清亮粘稠,作用时间不要超过5min,以免质粒受到破坏。
4、向离心管中加入350ul溶液Ⅲ,立即温和地上下翻转6-8次,充分混匀,此时会出现白色絮状沉淀。
12000rpm离心10min,用移液器小心地将上清转移到另一个干净的离心管中,尽量不要吸出沉淀。
Soil DNA Kit土壤基因组提取试剂盒Version 11032010‐2.6 I 组分说明Catalog no. CW2091 CW2091ANumber of preps 50 6Buffer SW 60 ml 2 × 5 mlBuffer SL 30 ml 3 mlBuffer SGL 30 ml 3 mlBuffer GWS 13 ml 3.8 mlBuffer GW1 19 ml 3.8 mlBuffer GW2 2 × 4.8 ml 2.6 mlBuffer GE 15 ml 2 mlSpin Column DM Collection Tube (2 ml) 505066Protocol 1 1II 保存条件自收到之日起,该试剂盒于室温干燥条件下(15-25℃)可保存一年。
III 产品特点本试剂盒用于土壤及海河沉淀物中总DNA的分离纯化。
专门的试剂与纯化柱能够有效去除杂质和腐殖酸。
每克土壤一般可提取得到5μg以上DNA,片段长度在30~50Kb左右。
本产品使用安全方便,单个样品操作一般可在40分钟内完成,得到DNA可直接用于PCR,Southern-blot和各种酶切反应等下游操作。
IV 注意事项1.第一次使用前应按照试剂瓶标签的说明先在Buffer GWS、GW1和Buffer GW2中加入无水乙醇。
2.若Buffer SL 和Buffer SGL中有沉淀,可在56℃水浴中重新溶解,摇匀后使用。
3.所有离心步骤均为使用台式离心机,室温下进行离心。
4.实验过程中,请自备70%乙醇。
V 操作步骤使用前请先在Buffer GWS、GW1和GW2中加入无水乙醇,加入体积请参照瓶上的标签。
1.取0.1g~0.3g土壤样本,加1ml Buffer SW,涡旋振荡1~3分钟(让管底的土壤振起来);12,000rpm(~13,400×g)离心1分钟,倒掉上清;2.加入750μl 70%乙醇,涡旋振荡1分钟(让管底的土壤振起来),12,000rpm(~13,400×g)离心1分钟,倒掉上清,并用移液枪吸尽余液;3.土壤中加入500μl Buffer SL,涡旋振荡1~3分钟(让管底的土壤振起来),65℃水浴20分钟(建议可每隔5分钟涡旋振荡5秒);12,000rpm(~13,400×g)离心3分钟,上清移至新的1.5ml离心管中;4.上清液中加等体积Buffer SGL,颠倒混匀15~25次,冰上放置5分钟;室温12,000rpm(~13,400×g)离心 5分钟;注意:冰上放置后液体可能会凝结,属正常现象5.上清转入Spin column DM中(Spin column DM事先放入1个2ml collection tube,若一次不能加完溶液,可分多次转入),12,000rpm(~13,400×g)离心1分钟,弃废液,将Spin column DM重新放入2ml collection tube 中;6.向Spin column DM中加入500μl Buffer GWS,12,000rpm(~13,400×g)离心 1分钟,弃废液,将Spin column DM重新放入2ml collection tube中;7.向Spin column DM中加入700μl Buffer GW1,12,000rpm(~13,400×g)离心1分钟,弃废液,将Spin column DM重新放入2ml collection tube中;8.向Spin column DM中加入500μl Buffer GW2,12,000rpm(~13,400×g)离心1分钟,弃废液。
Version 10112010 PlantGen DNA Kit植物基因组提取试剂盒Cat. No. CW0553保存:室温组分说明Cat.No. CW0553 CW0553A CW0553BKit Size 50 200 6Buffer GP1 40 ml 160 ml 5 mlBuffer GP2 40 ml 160 ml 5 mlBuffer GW1(concentrate)19 ml 76 ml 3.8 mlBuffer GW2(concentrate)13 ml 52 ml 2.6 mlBuffer GE 15 ml 60 ml 2 mlSpin Column DM 50 200 6Collection Tube(2ml) 50 200 6产品简介本试剂盒利用先进的硅胶膜技术和简单的离心程序可以简单快速地从植物或真菌中分离得到高纯度DNA。
本品可以在1小时内完成总DNA的全部提取过程,包括基因组DNA、线粒体DNA和叶绿体DNA。
纯化过程无需乙醇沉淀,提取后可以立即使用。
DNA特异性结合到硅胶膜上,PCR和其他酶促反应的抑制剂可通过两步有效的洗涤步骤去除,最后用低盐缓冲液或水洗脱下来的纯化DNA可以直接用于PCR、AFLP、RFLP、RAPD、Southern Blot、Microsatellite Analysis和Real-Time PCR 等下游操作。
注意事项1.样品应避免反复冻融,否则会导致提取的DNA片段较小且提取量下降。
2.所有离心步骤均应使用台式离心机,在室温下进行离心。
3.第一次使用前应按照试剂瓶标签的说明在Buffer GW1和Buffer GW2中加入无水乙醇。
4.使用前请先检查Buffer GP1和Buffer GP2是否出现浑浊,如有混浊现象,可在65℃水浴中加热几分钟,即可恢复澄清。
5.Buffer GP1在使用前请加入β-巯基乙醇,1 ml Buffer GP1加1 μl β-巯基乙醇。
质粒DNA 小量提取试剂盒一、产品简介采用SDS碱裂解法,结合硅胶膜选择性吸附DNA的方法,适合1-4ml细菌培养物中提取多至20 μg质粒DNA。
纯化的质粒DNA适合用于酶切、PCR、测序、转化和转染等分子生物学实验。
二、试剂盒组成和储存组成内容DK301-01 (50次) DK301-02 (200次)RNase A1*30 μl 120 μlBuffer BL 15 ml 60 mlBuffer P1 15 ml 60 mlBuffer P2 15 ml 60 mlBuffer P3 20 ml 90 mlBuffer WA§19 ml 75 mlBuffer WB§16 ml 65 mlDNA吸附柱-B 50套200套1.5 ml离心管50个200个TE※15 ml 30 ml说明书1份1份*RNase A1: 50 mg/ml, -20℃长期保存;第一次使用前将RNase A1全部加入Buffer P1中,于4℃保存。
§Buffer WA和Buffer WB,使用前按试剂瓶所示体积加入无水乙醇或者95%乙醇,混合均匀。
※TE:10 mM Tris-HCl, 0.1 mM EDTA, pH 8.0(25°C)。
除RNase A1和Buffer P1(已加入RNase A1)外,其他组成成分于室温储存。
三、注意事项1.Buffer P3和Buffer WA含刺激性化合物,避免沾染皮肤、眼睛和衣服、谨防吸入口鼻。
若沾染皮肤、眼睛,立即使用大量水或生理盐水冲洗沾染处,必要时寻求医疗咨询。
2. 使用后应及时盖紧试剂瓶盖子,以免影响下次使用效果。
3. 操作步骤A2和B2,充分悬浮细菌,无可见的块状菌团,不然会影响裂解效果。
4. 操作步骤A3和B3,缓慢翻转离心管,以免机械力打断基因组DNA而导致最后纯化的质粒DNA中有基因组DNA污染,同时避免打断质粒DNA,保持其完整性。
Version 10082010
FastPlasmid Mini Kit
质粒小提试剂盒
Cat. No. CW0511 保存:室温
更长时间的保存可置于2-8℃
组分说明
Cat. No. CW0511 CW0511A CW0511B
Kit Size 50 200 6 Buffer P1 15 ml 60 ml 3 ml Buffer P2 15 ml 60 ml 3 ml Buffer N3
20 ml 80 ml 5 ml Buffer PW (concentrate )
15 ml 50 ml 2 ml Buffer EB 10 ml 30 ml 1 ml RNase A (10 mg/ml ) 150 μl 600 μl 30 μl Spin Column CM 50
200
6
Collection Tube (2 ml )
50 200 6
产品简介
本试剂盒采用先进的新型硅胶膜吸附技术,可获得更大量的质粒。
菌体经碱裂解法处理后通过离心吸附柱,专一性结合DNA,洗去杂质,提取质粒DNA,无需酚抽提和乙醇沉淀,从而在保证提取量和纯度的情况下,将提取步骤减少到最少。
本试剂盒采用独特的缓冲液配方,每次可处理1-5 ml 菌液。
得到的DNA 可主要用于PCR、酶切、测序、转化等生物学实验。
注意事项
1 Buffer P1在使用前先加入RNase A(将试剂盒中提供的RNase A 全部加入),混匀,置于2-8℃保存。
2 第一次使用前应按照试剂瓶标签的说明在Buffer PW 中加入无水乙醇。
3
使用前请先检查Buffer P2 和Buffer N3 是否出现浑浊,如有混浊现象,可在37℃水浴中加热几分钟,即可恢复
澄清。
4 注意不要直接接触Buffer P2 和Buffer N3,使用后应立即盖紧盖子。
5 所有离心步骤均为使用常规台式离心机在室温下进行离心。
6
提取的质粒量与所提菌种培养浓度、质粒拷贝数等因素有关。
操作步骤
1.取1-5 ml 过夜培养的菌液,加入离心管中,>8000 rpm(~6800 x g)离心3分钟,尽量吸弃上清。
注意:质粒拷贝数较低或>10 kb时,可以使用更多菌液通过二次离心将菌体沉淀收集到同一个离心管中,同时后续所加试剂Buffer P1、P2及N3的量需加倍。
所加试剂的量必须能够充分裂解菌体,菌体过多、裂解不充分都会降低质粒的提取效率。
2.向留有菌体沉淀的离心管中加入250 μl Buffer P1(请先检查是否已加入RNase A),使用移液器或涡旋振荡器彻底悬
浮细菌沉淀。
注意:如果菌块未彻底混匀,将会影响裂解效果,使提取量和纯度偏低。
3.向离心管中加入250 μl Buffer P2,温和地上下颠倒混匀4-6次,使菌体充分裂解。
此时菌液应变得清亮粘稠。
所用时
间不应超过5分钟,以免质粒受损伤。
注意:不要剧烈震荡,以免造成所提质粒中出现基因组DNA污染。
如果溶液未变得清亮,提示可能菌量过大,裂解不彻底,应减少菌体量。
4.向离心管中加入350 μl Buffer N3,立即温和地上下颠倒混匀4-6次,此时出现白色絮状沉淀。
注意:Buffer N3加入后应立即充分混匀,避免产生局部沉淀。
室温放置时间不宜超过5分钟,以免损伤质粒。
5.13,000 rpm(~17,900 x g)离心10分钟,吸取上清,加入到已装入Collection Tube的Spin Column CM中, 注意
不要吸出沉淀。
注意:如果离心后上清中还有微小白色沉淀,可吸取上清于一个新的离心管中并再次离心。
在吸取上清时尽量不要吸出沉淀。
6.13,000 rpm(~17,900 x g)离心30-60秒,倒掉Collection Tube中的废液 ,将Spin Column CM放回Collection Tube
中。
7.向Spin Column CM中加入700 μl Buffer PW(请先检查是否已加入无水乙醇),13,000 rpm(~17,900 x g)离心
30-60秒,倒掉Collection Tube中的废液,将Spin Column CM重新放回Collection Tube中。
8.向Spin Column CM中加入500 μl Buffer PW(请先检查是否已加入无水乙醇),13,000 rpm(~17,900 x g)离心1
分钟,倒掉Collection Tube中的废液,将Spin Column CM重新放回Collection Tube中。
9.13,000 rpm(~17,900 x g)离心1分钟,倒掉废液。
将Spin Column CM开盖置于室温数分钟,以彻底晾干吸附膜上
残余的Buffer PW。
注意:这一步的目的是将吸附柱中残余的Buffer PW去除,Buffer PW中乙醇的残留会影响后续的酶促反应(酶切、PCR 等)。
10.将Spin Column CM置于一个新的离心管中,向吸附膜的中间部位悬空滴加50-100 μl Buffer EB,室温放置1-2分钟,
13,000 rpm(~17,900 x g)离心1分钟,将质粒溶液收集到离心管中。
-20℃保存质粒。
注意:1)为了增加质粒的回收效率,可将得到的溶液重新加入到Spin Column CM中,重复步骤10。
Buffer EB在65-70℃水浴预热,适当延长吸附和洗脱时间,可以增加提取效率。
2)洗脱液的pH值对于洗脱效率有很大影响。
若用水做洗脱液,应保证其pH值在7.0-8.5(可以用NaOH将水的pH值调到此范围),pH 值低于7.0会降低洗脱效率。
洗脱缓冲液体积不应少于50 μl,体积过小会影响回收效率。
3)如果使用TE洗脱,需要考虑其中含有的EDTA是否会影响后续的酶促反应。