4.1 含硫化合物的性质和应用
- 格式:doc
- 大小:38.50 KB
- 文档页数:2

含硫化合物的性质和应用知识点一硫元素在自然界中的存在1、主要存在形式(1)游离态(硫单质):主要存在于火山喷口附近或地壳的岩层里。
(2)化合态(硫化物、硫酸盐):主要存在于金属矿石中。
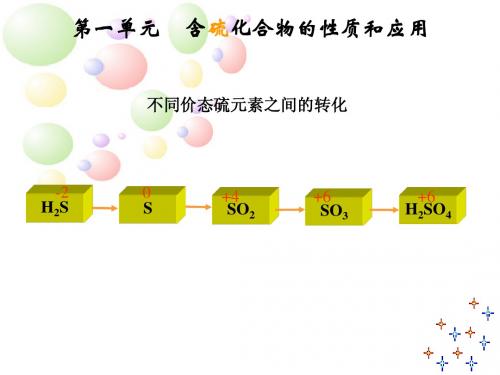
2、硫单质的性质(1)物理性质(2)化学性质知识点二二氧化硫的性质和作用1、物理性质2、化学性质二氧化硫是一种酸性氧化物,由于SO 2中硫元素为+4价,属于中间价态,所以SO 2既有还原性又有氧化性。
(1)酸性氧化物—亚硫酸酸酐,具有酸性氧化物的通性 ①与水反应:SO 2 + H 2OH 2SO 3(亚硫酸)②与碱反应:SO 2 (少量)+ Ca(OH)2 = CaSO 3↓+ H 2O ;不能用澄清石灰水鉴别CO 2和SO 2SO 2 (过量)+ Ca(OH)2 = Ca(HSO 3)2SO 2(少量) + 2NaOH = Na 2SO 3 + H 2O (实验室用NaOH 溶液来吸收SO 2尾气)③与盐反应:SO 2 (少量)+2NaHCO 3=Na 2SO 3 + CO 2 + H 2O (常用饱和NaHCO 3除去CO 2中的SO 2)【注意】酸性:盐酸>亚硫酸>碳酸,因此氯化钡溶液通入CO 2、SO 2时不发生反应。
(2)弱氧化性与H 2S 反应生成S 和H 2O ,其反应的化学方程式为:SO 2+ 2H 2S = 3S↓ + 2H 2O(归中反应) (3)强还原性①能使高锰酸钾褪色(除去CO 2中的SO 2)②2SO2 + O22SO3(可逆反应) 工业制硫酸的第二步反应③SO2 + X2+ 2H2O = 2HX + H2SO4(X2:Cl2Br2I2)使其褪色(4)漂白性(加合型)①原理:与某些有色物质(如品红溶液)化合成不稳定的无色物质。
②特点:不稳定,久置或加热会恢复原色。
③不漂白酸碱指示剂I 漂白原理分类II SO2和Cl2漂白比较(3)氯气和二氧化硫按1:1的比例通入品红溶液中,无现象:SO2+ Cl2+ 2H2O= 2HCl + H2SO43、二氧化硫的实验室制法(1)制取原理: Na2SO3+H2SO4===Na2SO4+H2O+SO2↑(2)二氧化硫使以下溶液产生不同现象的原理对比4、鉴别SO2和CO2的方法(1)用品红溶液,使品红溶液褪色的是二氧化硫,不能使品红溶液褪色的是二氧化碳。




《含硫化合物的性质和应用》说课稿尊敬的各位评委、老师:大家好!今天我说课的题目是《含硫化合物的性质和应用》。
下面我将从教材分析、学情分析、教学目标、教学重难点、教法与学法、教学过程以及教学反思这几个方面来展开我的说课。
一、教材分析本节课是高中化学必修课程中的重要内容,选自人教版化学必修 1第四章第三节。
含硫化合物在生产、生活和环境中都具有重要的地位和广泛的应用。
通过对含硫化合物性质的学习,学生能够深入理解元素化合物的性质和转化规律,为后续学习元素周期律和化学反应原理等知识奠定基础。
教材首先介绍了硫元素在自然界中的存在形式,然后依次阐述了二氧化硫、硫酸等含硫化合物的物理性质、化学性质和用途。
同时,教材还注重培养学生的环保意识,引导学生关注含硫化合物对环境的影响。
二、学情分析学生在之前的学习中已经掌握了氧化还原反应、物质的分类等基础知识,具备了一定的实验探究能力和分析问题的能力。
但是,对于含硫化合物的性质和应用,学生还缺乏系统的认识和深入的理解。
此外,学生在学习过程中可能会遇到一些困难,如二氧化硫的化学性质较为复杂,学生容易混淆和遗忘。
三、教学目标1、知识与技能目标(1)了解硫元素在自然界中的存在形式。
(2)掌握二氧化硫的物理性质、化学性质和用途。
(3)理解硫酸的物理性质、化学性质和用途。
2、过程与方法目标(1)通过实验探究,培养学生的观察能力、实验操作能力和分析问题的能力。
(2)通过对含硫化合物性质的学习,培养学生的逻辑思维能力和归纳总结能力。
3、情感态度与价值观目标(1)培养学生的环保意识,让学生认识到含硫化合物对环境的影响,树立可持续发展的观念。
(2)激发学生学习化学的兴趣,培养学生的创新精神和合作意识。
四、教学重难点1、教学重点(1)二氧化硫的化学性质。
(2)硫酸的化学性质。
2、教学难点(1)二氧化硫的漂白性原理。
(2)浓硫酸的强氧化性。
五、教法与学法1、教法(1)实验探究法:通过实验让学生直观地感受含硫化合物的性质,激发学生的学习兴趣和探究欲望。
加热加热加热点燃加热 点燃 加热课题含硫化合物的性质及其应用教学过程一、硫及其重要化合物的主要性质及用途: 1.硫:(1)物理性质:硫为淡黄色固体;不溶于水,微溶于酒精,易溶于CS 2(用于洗去试管壁上的硫);硫有多种同素异形体:如单斜硫、斜方硫、弹性硫等。
(2)化学性质:硫原子最外层6个电子,较易得电子,表现较强的氧化性。
①与金属反应(与变价金属反应,均是金属氧化成低价态) 2Na+S===Na 2S (剧烈反应并发生爆炸)2Al+3S Al 2S 3(制取Al 2S 3的唯一途径)Fe+S FeS (黑色)2Cu + S Cu 2S (黑色) ②与非金属反应S+O 2 SO 2S+H 2H 2S (说明硫化氢不稳定)③与化合物的反应S+6HNO 3(浓)H 2SO 4+6NO 2↑+2H 2OS+2H 2SO 4(浓) 2SO 2↑+2H 2O3S+6NaOH 2Na 2S+Na 2SO 3+3H 2O (用热碱溶液清洗硫)(3)用途:大量用于制造硫酸、硫化天然橡胶,也用于制药和黑火药。
2.硫的氢化物: ①硫化氢的制取:Fe+H 2SO 4(稀)=FeSO 4+H 2S ↑(不能用浓H 2SO 4或硝酸,因为H 2S 具有强还原性) ——H 2S 是无色、有臭鸡蛋气味的有毒气体;能溶于水,密度比空气略大。
②硫化氢的化学性质A .可燃性:当22/O S H n n ≥2/1时,2H 2S+O 22S+2H 2O (H 2S 过量)当22/O S H n n ≤2/3时,2H 2S+3O 2点燃2SO 2+2H 2O (O 2过量)当23222<<O SH n n 时,两种反应物全部反应完,而产物既有硫又有SO 2 B .强还原性:常见氧化剂Cl 2、Br 2、Fe 3+、HNO 3、KMnO 4等,甚至SO 2均可将H 2S 氧化。
加热SO2 SO2 CO2 CO2C.不稳定性:300℃以上易受热分解③H2S的水溶液叫氢硫酸,是二元弱酸。
含硫化合物的性质和应用知识点1:二氧化硫的性质1.物理性质:二氧化硫是一种无色,有刺激性气味,有毒的气体,易液化(-10℃),易溶于水(1 : 40)。
2.化学性质:(1)酸性氧化物:可与水发生反应生成相应酸-——亚硫酸(亚硫酸为中强酸);SO2+H2O H2SO3;可与碱反应生成盐和水;(2)强还原性:处于硫元素的中间价态,具有还原性(强),可与过氧化氢、氧气、卤素单质、高锰酸钾等反应:。
(3)弱氧化性:SO2具有氧化性(弱),可以氧化硫化氢生成单质S:。
(4)漂白性:二氧化硫具有漂白性,可使品红溶液褪色,能漂白纸浆、丝、毛、草制品等。
SO2的漂白原理与Na2O2、H2O2、O3、HClO、漂白粉等不同,是SO2与有色物质化合生成不稳定的无色物质,这些无色物质容易分解而恢复原色,故SO2的漂白是暂时性的,过程是可逆的。
Na2O2、H2O2、O3、HClO、漂白粉等的漂白性是由于它们的强氧化性,且漂白后颜色不再恢复,是永久的漂白,过程是不可逆的。
知识点 2:酸雨的成因和防治1.雨水的pH:正常雨水,pH<7,约在6左右,是由于大气中的CO2溶解在雨水里形成碳酸的缘故。
酸雨:pH小于5.6的雨水称为酸雨。
2.硫酸型酸雨的形成与防治:形成原因:化石燃料及其产品的燃烧、含硫金属矿石的冶炼和硫酸的生产等产生的废气中含有二氧化硫;酸雨的防治:开发新能源,对含硫燃烧进行脱硫处理,提高环境保护意识。
【同步训练】1.下列物质中,不能使品红溶液褪色的是A.Cl2B.HCl C.SO2 D.活性炭2.下列关于二氧化硫的叙述中错误的是()A.在高温下二氧化硫可被催化氧化成三氧化硫B.二氧化硫可使品红溶液褪色C.二氧化硫既具有氧化性又具有还原性D.二氧化硫与水反应生成硫酸3.既使石蕊试液最终变为红色,又能使品红试液变为无色,还能使溴水褪色的是()A.Cl2B.H2S C.SO2D.CO4.盛有氯化钡稀溶液的甲乙两试管分别通入SO2至饱和,若向甲试管中加入足量氯水,乙试管中加入足量氢氧化钠溶液,则下列叙述正确的是()A.甲、乙两试管都有白色沉淀生成B.甲、乙两管都没有白色沉淀生成C.甲管没有白色沉淀生成而乙试管有D.甲管有白色沉淀而乙试管没有5.将等物质的量的SO 2和Cl 2混合均匀后(SO 2+ Cl 2+2H 2O=2HCl +H 2SO 4),通入以下溶液,下列说法不正确的是( )A .品红溶液褪色B .AgNO 3溶液产生沉淀C .BaCl 2溶液产生沉淀D .石蕊试液变红6.能与SO 2气体发生反应且有沉淀产生的是①NaOH 溶液 ②CaCl 2溶液 ③Ca (OH)2溶液 ④BaCl 2和H 2O 2的混合液A .①②③B .②③④C .全部D .③④7.向装置中缓慢通入气体X ,若关闭活塞K ,则品红试液无变化,而澄清石灰水变浑浊;若打开活塞K ,则品红试液褪色。
含硫化合物的性质与反应硫是一种常见的元素,它在自然界和化学反应中都扮演着重要角色。
硫可以与其他元素形成含硫化合物,在化学研究和工业生产中具有广泛的应用。
本文将介绍含硫化合物的性质和反应,以及一些相关的应用。
一、含硫化合物的性质1. 物理性质:含硫化合物通常呈现出白色或黄色结晶固体,具有特定的熔点和沸点。
一些含硫化合物也可溶于水或有机溶剂中。
此外,它们往往具有恶臭的气味,如硫化氢(H2S)。
2. 化学性质:含硫化合物在化学反应中表现出一系列特征。
首先,它们能够与氧气反应生成硫酸,这是含硫化合物最常见的反应之一。
例如,二氧化硫(SO2)与水反应形成亚硫酸(H2SO3),进一步氧化则形成硫酸(H2SO4)。
其次,含硫化合物还可以与金属离子反应生成金属硫化物。
这种反应常被用于化学分析和沉淀反应。
最后,含硫化合物还能够参与氧化还原反应,例如硫酸铜与铁反应形成硫酸亚铁和硫。
二、含硫化合物的反应1. 氧化反应:氧化反应是含硫化合物最常见的反应之一。
例如,硫化氢与氧气反应生成二氧化硫和水。
反应方程式如下:2H2S + O2 -> 2SO2 + 2H2O此外,硫化物也可以以其他形式参与氧化反应,产生不同的硫氧化物。
2. 还原反应:含硫化合物也可以参与还原反应。
例如,金属硫化物可以与氧化剂反应,将硫还原为硫化物。
这种反应在冶金和电化学工业中常被应用。
3. 酸碱反应:含硫化合物通常表现出酸性反应。
例如,硫化氢溶于水会生成硫酸,并具有酸性溶液的性质。
与碱性物质反应时,硫化物离子会与金属离子结合形成金属硫化物沉淀。
三、含硫化合物的应用1. 工业生产:含硫化合物在许多工业领域有重要应用。
例如,二氧化硫广泛用于造纸、制药、食品和化肥工业中。
硫化氢则在石油和矿石冶炼过程中用作氧化剂和消毒剂。
2. 化学分析:含硫化合物通常用于化学分析,用于检测金属离子。
通过与金属离子反应生成可溶性或不溶性的金属硫化物沉淀,可以实现对金属离子的检测和定量。
硫及其化合物
【考纲要求】
1.了解硫元素在自然界中的存在形式及硫单质的性质。
2.掌握SO 2的性质。
3.掌握H 2SO 4的性质及特性和用途。
4.了解常见的漂白剂及漂白原理。
5.了解大气污染的来源、危害与治理,联系实际,对化工生产,环境保护作常识性了解。
【课时】1课时
【课前准备】(自主梳理)
一、硫和硫的氧化物
1.单质硫和过氧化钠都是 _________色固体。
2.硫的化合价位于_______价,既有_______性又有_______。
3.二氧化硫
(1)SO 2的物理性质
①颜色、状态:SO 2是一种 色、有 气味的气体。
②溶解性:SO 2 溶于水,且易液化。
③毒性:SO 2有毒,尾气中的SO 2用 溶液吸收。
④密度:SO 2的密度比空气的 ,收集SO 2用 。
(2)SO 2的化学性质
①具有酸性氧化物的通性
A .与H 2O 反应
SO 2与水反应生成H 2SO 3,化学方程式为
B .使指示剂变色:SO 2能使石蕊试液变 色。
注意:SO 2不能使指示剂褪色。
C .与碱反应
当NaOH 足量时,反应的化学方程式为 ; 当NaOH 不足量时,反应的化学方程式为 。
D .可与碱性氧化物或某些盐反应。
SO 2与Na 2SO 3溶液反应生成NaHSO 3,化学方程式为: ②氧化性
将SO 2通入到氢硫酸(H 2S 溶液)中:
A .反应的化学方程式为: ;
B .实验现象:产生 。
③还原性
A .SO 2被O 2氧化成SO 3的化学方程式为 。
B .SO 2的水溶液能被X 2(Cl 2、Br 2、I 2)氧化,如SO 2能使溴水褪色,反应的化学方程式为 。
C .SO 2能使酸性KMnO 4溶液的紫红色褪去,反应的离子方程式为
___________________________________________________________________。
④漂白性
SO 2+H 2O +有色物质――→化合不稳定无色物质――→△有色物质
4.三氧化硫
(1)SO3与水的反应:,反应放出大量的热。
(2)SO3是酸性氧化物,它跟碱性氧化物或碱都能反应生成硫酸盐。
①SO3与氧化钙的反应:。
②SO3与Ca(OH)2的反应:。
【思考】
1.有两瓶经过Cl2和SO2漂白的品红溶液,如何通过简单实验鉴别?将等量Cl2与SO2通入品红溶液,漂白性是否增强?
2.SO2使溴水或高锰酸钾溶液褪色体现了SO2的什么性质?
二、硫酸的性质及用途
1.稀硫酸
(1)跟酸碱指示剂作用,能使紫色石蕊试液变色。
(2)跟活泼金属反应
稀H2SO4与金属锌反应的化学方程式:。
(3)跟碱性氧化物反应
氧化铜与稀硫酸反应的离子方程式:。
(4)跟碱反应
氢氧化钡与稀硫酸反应的化学方程式:。
(5)跟某些盐反应
碳酸钠与稀硫酸反应的化学方程式:
2.浓硫酸
(1)物理性质
纯H2SO4是无色油状液体,沸点高,难挥发,密度大于水,溶解于水时放出。
(2)特性
①吸水性(常用作干燥剂)
a.可用浓H2SO4干燥的气体有:H2、O2、N2、CO2、Cl2、HCl、SO2、CO、CH4、C2H2、C2H4等。
b.不能用浓硫酸干燥的气体有:碱性气体,如;还原性气体,如等。
②脱水性
浓H2SO4将有机物里的氢、氧元素按原子个数的比例脱去,例如:
(3)强氧化性
①与金属的反应
浓H2SO4能氧化Cu等不活泼的金属,反应的化学方程式为
注意:冷的浓H2SO4能使铁、铝发生钝化。
②与非金属的反应
加热条件下浓H2SO4能氧化C等非金属单质,反应的化学方程式为
3.SO2-4的检验
检验SO2-4的正确操作是:
SO32—的检验
______________________________________________________
4.硫酸的用途
_______________________________________________________________________________ 【思考】
3.浓H2SO4用做干燥剂时,能干燥哪些气体?不能干燥哪些气体?
4.如何鉴别浓H2SO4和稀H2SO4?试列举可能的方法。