电化学-第二章电极与电极过程概述(极力推荐)
- 格式:ppt
- 大小:418.00 KB
- 文档页数:21





第二章电化学反应热力学第一节电化学体系一、两类电化学装置镀锐是重要电化学工业之一,其装置示意图如图2.1所示镀锐溶液(主要成分为NiS04,还有缓冲剂、添加剂等)电解槽或电解池:把两个电极与直流电源连结,使电流通过体系的装置原电池或化学电源:在两电极与外电路中的负载接通后自发地将电能送到外电路的装置。
上述两类电化学装置,也称为电化学体系。
® 2.1镀锐装置示意原电泡与电解池的两个电极之间存在着电位差,电位较高的电极称为正极,电位较低的电极称为负极。
在自发电池中,电流(习惯上指正电荷)自正极经外电路流向负极。
电解池的正、负极分别与外电源的正、负极相连。
事实上,在外电路传送的电荷都是电子,电子流动方向与习惯上认为的电流方向相反。
人为规定使正电荷由电极进入溶液的电极称为阳极,使正电荷由溶液进入电极的电极称为阴极,在阳极上进行氧化反应,在阴极上进行还原反应。
在电解时,正极是阳极,负极是阴极。
在原电池中负极是阳极,正极是阴极。
用正、负极名称是按电位高低来区分,用阴、阳极名称是按电极进行还原或氧化反应来区分。
也有用氧化极、还原极来称呼电极的,前者即阳极、后者为阴极。
电流通过电化学体系,必须有两类导体:电子导体和离子导体,以及在这两类导体的界面上进行电化学反应。
因此,电化学的研究对象应当包括三部分:电子导体、离子导体、两类导体的界面及其上发生的一切变化。
电子导体届丁物理研究的范围,在电化学中一般只引用它们所得的结论。
离子导体包括电解质溶液、熔融盐和固体电解质。
经典电化学的主要内容:电解质溶液理论。
近代电化学的主要内容:两类导体的界面性质及界面上所发生的变化,涉及化学热力学和化学动力学的许多问题。
电化学包括的基本内容为电解质溶液理论,电化学平■衡和电极对程动力学能量的转换:电解池,把电能转变为化学能;化学电源,使化学能转变为电能。
电化学主要是研究化学能和电能之间相互转化以及和这过程有关的定律和规则的科学。



第一章电化学理论基础1.1 电化学体系的基本单元1.1.1所有电化学体系至少含有浸在电解质溶液中或紧密附于电解质上的两个电极, 而且在许多情况下有必要采用隔膜将两电极分隔开。
1.1.2电极电极(electrode)是与电解质溶液或电解质接触的电子导体或半导体, 为多相体系。
电化学体系借助于电极实现电能的输入或输出, 电极是实施电极反应的场所。
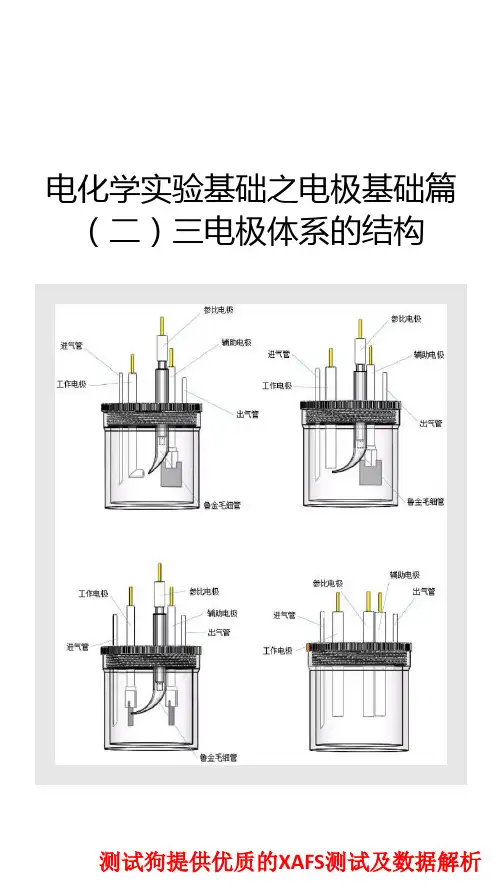
一般电化学体系为三电极体系, 相应的三个电极为工作电极、参比电极和辅助电极。
化学电源一般分为正、负极;而对于电解池, 电极则分为阴、阳极。
现介绍如下。
工作电极(working electrode, 简称WE): 又称研究电极, 是指所研究的反应在该电极上发生。
一般来讲, 对于工作电极的基础要求是: 所研究的电化学反应不会因电极自身所发生的反应而受到影响, 并且能够在较大的电位区域中进行测试;电极必须不与溶剂或电解液组分发生反应;电极面积不宜太大, 电极表面最好应均一、平滑的, 且能够通过简单的方法进行表面净化等等。
工作电极可以是固体, 也可以是液体, 各式各样的能导电的固体材料均能作电极。
通常根据研究的性质来预先确定电极材料, 但最普通的“惰性”固体电极材料是玻璃、铂、金、银、铅和导电玻璃等。
采用固体电极时, 为了保证实验的重现性, 必须注意建立合适的电极预处理步骤, 以保证氧化还原、表面形貌和不存在吸附杂质的可重现状态。
在液体电极中, 汞和汞齐是最常用的工作电极, 它们都是液体, 都有可重现的均相表面, 制备和保持清洁都较容易, 同时电极上高的氢析出超电势提高了在负电位下的工作窗口, 已被广泛用于电化学分析中。
辅助电极(counter electrode,简称CE):又称对电极, 该电极和工作电极组成回路, 使工作电极上电流畅通, 以保证所研究的反应在工作电极上发生, 但必须无任何方式限制电池观测的响应。
由于工作电极发生氧化或还原反应时, 辅助电极上可以安排为气体的析出反应或工作电极反应的逆反应, 以使电解液组分不变, 即辅助电极的性能一般不显著影响研究电极上的反应。