化学.新高考总复习选修5 第2节 烃和卤代烃
- 格式:pptx
- 大小:6.38 MB
- 文档页数:66



1、卤代烃(属于烃的衍生物)(1)定义:烃分子中的氢原子被卤素原子取代后所生成的化合物,通式为R-X,官能团是-X。
饱和一卤代烃通式:C n H2n+1X(2)分类:按分子中所含卤素原子种类的不同,分为氟代烃、氯代烃、溴代烃、碘代烃。
(3)物理性质:①状态:常温下,大多数卤代烃为液体或固体。
(CH3Cl为气体)②溶解性:卤代烃都不溶于水,能溶于大多数有机溶剂,某些卤代烃自身就是很好的有机溶剂。
③熔沸点:随碳原子数的增加而升高。
④密度:随碳原子数的增加而降低,除一氟代烃和一氯代烃比水轻外,其余卤代烃都比水重。
注:卤代烃分子中不一定含有H原子。
如CCl4、F2C=CF2等2、溴乙烷A. 分子组成和结构名称分子式结构式结构简式官能团球棍模型比例模型溴乙烷C2H5Br CH3CH2Br—BrB. 物理性质颜色状态沸点密度溶解性无色液体38O CρC2H5Br>ρH2O不溶于水,易溶于有机溶剂C. 化学性质溴乙烷化学性质稳定,一般不会被酸性高锰酸钾、溴水等强氧化剂氧化。
但能与NaOH水溶液、NaOH醇溶液发生反应。
(1)水解反应(取代反应)溴乙烷与NaOH水溶液的反应:(2)消去反应:有机物在一定条件下,从一个分子中相邻的两个碳原子上脱去一个或几个小分子(如H2O、HX等),而生成含不饱和键化合物的反应。
溴乙烷与NaOH的乙醇溶液反应:3、卤代烃的水解反应与消去反应A. 取代(水解)反应(1)反应条件:强碱的水溶液、加热。
(2)反应本质:卤代烃分子中的—X被水分子中的—OH 所取代:RCH 2X+NaOHRCH 2OH+NaX (X 表示卤素原子)2H O △(3)反应规律:所有的卤代烃在强碱(如NaOH )的水溶液中加热均能发生取代(水解)反应。
B. 消去反应(1)反应条件:强碱的醇溶液、加热。
(2)反应本质:相邻的两个碳原子间脱去小分子HX :CH 3CH 2X+NaOHCH 2=CH 2↑+NaX+H 2O (X 表示卤素原子)乙醇△(3)反应规律:①没有邻位碳原子的卤代烃不能发生消去反应,如CH 3Cl 。

| . . | 封 | . . | 裁 | . . | 封 | . . | 订 | . . | 甲烷的四种氯代物均难溶于水, 常温下,只有 CH3Cl 是气态,其余均为液态, CHCl 3 俗称氯仿, CCl 4 又叫四氯化碳,是重要的有机溶剂,密度比水大。
(2)乙烯| . . | . | | .线.. . | . 裁| | . . 烃与卤代烃 裁 | . | 封 | . . | 要点精讲订|一、几类重要烃地代表物比较 . | . 结构特点线 | . . . . | 裁 | . . | 封 | . . | 订 | . . | 线 | . . . . | 裁 | . . | 封 | . . | 、化学性质订 | . 知识点总结封 | . . | 订 | . . | 线 | . . . . | 裁 | . . | 封 | . . | 订 | . . | 线 | . . . . | 裁 | . . | 封 | . . | 订 . ()甲烷第一步: CH4+Cl CH Cl+HCl| . . |.线第二步: CH Cl+ Cl CH Cl +HCl |.| .第三步: CH Cl + Cl CHCl +HCl .. .| . 裁 第四步: CHCl +ClCCl 4+HCl|| . . | 封 | . . |裁 | . . | 封 | . . | 订 | . . | - 890kJ/mol②取代反应:有机物物分子里的某些原子或原子团被其他原子或原子团所替代的反应。
甲烷与氯气的取代反应分四步进行:| . . | 封 .|. | ||| 线. 裁. 线 | | |.裁 | 裁封 . . |. . | . 裁 | | 裁 . ①与卤素单质 X 加成 | ..|CH =CH +X →CH X — CH X .| 封 . ②与 H 加成| . . |催化剂. 订| |CH =CH+H △CH—CH 订 . . | ③与卤化氢加成 . 线 | .CH =CH +HX →CH —CH X |. . . ④与水加成. |催化剂.裁CH =CH +H OCH CH OH|. | . ⑤氧化反应. | . 封 | | ①常温下被氧化,如将乙烯通入酸性高锰酸钾溶液,溶液地紫色褪去。
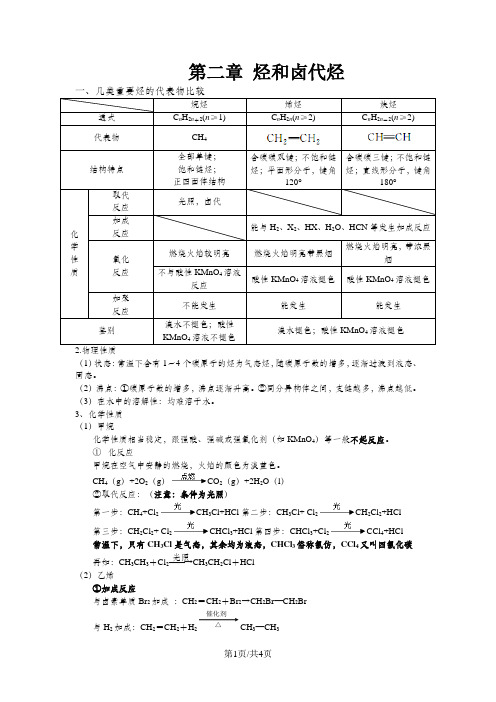
第二章 烃和卤代烃一、几类重要烃的代表物比较C n H 2n (n ≥2)C n H 2n -2(n ≥2)含碳碳双键;不饱和链含碳碳三键;不饱和链(1)状态:常温下含有1~4个碳原子的烃为气态烃,随碳原子数的增多,逐渐过渡到液态、固态。
(2)沸点:①碳原子数的增多,沸点逐渐升高。
②同分异构体之间,支链越多,沸点越低。
(3)在水中的溶解性:均难溶于水。
3、化学性质 (1)甲烷化学性质相当稳定,跟强酸、强碱或强氧化剂(如KMnO 4)等一般不起反应。
① 化反应甲烷在空气中安静的燃烧,火焰的颜色为淡蓝色。
CH 4(g )+2O 2(g )CO 2(g )+2H 2O (l ) ②取代反应:(注意:条件为光照) 第一步:CH 4+Cl 2CH 3Cl+HCl 第二步:CH 3Cl+ Cl 2CH 2Cl 2+HCl第三步:CH 2Cl 2+ Cl 2CHCl 3+HCl 第四步:CHCl 3+Cl 2CCl 4+HCl 常温下,只有CH 3Cl 是气态,其余均为液态,CHCl 3俗称氯仿,CCl 4又叫四氯化碳再如:CH 3CH 3+Cl 2――→光照CH 3CH 2Cl +HCl (2)乙烯①加成反应与卤素单质Br 2加成 :CH 2=CH 2+Br 2→CH 2Br —CH 2Br与H 2加成:CH 2=CH 2+H 2CH 3—CH 3催化剂 △与卤化氢加成:CH 2=CH 2+HX →CH 3—CH 2X与水加成 :CH 2=CH 2+H 2O CH 3CH 2OH (工业制乙醇的方法) ②氧化反应常温下被氧化,如将乙烯通入酸性高锰酸钾溶液,溶液的紫色褪去。
易燃烧 :CH 2=CH 2+3O 22CO 2+2H 2O 现象(火焰明亮,伴有黑烟) ③加聚反应(口诀:双键变单键,两边添横线,横线加括号,“n ”右下边)例如: n CH 2=CH 2――→催化剂 (3)烯烃的顺反异构①.顺反异构:由于碳碳双键不能旋转,导致分子中原子或原子团在空间的排列方式不同所产生的异构现象。
