(免费 高考题)高中化学平衡移动图像题大全
- 格式:pdf
- 大小:50.74 MB
- 文档页数:111

高二化学平衡移动图像问题专项训练题一、单选题1.在不同条件下进行化学反应2A(g) B(g) + D(g), B、 D起始浓度均为0,反应物A的浓度-1序号0 20 40 50①800 1.0 0.67 0.50 0.50②800 x 0.50 0.50 0.50③800 y 0.75 0.60 0.60④820 1.0 0.25 0.20 0.20下列说法不正确的是( )A.①中B在0~20min平均反应速率为8.25x10-3mo1·L-1min-1B.②中K=0.25,可能使用了催化剂C.③中Y=1.4mo1·L-1D.比较①、④可知,该反应为吸热反应2.烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g)C2H5OH(g)。
乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1L)。
下列分析不正确的是( )A.乙烯气相直接水合反应的ΔH<0B.图中压强的大小关系为:p1>p2>p3C.图中a点对应的平衡常数K=5/16D.达到平衡状态a、b所需要的时间:a>b3.升高温度,下列各项的值可能减小的是( )A.化学反应速率vB.NaCl的溶解度SC.化学平衡常数KD.弱酸的电离平衡常数K a4.在恒容密闭容器中进行反应:2CO2(g)+6H2(g)C2H5OH(g)+3H2O(g) ΔΗ在某压强下起始时按不同氢碳比[n(H2)/n(CO2)]投料(见图中曲线①②③ ),测得CO2的平衡转化率与温度的关系如图所示,下列有关说法正确的是( )A.该反应的ΔΗ>0B.氢碳比:① <② <③C.其他条件不变的情况下,增大容器的体积可提高CO 2的转化率D.若起始时CO 2浓度为2mol·L -1,H 2浓度为4mol·L -1,在图中曲线③ 氢碳比条件下进行反应,则400K 时该反应的平衡常数数值约为1.75.在某容积一定的密闭容器中,有下列可逆反应:()()()A g +B g xC g H 僔未知,有图Ⅰ所示的反应曲线,试判断对图Ⅱ的说法中正确的是(T 表示温度,P 表示压强,C%表示C 的体积分数( )A. 34P >P ,y 轴表示C 的转化率B. 34P <P ,y 轴表示B 的体积分数C. 34P <P ,y 轴表示混合气体的密度D. 34P >P ,y 轴表示混合气体的平均摩尔质量6.在一恒温、恒容密闭容器中发生反应:()()()()50~804180~200Ni s +4CO g Ni CO g ,H<0垐垐垎V 噲垐垐℃℃利用该反应可以将粗镍转化为纯度达99.9%的高纯镍.对该反应的说法正确的是( ) A. 增加Ni 的量可提高CO 的转化率,Ni 的转化率降低℃ B. 缩小容器容积,平衡右移,H V 减小C. 反应达到平衡后,充入CO 再次达到平衡时,CO 的体积分数降低D. 当()()44v Ni CO =v CO ⎡⎤⎣⎦正正时或容器中混合气体密度不变时,都可说明反应已达化学平衡状态7.以下自发反应可以用熵判据来解释的是( ) A. ()()()222N g +2O g ==2NO g H=+67.7kJ/mol VB. ()()()23CaO s +CO g ==CaCO s H=-175.5kJ/mol VC. ()()()()434332NH CO s ==NH HCO s +NH g H=+74.9kJ/mol VD. ()()()2222H g +O g ==2H O l H=-285.8kJ/mol V 8.工业上以CH 4为原料制备H 2的原理为CH 4(g)+H 2O(g)4CO(g)+3H 2(g) ΔΗ>0。

1.在一定条件下,反应A (气)+B (气)C (气)(正反应放热),达到平衡后,根据下列图象判断:(1)升温,达到新的平衡的是 。
(2)降压,达到新的平衡的是 。
(3)减少C 的量,移向新平衡的是 。
(4)增加A 的量,移向新平衡的是 。
(5)使用催化剂,达到平衡的是 。
2、已知某可逆反应:mA (g )+nB (g )r C (g )在密闭容器中进行。
右图表示此反应在不同时间t ,温度T 和压强p 与反应物B 在混合气体中的百分含量(B%)的关系曲线。
由 曲线分析下列判断正确的是( )A.T 1>T 2,p 1>p 2,m +n >r ,正反应吸热B.T 1<T 2,p 1<p 2,m +n <r ,正反应吸热C.T 1>T 2,p 1>p 2,m +n <r ,正反应放热D.T 1<T 2,p 1<p 2,m +n >r ,正反应放热 3.在密闭容器中进行下列反应:M(g)+ N(g) R(g) + 2L 此反应符合右图,下列叙述正确的是( )A .正反应放热 ,L 是气体B .正反应放热 ,L 是固体C .正反应吸热 ,L 是气体D .正反应吸热, L 是固体 4、右图是温度和压强对X +Y2Z 反应影响的示意图。
图中横坐标表示平衡混合气体中Z 的体积分数。
下列叙述正确的是( ) A X 和Y 中只有一种为气态,Z 为气态 B X 、Y 、Z 均为气态C 上述可逆反应的正反应为放热反应D 上述反应的逆反应的ΔH>0(即吸热反应) 5、下列各图是温度或压强对反应2A(s)+2B(g)2C(g)+D(g)(正反应为吸热反应)的正逆反应速率的影响,其中正确的图象是( )DV 正V 逆PVCV 正 V 逆PvBV 正V 逆TVAV 正V 逆TV6、已知反应N2(g)+3H2(g )2NH3(g);△H<0,向某体积恒定的密闭容器中按体积比1∶3充入N2和H2,在一定条件下发生反应,下图是某物理量Y随时间(t)变化的示意图,Y不可以...是()A.密闭容器的压强B.混合气体的密度C.N2的转化率D.混合气体的平均摩尔质量7.对于可逆反应A(g)+2B(g)2C(g)(正反应吸热),下列图象中正确的是8、用来表示可逆反应3A(g)+B(g )2C(g)(正反应为放热反应)的图像正确的是()9、在某一密闭容器中,充入一定量的HI气体,发生反应2HI(气) H2(气)+I2(气) △H >0,在t1时达到平衡,t2时加热升温并保温,到t3时又达到新平衡,符合这一变化的图像是( )10、反应2A(g)+B(g) 2C(g);ΔH= a kJ/mol,在不同温度(T1和T2)及压强(P1和P2)下,Y的物质的量n(Y) 与反应时间(t)的关系如下图所示,下列判断正确的是A.Y可能是A或B,a<0B. Y可能是A或B,a>0C.Y一定是C,a<0D. Y一定是C,a>0HI%11、在容积固定的密闭容器中存在如下反应:A(g)+3B(g) 2 C(g)(正反应放热),某研究小组研究了其它条件不变时,改变某一条件对上述反应的影响,并根据实验数据作出右边关系图。

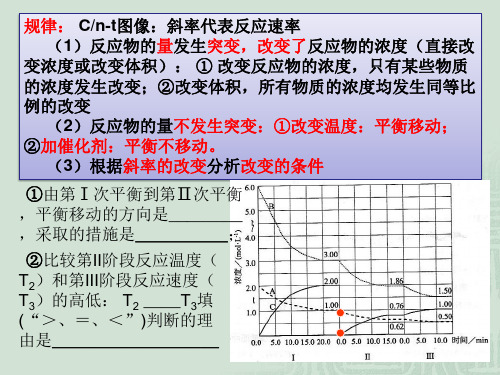
平衡移动&图象作业题作业题目难度分为3档:三星☆☆☆(基础题目)四星☆☆☆☆(中等题目)五星☆☆☆☆☆(较难题目)本套作业题目3,7题为三星,1-2,4-6,8-20为四星。
1.在容积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)2SO3(g)△H<0,某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的()☆☆☆☆A.图Ⅰ研究的是t0时刻增大O2的物质的量浓度对反应速率的影响B.图Ⅱ研究的是t时刻通入氦气增大体系压强对反应速率的影响C.图Ⅲ研究的是催化剂对化学平衡的影响,且甲的催化效率比乙高D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较高【解答】A.增大反应物的浓度瞬间,正反速率增大,逆反应速率不变,之后逐渐增大,图Ⅰ应是增大压强的原因,故A错误;B.图Ⅱ在t时刻正逆反应速率都增大,但仍相等,平衡不发生移动,应是加入催化剂的原因,故B错误;C.图Ⅲ甲、乙两个平衡状态不同,而加入催化剂,平衡不发生移动,故C错误;D.正反应放热,升高温度,反应速率增大,平衡向逆反应方向移动,SO2的转化率减小,故D正确.2.可逆反应2SO 2(g)+O 2(g)2SO 3(g)△H<0,在一定条件下达到平衡状态,时间为t 1时改变条件.化学反应速率与反应时间的关系如图所示.下列说法正确的是()☆☆☆☆A.维持温度、容积不变,t 1时充入SO 3(g)B.维持压强不变,t 1时升高反应体系温度C.维持温度、容积不变,t 1时充入一定量Ar D.维持温度、压强不变,t 1时充入SO 3(g)【解答】A.维持温度、反应体系体积不变,t 1时充入SO 3,此时正逆反应速率均增大,故A 错误;B.维持压强不变,t 1时升高反应体系温度,正逆反应速率都增大,不符合,故B 错误;C.维持温度、容积不变,t 1时充入一定量Ar,反应物和生成物的浓度都不变,正逆反应速率都不变,故C 错误;D.维持温度、压强不变,t 1时充入SO 3,该时刻生成物三氧化硫的浓度增大,则逆反应速率增大,但是压强不变,所以体积增加,反应物二氧化硫和氧气的浓度减小,正反应速率减小,故D 正确.故选D.3.如图是可逆反应A+2B 2C+3D 的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此可推断()☆☆☆A.正反应是吸热反应B.若A、B 是气体,则D 是液体或固体C.逆反应是放热反应D.A、B、C、D 均为气体由图象可以看出降低温度,正反应速率大于逆反应速率,说明平衡向正反应移动,则该反应的正反应为放热反应,逆反应吸热,则A、C错误;增大压强,正反应速率大于逆反应速率,说明平衡向正反应方向移动,则说明气体反应物的化学计量数之和大于气体生成物的化学计量数之和,若A、B、C、D 均为气体,增大压强平衡向逆反应方向移动,若A、B是气体,则D是液体或固体,增大压强平衡向正反应方向移动,则B正确、D错误,故选B.4.在一定温度下,某可逆反应aA(s)+bB(g)cC(g)在一密闭的容器中时,改变某一外界条件,化学反应速率(v)﹣时间(t)图达到平衡,如果t象如图所示.下列说法正确的是()☆☆☆☆时可能是增大反应体系的压强A.若a+b=c,则t时不可能是加入催化剂B.若a+b=c,则t时只可能是加入催化剂C.若a+b≠c,则t时有可能是增大反应体系的压强D.若a+b≠c,则t【解答】根据图象可知,条件改变后,正逆反应速率同时增大,且增大的程度相同,即平衡不移动,这说明改变的条件是催化剂或压强.但如果是改变压强,则说明反应前后气体的体积是不变的,即b=c.时可能是增大反应体系的压强,故A错误;A、b=c时,tB、a、b、c是任何系数,都有可能是加入催化剂,故B错误;C、由于a、b、c是任何系数,都有可能是加入催化剂,故C错误;时有可能是增大反应体系的压强,故D正确.D、若a+b≠c,但是满足b=c,则t故选D.5.对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率的关系是()☆☆☆☆A.B.C.D.【解答】对于某一可逆反应,在不同条件下的平衡状态中,正、逆反应速率一定相等,即v(正)=v(逆),A.该图象中正逆反应速率始终相等,表示的是在不同条件下的平衡状态,故A 正确;B.该图象中,只有某一时刻才能满足v(正)=v(逆),不能表示在不同条件下的平衡状态,故B错误;C.该图象中,逆反应速率增大,正反应速率不变,不满足v(正)=v(逆),不能表示在不同条件下的平衡状态,故C错误;D.根据图象中曲线变化可知,正逆反应速率不满足始终相等,说明表示在不同条件下的平衡状态,故D错误。

化学平衡和速率图像1.速率-时间(v-t )图像方法:A. 首先分清图像的“突变”和“渐变”,出现渐变的为改变浓度。
如下图甲乙甲图中v 正突然变大、v 逆在t1渐变,可见改变的为增加反应物的浓度。
乙图中v 正突然变小、v 逆在t1渐变,可见改变的为减少反应物的浓度。
B.如果图像都为突变,则改变的可能是温度、压强、催化剂等,以及同时改变反应物和生成物的浓度。
这类图像要先看速率,再看平衡。
首先分析速率较之前的大小变化,如果变大,为增大温度、增大压强、加催化剂,再分析此时v 正、v 逆的相对大小,如果v 正>v 逆,表示平衡正向移动,再从上述条件里选择使平衡正向移动的条件。
例1,N 2+ 3H 22NH 3,△H<0建立平衡后加热对速率的影响如图1。
123图1υ图2如图1所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为升温。
如图2所示,t 2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v 逆,平衡正向移动,上述可以使此反应正向移动的为升压。
如图3所示,t2时刻后,图像突变,速率较之前都变小,为降温降压,又因为v 逆>v 正,平衡逆向移动,上述可以使此反应逆向移动的为降温。
图3练习1.下列图像为反应H 2(g)+I 2(g)2HI(g);△H>0 的速率-时间图像,分析下列三个图像改变的条件图1中,t2时刻后,图像突变,速率较之前都变大,为升温、升压、加催化剂,又因为v 正>v逆,平衡正向移动,上述可以使此反应正向移动的为升温。
图2中,t1时刻后,图像渐变,v逆突然变小,V正渐渐变小,为减少生成物即HI的浓度。
图3中,t0时刻后,图像突变,速率都变大,为升温、升压、加催化剂,又因为v正=v逆,平衡不移动,根据此反应,为升压或者加催化剂。
练习2一密封体系中发生下列反应:N+3H2 2NH3 +Q,下图是某一时间段中反应速率2与反应进程的曲线关系图:回答下列问题:(1)处于平衡状态的时间段是______.(2)t1、t3、t4时刻体系中分别是什么条件发生了变化?、、(3)下列各时间段时,氨的百分含量最高的是______.A.t0~t1B.t2~t3C.t3~t4D.t5~t6【答案】(1)t0~t1、t2~t4、t5~t6(2)升高温度,加了催化剂,降低压强(3)t0~t1练习3一定温度下可逆反应aX(g)+bY(g)cZ(g)在一密闭容器内达到平衡后,t0时刻改变某一外界条件,化学反应速率()随时间(t)变化如图所示。

化学平衡移动图像1、(2007年高考江苏卷)一定温度下可逆反应:A (s)+2B(g)2C (g)+D(g );∆H <0。
现将1 mol A 和2 mol B 加入甲容器中,将4 mol C 和2 mol D 加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t 1时两容器内均达到平衡状态(如图1所示,隔板K 不能移动)。
下列说法正确的是0时间t 速率v v (正)v (逆)v (逆)′v (正)′t 1t 2甲容器==0时间t 速率v v (正)v (逆)′′v (正)v (逆)=v(逆)′v (正)′=t 1t 2乙容器′′′′图1 图2 图3(A )保持温度和活塞位置不变,在甲中再加入1 mol A 和2 mol B ,达到新的平衡后,甲中C 的浓度是乙中C 的浓度的2倍(B)保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B 的体积分数均增大(C)保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C 的体积分数是甲中C 的体积分数的2倍(D )保持温度和乙中的压强不变,t 2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t 1前的反应速率变化已省略)2、在温度一定时,压强分别为P 1,P 2的条件下,A(g)+2B (g) nC(g )的反应体系中,C 的分数与时间t ,压强P 1,P 2的关系如图所示,则下列结论正确的是A 、P 1>P 2,n <3B 、P 1<P 2,n=3C 、P 1<P 2,n >3D 、P 1>P 2,n >33、可逆反应mA (s )+nB(g ) eC(g )+fD (g ),反应过程中,当其他条件不变时,C 的体积分数w(C )在不同温度(T )和不同压强(P )的条件下随时间(t )的变化关系见下图,下列叙述正确的是 A 、达平衡后,若使用催化剂,C 的体积分数将增大B 、达平衡后,若温度升高,化学平衡向逆反应方向移动C 、化学方程式中:n >e+fD 、达平衡后,增加A 的质量有利于化学平衡向正反应方向移动4、在可逆反应A 2(g)+2B 2(g )====2AB 2(g)(正反应为放热反应)趋向平衡时,图中符合勒夏特列原理的是5、对于反应mA(g )+nB(g) pC(g)+gD (g );△H=Q,改变反应条件时,A 的转化率变化情况如图所示,符合题意的是A 、m+n=p+g ;H ∆<0B 、m+n <p+g ;H ∆<0C 、m+n <p+g ;H ∆>0D 、m+n >p+g ;H ∆>0甲乙 P 活塞 K 1 2 3 46、根据下图中的两个图象,选出符合题意的反应方程式∆>0A、X+2Y Z;H∆<0B、X+2Y Z;H∆<0C、5X+3Y 4Z;H∆<0D、X+2Y 3Z;H7、如图(Ⅰ)表示反应:mA(g)+nB(g)pC(g)+qD(g);△H.在不同温度下经过一定时间混合气体体系中C的百分含量与温度T的关系。
化学平衡图像题_(含答案)(word版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(化学平衡图像题_(含答案)(word 版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为化学平衡图像题_(含答案)(word版可编辑修改)的全部内容。
化学反应速率化学平衡之图像题一、选择题1.(2012·武汉模拟)如图为某化学反应的速率与时间的关系示意图。
在t1时刻升高温度或者增大压强。
速率的变化都符合的示意图的反应是()A.4NH3(g)+5O2(g)4NO(g)+6H2O(g) ΔH<0B.2SO2(g)+O2(g)2SO3(g)ΔH〈0C.H2(g)+I2(g )2HI(g)ΔH〉0D.C(s)+H2O(g )CO(g)+H2(g) ΔH>02。
可逆反应m A(g)n B(g)+p C(s) ΔH=Q,温度和压强的变化对正、逆反应速率的影响分别符合下图中的两个图象,以下叙述正确的是( )A.m〉n,Q>0 B.m〉n+p,Q〉0 C.m〉n,Q<0 D.m〈n+p,Q〈03。
在密闭容器中进行如下反应:H2(g)+I2(g)2HI(g),在温度T1和T2时,产物的量与反应时间的关系如下图所示,符合图示的正确判断是( )A.T1>T2,ΔH>0 B.T1>T2,ΔH〈0 C.T1〈T2,ΔH>0 D.T1<T2,ΔH 〈0第1题图第2题图第3题图第4题图XY4.(2011·陕西四校联考)在一密闭容器中有如下反应:L(s )+a G(g ) b R (g ),温度和压强对该反应的影响如图所示,其中压强p 1〈p 2,由此可判断 ( )A .正反应为放热反应B .化学方程式中的计量数a 〉bC .G 的转化率随温度升高而减小D .增大压强,容器内气体质量不变 5.下图是表示外界条件(温度和压强)变化对反应的影响,L(s )+G (g )2R(g ),△H >0,在图中y 轴是指 ( )A.平衡混合物中R 的质量分数 B 。
专题27 化学平衡图像专练1.已知反应:CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)。
在肯定压强下,按向密闭容器中充入氯气与丙烯。
图甲表示平衡时,丙烯的体积分数(ϕ)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。
则下列说法正确的是A.图甲中11ω>B.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变C.温度T1、2ω=, Cl2的转化率约为33.3%D.图乙中,线A表示正反应的平衡常数【答案】C【解析】A.ω增大,CH2=CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1,故A错误;B.该反应在反应前后气体分子数不变,依据图甲上升温度丙烯的体积分数增大,即上升温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度上升,依据PV=nRT,达到平衡时,装置内的气体压强将增大,故B错误;C.由图乙可知,T1时平衡常数为1,设起始时CH2=CHCH3和Cl2的物质的量分别为amol和2amol,达到平衡时转化的Cl2的物质的量为xmol,依据三段式进行计算:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)起始(mol) a 2a 0 0转化(mol) x x x x平衡(mol) a-x 2a-x x x则(xV)2÷(a xV-×2a xV-)=1,解得x=2/3a,则Cl2的转化率2/3a÷2a×100%=33.3%,故C正确;D.由图甲可知,ω肯定时,温度上升,φ增大,说明正反应是放热反应,故温度上升,正反应平衡常数减小,故图乙中,线A表示逆反应的平衡常数,故D错误。
2.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A.B.C.D.【答案】A【解析】A.该反应为放热反应,温度上升平衡向逆反应方向移动,C的质量分数减小,故A正确;B.依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C.催化剂同等程度地变更正逆反应速率,平衡不发生移动,故C错误;D.该反应为放热反应,温度上升平衡向逆反应方向移动,A的转化率降低,依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误。
高考专题训练—化学平衡图像类型及解读1、反应2X(g)+Y(g)2Z(g)+Q,在不同温度(T1和T2)及压强(p1和p2)下,产物Z的物质的量n与反应时间t的关系如图所示。
下列判断正确的是()A.T1<T2,p1<p2B.T1<T2,p1>p2C.T1>T2,p1>p2D.T1>T2,p1<p2【答案】:C【解析】:温度越高,速率越快,反应就先达到平衡,因此p2相同时,T1>T2;压强越大,速度越快,反应先达到平衡,因此T2相同时,p1>p2。
2、在容积一定的密闭容器中发生可逆反应:A(g)+2B(g)2C(g)ΔH >0,条件变化时,影响平衡移动的关系如图所示。
下列说法不正确的是()A.p1<p2,纵坐标指A的质量分数B.p1>p2,纵坐标指C的质量分数C.p1>p2,纵坐标指混合气体的平均摩尔质量D.p1>p2,纵坐标指A的转化率【答案】:A【解析】:结合图象可确定,若p1<p2,增大压强平衡正向移动,A的质量分数将减小,气体的物质的量减小,即混合气体的平均摩尔质量增大,C项正确;但升高温度,平衡正向移动,A的质量分数减小与图象不符,故A错误;若p1>p2,增大压强平衡正向移动,混合气体中C的质量分数增加,A的转化率将增大,故B、D项正确。
故选A。
3、(2019·许昌高二检测)已知:2SO2(g)+O2(g)2SO3(g)ΔH<0且压强p1<p2,下列图象中曲线变化错误的是()【答案】:C【解析】:该反应为放热反应,升高温度,反应速率增大,平衡向逆反应方向移动,SO2的平衡转化率降低,A项正确;温度不变时,增大压强,平衡正向移动,SO3的百分含量增大,B项正确;升高温度,平衡逆向移动,平衡常数减小,C项错误;升高温度,正、逆反应速率均增大,由于平衡逆向移动,故升温瞬间v(逆)>v(正),D项正确。