氨基酸
- 格式:doc
- 大小:144.50 KB
- 文档页数:16

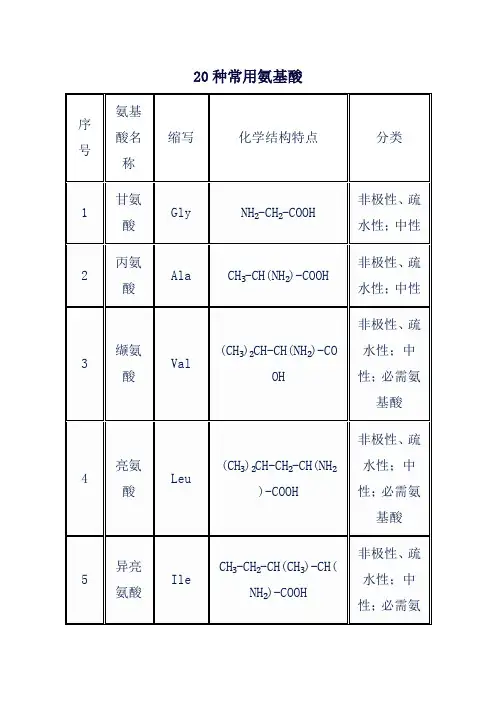
氨基酸的化学符号可以用化学式来表示,其通式为R-CH(NH?)COOH,其中R表示氨基酸的侧链基团,可以是任何有机基团。
氨基酸的种类很多,不同氨基酸的R基不同。
常见的氨基酸及其化学符号如下:天冬氨酸(Asp):化学式为H2N-CO2H,可用简式C4H5NO2表示。
谷氨酸(Glu):化学式为H2N-CO-CH2-CH(NH3+)CO2H,可用简式C5H8NO3表示。
丙氨酸(Ala):化学式为H3C-CH(NH2)-COOH,可用简式C3H7NO2表示。
甘氨酸(Gly):化学式为H2N-CH2CO2H,可用简式C2H3NO2表示。
缬氨酸(Val):化学式为H3C-CH(NH-COCH3),可用简式C4H7NO2表示。
亮氨酸(Leu):化学式为H3C-CH(CH3)-CH(NH2)-CO2H,可用简式C6H13NO2表示。
异亮氨酸(Ile):化学式为(H3C)?-(CH(CH3)2)CH(NH2)-CO2H,可用简式C9H19NO2表示。
脯氨酸(Pro):化学式为H3C-CH(SH)-COOH,可用简式C5H7NO2表示。
丝氨酸(Ser):化学式为H2N-CH(CH3)-COOH,可用简式C3H7NO3表示。
半胱氨酸(Cys):化学式为H4N-S-CH(NH2)-COOH,可用两个单巯基取代两个氨基酸分子中的氨基甲酰基和羧基,或一个二硫键取代一个氨基酸分子中的氨基甲酰基和羧基,或一个二硫键取代一个氨基酸分子中的两个氨基甲酰甲基上的氢而形成的化合物。
酪氨酸(Tyr):化学式为H3C-(CH(CH3)2)-OH-COOH,可用简式C9H10O4表示。
赖氨酸(Lys):化学式为H2N-CH(NH4)-COOH,可用简式C6H14N2O2表示。
苏氨酸(Thr):化学式为H3C-(CHOH)-COOH,可用简式C4H7O3N表示。
色氨酸(Trp):化学式比较复杂,其基本骨架是吲哚的甲烷衍生物和甘氨酸、缬氨酸的混合物。

18种氨基酸的作用氨基酸是构成蛋白质的基本单位,被广泛应用于细胞生物学、营养学、医学等领域。
人体内共有20种氨基酸,其中有9种被视为人体必需氨基酸,而另外11种被称为非必需氨基酸,因为人体可以通过其他氨基酸的合成来满足需求。
以下是18种氨基酸及它们的作用:1. 色氨酸 (Tryptophan):是必需氨基酸之一,用于合成血清素和褪黑激素,被认为对调节情绪、睡眠和免疫系统功能发挥重要作用。
2. 苯丙氨酸 (Phenylalanine):必需氨基酸之一,参与合成多巴胺、去甲肾上腺素和肾上腺素,对神经传导和心理健康起关键作用。
3. 组氨酸 (Histidine):必需氨基酸之一,用于合成组胺和肽类激素,对心血管健康、神经发育和免疫功能至关重要。
4. 赖氨酸 (Lysine):必需氨基酸之一,参与合成胶原蛋白、骨骼和肌肉组织,对维持骨骼健康、肌肉生长和免疫功能发挥重要作用。
5. 硫氨酸 (Methionine):必需氨基酸之一,用于合成蛋白质和多种重要物质,如肌肉、酶和激素。
6. 缬氨酸 (Valine):必需氨基酸之一,参与合成肌肉组织,对维持肌肉力量和增强免疫系统功能至关重要。
7. 亮氨酸 (Leucine):必需氨基酸之一,参与合成蛋白质和肌肉组织,对维持肌肉力量、促进体内蛋白质合成起关键作用。
8. 异亮氨酸 (Isoleucine):必需氨基酸之一,参与合成肌肉和蛋白质,对维持肌肉健康、调节血糖和能量代谢十分重要。
9. 缬氨酸 (Norvaline):属于非必需氨基酸,参与合成肌肉组织和蛋白质,同时被认为对促进生长激素的分泌和肌肉生长起重要作用。
10. 苏氨酸 (Threonine):必需氨基酸之一,参与合成胶原蛋白、抗体和骨骼组织,也对中枢神经系统的功能具有重要影响。
11. 缬氨酸 (Thyrosine):属于非必需氨基酸,参与合成甲状腺激素和多巴胺,对调节代谢、心理健康和免疫功能发挥作用。
12. 丝氨酸 (Serine):属于非必需氨基酸,参与合成抗体、免疫球蛋白和酶,对维持稳定的氨基酸代谢和肌肉结构发挥重要作用。

十八种氨基酸简介氨基酸是构成蛋白质的基本组成单位,共有20种常见的氨基酸,其中有9种被称为必需氨基酸,人体无法自行合成,必须通过摄入食物来获得。
而剩下的11种被称为非必需氨基酸,人体可以自行合成。
本文将介绍其中的十八种氨基酸。
必需氨基酸1.赖氨酸(Lysine)•赖氨酸是一种必需氨基酸,它对维持正常的生长和组织修复很重要。
主要存在于蛋白质食物中,如肉、鱼、奶制品等。
2.苏氨酸(Threonine)•苏氨酸是身体合成蛋白质时必需的氨基酸之一。
它对于肌肉的清除有重要作用,主要存在于奶制品、鱼、肉类等食物中。
3.缬氨酸(Leucine)•缬氨酸是构成肌肉蛋白质的重要成分,它能促进肌肉生长和修复。
主要存在于坚果、奶制品和肉类等食物中。
4.异亮氨酸(Isoleucine)•异亮氨酸也是构成肌肉蛋白质的重要组成成分。
它对维持氮平衡和肌肉代谢有重要作用,主要存在于肉类、鱼、大豆等食物中。
5.赖氨酸(Lysine)•赖氨酸在维持氮平衡和生长发育方面起着重要的作用。
富含赖氨酸的食物包括红肉、鱼类和奶制品等。
6.苯丙氨酸(Phenylalanine)•苯丙氨酸是合成蛋白质时必需的氨基酸之一。
它可以通过鱼类、肉类和奶制品等食物摄入。
7.色氨酸(Tryptophan)–色氨酸在蛋白质合成和组织修复中起着重要作用。
富含色氨酸的食物包括家禽、贝类和豆类等。
8.苯丙氨酸(Methionine)•苯丙氨酸是一种必需氨基酸,不仅对蛋白质合成至关重要,还参与一些重要酶的合成。
可以通过食用肉类、家禽、鱼类等蛋白质来补充。
9.组氨酸(Histidine)–组氨酸是必需氨基酸之一,对于维持正常的生长和维持组织修复至关重要。
富含组氨酸的食物包括肉类、鱼类和奶制品等。
非必需氨基酸1.丙氨酸(Alanine)•丙氨酸是非必需氨基酸之一,它是能量代谢的关键成分,同时也参与蛋白质的合成与分解。
存在于肉类、家禽等食物中。
2.天冬酰基半胱氨酸(Asparagine)•天冬酰基半胱氨酸是身体合成蛋白质、尿素等化合物的重要原料之一。

氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物。
国内的氨基酸生产厂家,由于生产工艺相对比较落后,排放的废水中含有大量的氨基酸,这些废水虽然毒性不大,但水的BOD、COD值较高,直接排放,既污染环境,也造成资源浪费。
你看看你那厂的废水指标,能不能给他做下回收重利用酸溶法生产氨基酸工艺为:酸溶-过滤-脱色-浓缩-结晶-洗涤-干燥-包装-产品在过滤洗涤工段产生高浓度废水,其他工段产生的是低浓度废水。
高浓度废水中氨基酸含量约50g/l COD 10000mg/l 所以一般建议兄弟你将高浓度废水进行预处理,将高浓度的氨基酸回收再进行处理,这样会减轻你后续废水处理的负担高浓度废水回收工艺如下:高浓度废液-真空浓缩-冷却结晶-过滤分离-干燥包装-粗产品真空浓缩中所用蒸汽为氨基酸生产过程中的低压蒸汽。
通过对全厂热力平衡进行调整,原有锅炉不必改动。
利用水喷射真空泵可避免蒸汽中气味对环境造成的影响。
浓缩的真空度为0.04 MPa ,温度为85~105 ℃。
浓缩液经冷却结晶,通过过滤得到氨基酸晶体,可作为饲料添加剂。
经过滤的母液部分循环,其余则排出与生产过程其他工段废水混合,进入处理设施。
废水混合后,降低了废水的浓度,这时CODCr值为500~600 mg/ L ,BOD5 值为200~250 mg/ L ,废水中主要含有无机氮、氨基酸等物质,可生化性较强,我们采用了生物氧化与物化处理结合的处理工艺:混合废水除去浮渣,利用氨基酸工艺过程中的废碱液调整pH值后进入调节池,调节水量和水质,以利于生化处理。
然后废水泵入塔式生物滤池进行生物吸附及氧化处理。
滤塔的BOD 负荷为2000~2 300 BOD5 g/ (m3·d) ,塔径与塔高比为1∶10 ,出水回流比为30 %。
滤塔的接种污泥取自市污水处理厂沉淀池污泥和氨基酸厂的排水沟污泥,经过一个月培养驯化,生物膜中形成了包括细菌、真菌、藻类、原生动物、后生动物等微生物类群。


氨基酸的结构与性质氨基酸是生命中的基本分子之一,它是构成生物体内蛋白质的组成单元,同时还在许多代谢反应中发挥重要作用。
氨基酸的结构与性质涉及到它的化学组成、空间结构以及在生物体内的功能。
以下将详细介绍氨基酸的结构与性质。
一、氨基酸的化学结构:氨基酸由中心碳原子(α-C)和与之相连的四个基团组成:氨基(-NH2)、羧基(-COOH)、一个氢原子(-H)和一个侧链基团(R)。
1.氨基:-NH2,和一个氢原子连接,是氨基酸的一个常见特点。
2.羧基:-COOH,和一个氢原子连接,为氨基酸的另一个特点。
3.氢原子:-H,连接在中心碳原子上,可以与侧链基团相互作用。
4.侧链基团:R是氨基酸的特异性标志,不同的R导致了不同的氨基酸种类。
二、氨基酸的分类:氨基酸可以根据其侧链基团的性质被分为极性、非极性、酸性和碱性氨基酸。
1.极性氨基酸:侧链中含有氢键供体或受体,可以与其他极性物质相互作用。
酪氨酸、赖氨酸、组氨酸等就是极性氨基酸的代表。
2.非极性氨基酸:侧链中没有明显的极性基团,通常是脂溶性的。
丙氨酸、丝氨酸、亮氨酸等都属于非极性氨基酸。
3.酸性氨基酸:侧链中含有羧基,可以失去质子。
谷氨酸、门冬氨酸是常见的酸性氨基酸。
4.碱性氨基酸:侧链中含有氨基,在适当的条件下可以接受质子。
赖氨酸、精氨酸等属于碱性氨基酸。
三、氨基酸的空间结构:氨基酸通常以L型存在,这是由于侧链基团的位置而决定的。
在L型氨基酸中,羧基位于左侧,而氨基位于右侧。
D型氨基酸存在于一些细菌细胞壁中,而在自然界中D型氨基酸几乎不见。
氨基酸的侧链基团的位置和性质决定了氨基酸的生物功能和化学反应。
侧链基团的大小、电荷、极性、亲水性等属性对蛋白质的结构和功能起着重要的影响。
四、氨基酸的性质:1.酸碱性:氨基酸可以通过羧基中的羟基(-OH),羟基的质子(H+),以及氨基中的氨基质子(NH3+)与其他分子发生酸碱反应。
2.缔合特性:在生物体内,通过形成酯、肽和烷基缔合等化学反应,氨基酸可以与其他分子形成化学连接。

22种必需氨基酸一、引言氨基酸是构成蛋白质的基本单位,是生物体进行生命活动不可或缺的化合物。
在众多的氨基酸中,有22种氨基酸被认定为人类和动物体的必需氨基酸,这意味着它们不能由生物体自行合成,必须从食物中获取。
这22种必需氨基酸对于维持生命、生长和发育起着至关重要的作用。
本文将详细探讨这22种必需氨基酸的种类、作用以及来源与摄入建议。
二、必需氨基酸的种类与作用1.亮氨酸:亮氨酸是人体骨骼肌肉和心肌组织的重要能源,也是调节睡眠、食欲和情绪的重要物质。
2.异亮氨酸:异亮氨酸参与细胞生长和修复,对维持免疫系统功能和防止肌肉损失具有重要作用。
3.缬氨酸:缬氨酸是维持心脏、肝脏和其他器官正常功能的必需氨基酸,也是能量代谢的关键物质。
4.赖氨酸:赖氨酸是合成抗体、酶和其他重要生物分子的关键物质,对于生长发育和维持免疫系统功能至关重要。
5.甲硫氨酸(蛋氨酸):甲硫氨酸是参与蛋白质合成、脂肪代谢和DNA合成的重要物质,对细胞生长和修复至关重要。
6.色氨酸:色氨酸是人体合成神经递质血清素和褪黑激素的原料,对于维持神经系统和免疫系统的正常功能具有重要作用。
7.苯丙氨酸:苯丙氨酸是合成甲状腺素和肾上腺素等激素的原料,对于维持体温、睡眠和情绪等生理功能具有重要作用。
8.苏氨酸:苏氨酸对维持免疫系统、消化系统和神经系统功能有重要作用,也是细胞生长和修复的重要物质。
9.蛋氨酸:蛋氨酸与甲硫氨酸是同一物质,也是人体重要的氨基酸之一,参与蛋白质合成和代谢。
10.半胱氨酸:半胱氨酸参与合成谷胱甘肽等抗氧化物质,对于维持细胞健康和免疫系统功能具有重要作用。
11.甘氨酸:甘氨酸是体内氨解毒和转化为尿素的关键物质,对维护肝功能具有重要作用。
12.组氨酸:组氨酸是合成组胺等生物活性物质的原料,对于维持血压和神经传导具有重要作用。
13.丝氨酸:丝氨酸参与合成磷脂、肌酸等物质,对于维持细胞膜健康和能量代谢具有重要作用。
14.天冬氨酸:天冬氨酸是能量代谢和合成蛋白质的重要物质,对心脏和神经系统功能有重要作用。

34种人体所需的氨基酸人体所需的氨基酸是非常重要的营养素,它们对于维持健康的生命活动和生长发育都非常重要。
根据研究,人体所需的氨基酸共有34种,以下将逐一介绍这些氨基酸的作用、来源、及不足时所产生的问题。
1. 色氨酸(Tryptophan):原始蛋白质来源,被身体转化为血清蛋白、合成维生素B3和血红素。
缺乏色氨酸会导致情绪低落和缺乏维生素B3的症状。
2. 赖氨酸(Lysine):原始蛋白质来源,帮助制造肌肉和骨骼组织、减轻口腔疮症状,并能降低血压。
缺乏赖氨酸会导致生长迟缓和疲劳。
3. 缬氨酸(Valine):原始蛋白质来源,可产生能量,并有助肌肉生长和修复。
缺乏缬氨酸会导致肌肉无力和疲劳。
4. 苯丙氨酸(Phenylalanine):原始蛋白质来源,帮助制造多巴胺、去甲肾上腺素和肾上腺素等荷尔蒙。
缺乏苯丙氨酸会影响神经系统,引发情感疾病。
5. 色胺酸(Tyrosine):身体可以将赖氨酸转化成色胺酸。
它对神经系统和肾上腺素素系统的功能有重要影响。
它能提高注意力和认知能力、减轻压力,还有降低胆固醇水平的作用。
缺乏色胺酸会导致记忆力下降和精神不稳定等问题。
6. 色胺酸(Histidine):原始蛋白质来源,帮助构建血液,修复组织损伤和促进生长。
缺乏组胺会干扰呼吸系统的功能,导致皮肤瘙痒和生长迟缓。
7. 缬胺酸(Isoleucine):原始蛋白质来源,维持肌肉和骨骼组织的健康。
缺乏缬氨酸会导致肌酸激酶降低,影响能量代谢。
8. 甲硫氨酸(Methionine):原始蛋白质来源,帮助构建健康的肌肉和骨骼组织,支持肝脏和循环系统的健康。
缺乏甲硫氨酸会影响生长和肝脏的正常功能。
9. 酪氨酸(Cysteine):原始蛋白质来源,促进毛发健康和白细胞制造。
此外,它还有抗氧化和解毒作用,支持肝脏健康和免疫系统。
缺乏酪氨酸会影响免疫系统和脂肪代谢。
10. 酪氨酸(Cystine):由两个酪氨酸形成的,具有相同的作用。

氨基酸一.氨基酸的概念:羧酸分子里烃基上的氢原子被氨基取代后的生成物。
注意:⑴.氨基:氨气分子(NH 3)去掉一个氢原子后剩余的部分(—NH 2),它仍具有NH 3的性质——碱性。
氨基的电子式__________________。
⑵.α—氨基酸:羧酸分子里的α氢原子被氨基取代的生成物。
α—氨基酸是构成蛋白质的基石,天然氨基酸都是α—氨基酸。
二.几种常见的氨基酸:1.常温下,氨基酸都是晶体,可溶于水。
2.具有两性:氨基酸中同时含有氨基和羧基,所以它具有酸性又有碱性。
与酸反应:R —CH —COOH +HCl → R —CH —COOH2 3Cl与碱反应:R —CH —COOH +NaOH → R —CH —COONa +H 2ONH 2 2【思考】在所学过的物质中有哪些物质既能跟酸反应又能跟碱反应?3.缩合反应:两个α—氨基酸经缩合反应,生成的产物叫二肽,多个α—氨基酸缩合生成的产物叫多肽。
α—氨基酸的混合物。
【知识巩固】1.下列关于氨基酸的叙述不正确的是( ) A .分子中同时含有氨基和羧基的化合物叫氨基酸 B .羧酸分子里的α—氢原子被氨基取代后生成α—氨基酸 C .蛋白质水解的最后产物是氨基酸 D .HO 2属于氨基酸2C —N 键的是( ) A .浓H 2SO 4、浓HNO 3混合液和苯作用,生成硝基苯 B .蛋白质水解生成α—氨基酸 C .由棉花制得纤维素硝酸酯 D .氨基乙酸和NaOH 溶液反应 3.下列叙述正确的是( ) A .能发生酯化反应的酸一定是羧酸 B .天然蛋白质水解的最后产物是α—氨基酸 C .植物油不能使溴的四氯化碳溶液褪色D .米饭在嘴中越咀嚼越甜的原因是淀粉水解生成甜味物质4.当含有下列结构片断的蛋白质在胃中水解时,不可能产生的氨基酸是( )5.下列物质中,既与盐酸反应,又可与KOH 溶液反应的是( )5.化学式为C 4H 9NO 2的化合物的同分异构体中,属于氨基酸的有( ) A .3种 B .4种 C .5种 D .6种6.分子式与苯丙氨酸()相同,且同时符合下列两个条件:①有带有两个取代基的苯环 ②有一个硝基直接连在苯环上的异构体的数目是( ) A .3 B .5 C .6 D .107.已知某氨基酸的相对分子质量小于200,且氧的质量分数约为0.5,则其分子中碳的个数最多为( )A .5个B .6个C .7个D .8个 8.A 、B 两种有机化合物,分子式都是C 9H 11O 2N 。
L-蛋氨酸价格比dl型的高很多,而两者生理活性相同。
L-组氨酸在水中溶解度远比盐酸盐低。
L-赖氨酸稳定性很差,一般用其盐类。
1、L-丙氨酸:白色结晶性粉末,有特殊甜味,甜度约为蔗糖的70%。
化学性能稳定,易溶于水,微溶于乙醇。
5%水溶液PH=5.5-7.0。
2、L-精氨酸:白色结晶性粉末,经水重结晶后,于105℃失去结晶水,水溶液呈强碱性,可从空气中吸收二氧化碳。
溶于水,微溶于乙醇。
成人为非必须氨基酸,但体内生成速度慢,婴幼儿为必须氨基酸,有一定解毒作用。
3、L-精氨酸盐酸盐:白色或近白色几乎无臭结晶性粉末。
干燥状态下稳定。
3%水溶液pH=5.7。
易溶于水,微溶于热乙醇。
4 、L-天冬氨酸:白色结晶性粉末,无臭。
稍有酸味,难溶于水,易溶于热水,不溶于乙醇,属非必须氨基酸。
5、L-天冬酰胺:白色结晶性粉末,稍有甜味。
遇碱水解成天冬氨酸。
溶于水,几乎不溶于乙醇,水溶液呈酸性。
为非必须氨基酸。
6、L-胱氨酸:白色针状,几乎无臭,在热碱水溶液中易分解,极难溶于水和乙醇。
为非必须氨基酸,对构成皮肤和毛发是必须物质,可促进手术及外伤的治疗,刺激造血功能,促进白血球生成。
7、L-谷氨酰胺:白色结晶性粉末,稍有甜味,结晶状态稳定,遇酸碱热水不稳定,可水解成L-谷氨酸。
溶于水呈酸性,几乎不溶于乙醇,属非必须氨基酸。
8、甘氨酸(氨基乙酸) :结晶性粉末,有特殊甜味,水溶液呈微酸性。
易溶于水,极难溶于乙醇。
9、L-组氨酸:稍有苦味,易与金属离子形成络盐。
溶于水,极难溶于乙醇。
因溶解度极小,常用其盐酸盐。
10、L-组氨酸盐酸盐:稍有酸、苦味,性质稳定。
易溶于水,在水中溶解度远比L-组氨酸大,不溶于乙醇。
属于必需氨基酸,在体内合成较慢,D-型与L-型生理效果相同。
11、DL-异亮氨酸:稍有苦味,10%溶液的pH=5.5-7.0,溶于水,几乎不溶于乙醇。
12 、L-异亮氨酸:略苦,无臭,10%溶液的pH=5.5-7.0,溶于水,化学性能稳定,加工受热时几乎无损失,微溶于热乙醇。
编辑词条氨基酸百科名片氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物。
氨基连在α-碳上的为α-氨基酸。
天然氨基酸均为α-氨基酸。
目录[隐藏]氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊amino acid (abbr.aa)[编辑本段]氨基酸的结构通式α-氨基酸的结构通式:(R是可变基团)构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
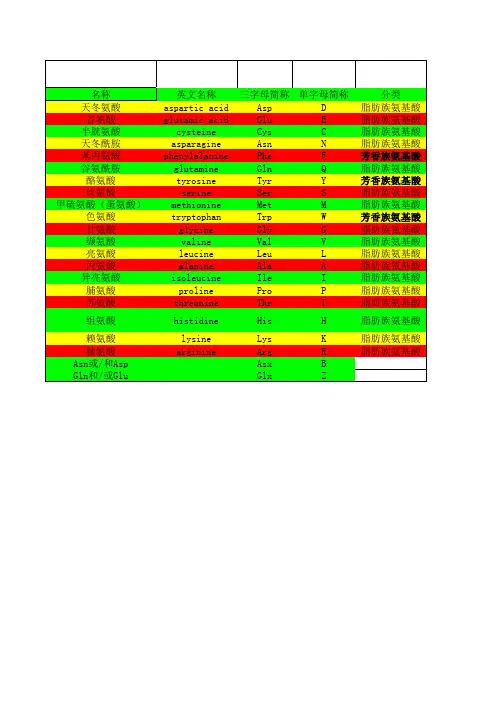
[编辑本段]氨基酸的分类天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有10种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophan):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Valine):作用于黄体、乳腺及卵巢。
人体21种氨基酸人体共有20种氨基酸,它们是构成蛋白质的基本组成单位。
这20种氨基酸可以根据其在人体内是否能够被合成而被分为必需氨基酸和非必需氨基酸两类。
必需氨基酸指的是人体无法自身合成,必须从外部获得的氨基酸;非必需氨基酸则是人体能够自身合成的氨基酸。
必需氨基酸包括:亮氨酸、异亮氨酸、赖氨酸、色氨酸、缬氨酸、苯丙氨酸、苏氨酸、甲硫氨酸、蛋氨酸、腺氨酸、苏氨酸、亮上氨酸。
非必需氨基酸包括:天冬氨酸、丝氨酸、天冬氨酸、谷氨酸、缬氨酸、甘氨酸、苏氨酸、丙氨酸、茉莉氨酸、天门冬氨酸、酪氨酸、精氨酸、组氨酸、赖氨酸、β-氨丙氨酸。
以下是这些氨基酸的一些特点及其在人体内的作用:1.亮氨酸:亮氨酸是一种必需氨基酸,它参与合成肌肉组织,维持正常的肌肉功能。
2.异亮氨酸:异亮氨酸也是一种必需氨基酸,它参与合成肌肉组织,维持正常的肌肉功能。
3.赖氨酸:赖氨酸是一种必需氨基酸,它参与合成肌肉组织,维持正常的肌肉功能。
赖氨酸还参与体内脂肪代谢,有助于维持良好的体型。
4.色氨酸:色氨酸是一种必需氨基酸,它参与合成血清素,血清素是一种重要的神经递质,维持正常的神经功能,对调节情绪、食欲和睡眠有重要作用。
5.缬氨酸:缬氨酸是一种必需氨基酸,它参与合成肌肉组织,维持正常的肌肉功能。
6.苯丙氨酸:苯丙氨酸是一种必需氨基酸,它是合成多巴胺、肾上腺素和去甲肾上腺素的前体,对调节情绪、抑制疼痛有重要作用。
7.苏氨酸:苏氨酸是一种必需氨基酸,它参与合成肌肉组织,维持正常的肌肉功能。
8.甲硫氨酸:甲硫氨酸是一种必需氨基酸,它参与合成肌肉组织,维持正常的肌肉功能。
甲硫氨酸还是构成胱氨酸的原料。
9.蛋氨酸:蛋氨酸是一种必需氨基酸,它是合成胆固醇的原料,对维持正常的脂肪代谢有重要作用。
10.腺氨酸:腺氨酸是一种必需氨基酸,它是合成ATP的原料,ATP是细胞能量的主要来源。
11.苏氨酸:苏氨酸是一种必需氨基酸,它参与合成肌肉组织,维持正常的肌肉功能。
编辑词条氨基酸百科名片氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物。
氨基连在α-碳上的为α-氨基酸。
天然氨基酸均为α-氨基酸。
目录[隐藏]氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊氨基酸的结构通式氨基酸的分类氨基酸的检测氨基酸的功能氨基酸合成氨基酸所对应的密码子表氨基酸胶囊amino acid (abbr.aa)[编辑本段]氨基酸的结构通式α-氨基酸的结构通式:(R是可变基团)构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
[编辑本段]氨基酸的分类天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有10种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophan):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Valine):作用于黄体、乳腺及卵巢。
氨基酸氨基酸(amino acid):含有氨基和羧基的一类有机化合物的通称。
生物功能大分子蛋白质的基本组成单位,是构成动物营养所需蛋白质的基本物质。
是含有一个碱性氨基和一个酸性羧基的有机化合物。
氨基连在α-碳上的为α-氨基酸。
天然氨基酸均为α-氨基酸。
氨基酸的结构通式α-氨基酸的结构通式:(R是可变基团)构成蛋白质的氨基酸都是一类含有羧基并在与羧基相连的碳原子下连有氨基的有机化合物,目前自然界中尚未发现蛋白质中有氨基和羧基不连在同一个碳原子上的氨基酸。
氨基酸的分类天然的氨基酸现已经发现的有300多种,其中人体所需的氨基酸约有22种,分非必需氨基酸和必需氨基酸(人体无法自身合成)。
另有酸性、碱性、中性、杂环分类,是根据其化学性质分类的。
1、必需氨基酸(essential amino acid):指人体(或其它脊椎动物)不能合成或合成速度远不适应机体的需要,必需由食物蛋白供给,这些氨基酸称为必需氨基酸。
共有10种其作用分别是:①赖氨酸(Lysine ):促进大脑发育,是肝及胆的组成成分,能促进脂肪代谢,调节松果腺、乳腺、黄体及卵巢,防止细胞退化;②色氨酸(Tryptophan):促进胃液及胰液的产生;③苯丙氨酸(Phenylalanine):参与消除肾及膀胱功能的损耗;④蛋氨酸(又叫甲硫氨酸)(Methionine);参与组成血红蛋白、组织与血清,有促进脾脏、胰脏及淋巴的功能;⑤苏氨酸(Threonine):有转变某些氨基酸达到平衡的功能;⑥异亮氨酸(Isoleucine ):参与胸腺、脾脏及脑下腺的调节以及代谢;脑下腺属总司令部作用于甲状腺、性腺;⑦亮氨酸(Leucine ):作用平衡异亮氨酸;⑧缬氨酸(Valine):作用于黄体、乳腺及卵巢。
9.精氨酸(arginine):精氨酸与脱氧胆酸制成的复合制剂(明诺芬)是主治梅毒、病毒性黄疸等病的有效药物。
10.组氨酸histidine人体虽能够合成Arg和His,但合成的量通常不能满足正常的需要,因此,这两种氨基酸又被称为半必需氨基酸。
前8种人体必需氨基酸的记忆口诀①"赖蛋苏苯挟一亮色(联想记忆法-高中生物老师教的,意义深刻)"谐音: 借(缬氨酸), 一(异亮氨酸),两(亮氨酸),本(苯丙氨酸),蛋(蛋氨酸),色(色氨酸),书(苏氨酸),来(赖氨酸).②"笨蛋来宿舍,晾一晾鞋"笨(苯丙氨酸)蛋(蛋氨酸)来(赖氨酸)宿(苏氨酸)舍(色氨酸),晾(亮氨酸)一晾(异亮氨酸)鞋(缬氨酸)③"携带一两本甲硫色书来"携(缬氨酸)带一(异亮氨酸)两(亮氨酸)本(苯丙氨酸)甲硫(甲硫氨酸)色(色氨酸)书(苏氨酸)来(赖氨酸)④“一家写两三本书来”一(异亮氨酸)家(甲硫氨酸)携(缬氨酸)两(亮氨酸)三(色氨酸)本(苯丙氨酸)书(苏氨酸)来(赖氨酸)⑤“(路人)甲挟来一本两色书”甲(甲硫氨酸)挟(缬氨酸)来(赖氨酸)一(异亮氨酸)本(苯丙氨酸)两(亮氨酸)色(色氨酸)书(苏氨酸)20种氨基酸记忆口诀六伴穷光蛋,酸谷天出门,死猪肝色脸,只携一两钱。
一本落色书,拣来精读之。
芳香老本色,不抢甘肃来。
六伴穷光蛋:硫、半、光、蛋→半胱、光、蛋(甲硫)氨酸→含硫氨基酸酸谷天出门:酸、谷、天→谷氨酸、天门冬氨酸→酸性氨基酸死猪肝色脸:丝、组、甘、色→丝、组、甘、色氨酸→一碳单位来源的氨基酸只携一两钱:支、缬、异亮、亮→缬、异亮、亮氨酸→支链氨基酸一本落色书:异、苯、酪、色、苏→异亮、苯丙、酪、色、苏氨酸→生糖兼生酮拣来精读之:碱、赖、精、组→赖氨酸、精氨酸、组氨酸→碱性氨基酸芳香老本色:芳香、酪、苯、色→酪、苯丙、色氨酸→芳香族氨基酸不抢甘肃来:脯、羟、甘、苏、赖→脯、羟脯、甘、苏、赖氨酸→不参与转氨基的氨基酸其理化特性大致有:1)都是无色结晶。
熔点约在230°C以上,大多没有确切的熔点,熔融时分解并放出CO2;都能溶于强酸和强碱溶液中,除胱氨酸、酪氨酸、二碘甲状腺素外,均溶于水;除脯氨酸和羟脯氨酸外,均难溶于乙醇和乙醚。
2)有碱性[二元氨基一元羧酸,例如赖氨酸(lysine)];酸性[一元氨基二元羧酸,例如谷氨酸(Glutamic acid)];中性[一元氨基一元羧酸,例如丙氨酸(Alanine)]三种类型。
大多数氨基酸都呈显不同程度的酸性或碱性,呈显中性的较少。
所以既能与酸结合成盐,也能与碱结合成盐。
3)由于有不对称的碳原子,呈旋光性。
同时由于空间的排列位置不同,又有两种构型:D型和L型,组成蛋白质的氨基酸,都属L型。
由于以前氨基酸来源于蛋白质水解(现在大多为人工合成),而蛋白质水解所得的氨基酸均为α-氨基酸,所以在生化研究方面氨基酸通常指α-氨基酸。
至于β、γ、δ……ω等的氨基酸在生化研究中用途较小,大都用于有机合成、石油化工、医疗等方面。
氨基酸及其衍生物品种很多,大多性质稳定,要避光、干燥贮存。
2.非必需氨基酸(nonessentialamino acid):指人(或其它脊椎动物)自己能由简单的前体合成,不需要从食物中获得的氨基酸。
例如甘氨酸、丙氨酸等氨基酸。
氨基酸单字母简写和性质列表:缩写全名中文译名支链分子量等电点解离常数(羧基)解离常数(胺基)pKr(R) R基G Gly Glycine 甘氨酸亲水性75.07 6.06 2.35 9.78 -HA Ala Alanine 丙氨酸疏水性89.09 6.11 2.35 9.87 -CH3V Val Valine 缬氨酸疏水性117.15 6.00 2.39 9.74 -CH-(CH3)2L Leu Leucine 亮氨酸疏水性131.17 6.01 2.33 9.74 -CH2-CH(CH3)2I Ile Isoleucine 异亮氨酸疏水性131.17 6.05 2.32 9.76 -CH(CH3)-CH2-C H3F Phe Phenylalanine 苯丙氨酸疏水性165.19 5.49 2.20 9.31 -CH2-C6H5W Trp Tryptophan 色氨酸疏水性204.23 5.89 2.46 9.41 -C8NH6Y Tyr Tyrosine 酪氨酸疏水性181.19 5.64 2.20 9.21 10.46 -CH2-C6H4-OHD Asp Aspartic acid 天冬氨酸酸性133.10 2.85 1.99 9.90 3.90 -CH2-C OOHN Asn Asparagine 天冬酰胺亲水性132.12 5.41 2.14 8.72 -CH2-CONH2E Glu Glutamic acid 谷氨酸酸性147.13 3.15 2.10 9.47 4.07 -(CH2)2-C OOHK Lys Lysine 赖氨酸碱性146.19 9. 60 2.16 9.06 10.54 -(CH2)4-NH2 Q Gln Glutamine 谷氨酰胺亲水性146.15 5.65 2.17 9.13 -(CH2)2-CONH 2M Met Methionine 甲硫氨酸疏水性149.21 5.74 2.13 9.28 -(CH2)-S-CH3S Ser Serine 丝氨酸亲水性105.09 5.68 2.19 9.21 -CH2-OHT Thr Threonine 苏氨酸亲水性119.12 5.60 2.09 9.10 -CH(CH3)-OHC Cys Cysteine 半胱氨酸亲水性121.16 5.05 1.92 10.70 8.37 -CH2-SHP Pro Proline 脯氨酸疏水性115.13 6.30 1.95 10.64 -C3H6H His Histidine 组氨酸碱性155.16 7.60 1.80 9.33 6.04R Arg Arginine 精氨酸碱性174.20 10.76 1.82 8.99 12.48氨基酸的检测1、茚三酮反应(ninhydrin reaction)试剂颜色备注茚三酮(弱酸环境加热)紫色(脯氨酸、羟脯氨酸为黄色)(检验α-氨基)2、坂口反应(Sakaguchi reaction)α-萘酚+碱性次溴酸钠红色(检验胍基精氨酸有此反应)3、米隆反应(又称米伦氏反应)HgNO3+HNO3+热红色(检验酚基酪氨酸有此反应,未加热则为白色)4、Folin-Ciocalteau反应(酚试剂反应)磷钨酸-磷钳酸蓝色(检验酚基酪氨酸有此反应)5、黄蛋白反应浓硝酸煮沸黄色(检验苯环酪氨酸、苯丙氨酸、色氨酸有此反应)6、Hopkin-Cole反应(乙醛酸反应)加入乙醛酸混合后徐徐加入浓硫酸乙醛与浓硫酸接触面处产生紫红色环(检验吲哚基色氨酸有此反应)7、Ehrlich反应P-二甲氨基苯甲醛+浓盐酸蓝色(检验吲哚基色氨酸有此反应)8、硝普盐试验Na2(NO)Fe(CN)2*2H2O+稀氨水红色(检验巯基半胱氨酸有此反应)9、Sulliwan反应1,2萘醌、4磺酸钠+Na2SO3 红色(检验巯基半胱氨酸有此反应)10、Folin反应1,2萘醌、4磺酸钠在碱性溶液深红色(检验α-氨基酸)肽键(peptide bond):一个氨基酸的羧基与另一个氨基酸的氨基缩合,除去一分子水形成的酰胺键。
肽(peptide):两个或两个以上氨基通过肽键共价连接形成的聚合物。
是氨基酸通过肽键相连的化合物,蛋白质不完全水解的产物也是肽。
肽按其组成的氨基酸数目为2个、3个和4个等不同而分别称为二肽、三肽和四肽等,一般含10个以下氨基酸组成的称寡肽(oligopeptide),由10个以上氨基酸组成的称多肽(polypeptide),它们都简称为肽。
肽链中的氨基酸已不是游离的氨基酸分子,因为其氨基和羧基在生成肽键中都被结合掉了,因此多肽和蛋白质分子中的氨基酸均称为氨基酸残基(ami no acid residue)。
多肽有开链肽和环状肽。
在人体内主要是开链肽。
开链肽具有一个游离的氨基末端和一个游离的羧基末端,分别保留有游离的α-氨基和α-羧基,故又称为多肽链的N端(氨基端)和C端(羧基端),书写时一般将N端写在分子的左边,并用(H)表示,并以此开始对多肽分子中的氨基酸残基依次编号,而将肽链的C端写在分子的右边,并用(OH)来表示。
目前已有约20万种多肽和蛋白质分子中的肽段的氨基酸组成和排列顺序被测定了出来,其中不少是与医学关系密切的多肽,分别具有重要的生理功能或药理作用。
多肽在体内具有广泛的分布与重要的生理功能。
其中谷胱甘肽在红细胞中含量丰富,具有保护细胞膜结构及使细胞内酶蛋白处于还原、活性状态的功能。
而在各种多肽中,谷胱甘肽的结构比较特殊,分子中谷氨酸是以其γ-羧基与半胱氨酸的α-氨基脱水缩合生成肽键的,且它在细胞中可进行可逆的氧化还原反应,因此有还原型与氧化型两种谷胱甘肽。