分析方法验证 - 专属性
- 格式:ppt
- 大小:1.77 MB
- 文档页数:7

分析方法验证与确认管理规程一、目的为了确保分析方法的准确性、可靠性和适用性,保证分析结果的质量,特制定本管理规程。
二、适用范围本规程适用于公司内所有分析方法的验证与确认工作,包括但不限于原材料、中间产品、成品的质量控制分析方法,以及清洁验证、工艺验证等过程中所使用的分析方法。
三、职责分工1、研发部门负责新分析方法的开发,并在方法转移前完成方法的验证工作。
2、质量控制部门负责接收转移的分析方法,并对其进行确认。
在日常工作中,负责按照经过验证或确认的分析方法进行检验,并对方法的适用性进行监控。
3、验证小组由质量控制、研发、生产等相关部门人员组成,负责对重大或复杂的分析方法验证与确认工作进行方案的制定、审核和结果的评价。
四、分析方法验证的类型1、鉴别试验用于确定样品中是否存在被分析物。
2、定量测定包括含量测定、杂质测定等。
3、限度试验用于检测样品中被分析物的含量是否低于或高于规定的限度。
五、分析方法验证的指标1、专属性指在其他成分(如杂质、辅料等)可能存在的情况下,能够准确地测定被分析物的能力。
2、准确性指测定结果与真实值或参考值接近的程度。
3、精密度包括重复性、中间精密度和重现性。
重复性是在相同条件下,由同一分析人员测定结果的精密度;中间精密度是在同一实验室,不同时间、不同分析人员、不同设备等条件下测定结果的精密度;重现性是在不同实验室,由不同分析人员使用不同设备测定结果的精密度。
4、检测限指样品中能够被检测出的被分析物的最低量。
5、定量限指样品中能够被定量测定的被分析物的最低量。
6、线性指在给定的范围内,测试结果与样品中被分析物浓度直接呈正比关系的程度。
7、范围指能够达到一定的准确性、精密度和线性的被分析物浓度的区间。
8、耐用性指在测定条件有小的变动时,分析方法仍然能够保持其有效性的能力。
六、分析方法验证的流程1、验证方案的制定由相关部门根据分析方法的特点和预期用途,制定详细的验证方案,明确验证的指标、方法、接受标准、样品制备、检验步骤等内容。


xxxx含量分析方法验证方案起草签名日期审核签名日期批准签名日期变更历史1 验证目的 (3)2 验证范围 (3)3 验证时间 (3)4职责 (3)5 接受标准 (3)6 检测条件 (4)6.1 仪器、对照品、测试品 (4)6.2 检测方法 (4)7 验证内容 (5)7.1 专属性 (5)7.2 系统适应性 (6)7.3 线性及范围 (6)7.4 准确度 (8)7.5 精密度 (9)7.5.2 方法精密度 (10)7.5.3 中间精密度 (11)7.6 耐用性 (12)7.7 溶液稳定性 (14)7.8 三批样品含量测定 (15)7 偏差及异常处理 (16)8 验证结果结论与评价 (17)1 验证目的本分析方法验证方案的目的在于验证XXX含量分析方法,能有效的用于含量测定。
2 验证范围1)系统适应性2)专属性3)线性及范围4)精密度5)准确度6)耐用性7)溶液稳定性8)三批样品含量测定3 验证时间2013年1月4职责质量分析室分析员:起草验证方案并付诸实施,起草验证报告并做好相关的原始记录。
质量分析室副主任:审核验证方案及验证报告;准备相关仪器、试剂及人员安排,在验证实施过程中提供技术指导。
质量分析室主任:批准验证方案及验证报告。
6检测条件6.1仪器、对照品、测试品6.1.1 仪器6.1.2 对照6.1.3 测试品6.2检测方法6.2.1色谱条件色谱柱:Welch Ultimate RP 4.6*250mm 5um进样量:20ul柱温:25℃检测波长:298nm流动相A:20Mmol/L的磷酸二氢钾溶液(用氢氧化钾调节pH=5.70)流动相B:乙腈6.2.2溶液配制对照溶液: 称取约25.0mgXXXX对照品,置25ml容量瓶中,用流动相A溶解并稀释至刻度,作为对照品溶液。
供试液:称取约25.0mgXXXX供试品,置25ml容量瓶中,用流动相A溶解并稀释至刻度,作为供试品溶液。
7验证内容7.1专属性7.1.1 溶液配制B10:取25.0mgB10,精密称定,置25 ml容量瓶中,用流动相A并稀释至刻度,摇匀,即可。



体内药分作业J药剂0901 3091158012 钱晨药品质量标准分析方法验证的内容有:准确度,精密度(包括重复性,中间精密度和重现性),专属性,检测限,定量限,线性,范围和耐用性。
一、专属性1、体内:必须证明所测定的物质是原形药物或特定的活性代谢物,内源性物质和相应的代谢物不得干扰样品的测定。
对于色谱法至少要提供空白生物样品色谱图,空白生物样品外加对照色谱图记用药后的生物样品色谱图。
对于复方制剂应特别加强专属性研究,以排除可能的干扰。
2、体外:专属性系指在其他成分(如杂质,降解产物,辅料等)可能存在的情况下,采用的方法能正确测定出被测物的特性。
鉴别反应,杂质检查和含量测定方法,均应考察专属性。
如方法不够专属,应采用多个方法予以补充。
A、鉴别反应应能与可能共存的物质或结构相似的化合物区分。
不含被测物成分的供试品,以及结构相似或组分中的有关化合物,应均呈负反应。
B、含量测定和杂质测定色谱法和其他分离方法,应附代表性图谱,以说明方法的专属性,并标明诸成分在图谱中的位置,色谱中的分离应符合要求。
二、标准曲线和线性范围1、体内:根据所测定物质的浓度与响应的相关性,用回归分析方法获得标准曲线。
标准曲线高低浓度范围为线性范围,在线性范围内浓度测定结果应达到实验要求的精密度和准确度。
必须用至少6个浓度建立标准曲线,应使用与待测样品相同的生物介质,线性范围要能覆盖全部待测浓度,不允许将线性范围外推求算未知样品的浓度。
标准曲线不包括零点。
标准曲线上各浓度点的实测值与标示值的偏差(bias)在可接受范围内时,可判定标准曲线合格。
回归值系将各浓度点的响应值代人标准曲线计算所得的浓度值;标示值系指制备标准曲线时,各相应浓度点的配制浓度,标准曲线上各浓度点偏差的可接受范围一般规定为:最低浓度点的偏差在±20%以内,在其余各浓度点的偏差在±15%以内。
只有合格的标准曲线才能用于临床待测样品的浓度计算。
当线性范围较宽时,推荐采用加权最小二乘法(weighted least square method)进行同归计算2、体外:线性是只在设计范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。
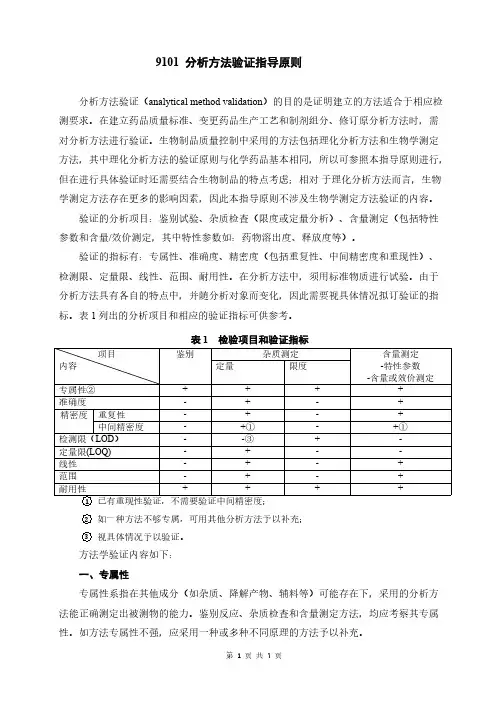
9101分析方法验证指导原则分析方法验证(analytical method validation)的目的是证明建立的方法适合于相应检测要求。
在建立药品质量标准、变更药品生产工艺和制剂组分、修订原分析方法时,需对分析方法进行验证。
生物制品质量控制中采用的方法包括理化分析方法和生物学测定方法,其中理化分析方法的验证原则与化学药品基本相同,所以可参照本指导原则进行,但在进行具体验证时还需要结合生物制品的特点考虑;相对于理化分析方法而言,生物学测定方法存在更多的影响因素,因此本指导原则不涉及生物学测定方法验证的内容。
验证的分析项目:鉴别试验、杂质检查(限度或定量分析)、含量测定(包括特性参数和含量/效价测定,其中特性参数如:药物溶出度、释放度等)。
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围、耐用性。
在分析方法中,须用标准物质进行试验。
由于分析方法具有各自的特点中,并随分析对象而变化,因此需要视具体情况拟订验证的指标。
表1列出的分析项目和相应的验证指标可供参考。
表1检验项目和验证指标项目内容鉴别杂质测定含量测定-特性参数-含量或效价测定定量限度专属性②++++准确度-+-+精密度重复性-+-+中间精密度-+①-+①检测限(LOD)--③+-定量限(LOQ)-+--线性-+-+范围-+-+耐用性++++ 1已有重现性验证,不需要验证中间精密度;2如一种方法不够专属,可用其他分析方法予以补充;3视具体情况予以验证。
方法学验证内容如下:一、专属性专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。
鉴别反应、杂质检査和含量测定方法,均应考察其专属性。
如方法专属性不强,应采用一种或多种不同原理的方法予以补充。
1.鉴别反应应能区分可能共存的物质或结构相似的化合物。
不含被测成分的供试品,以及结构相似或组分中的有关化合物,应均呈阴性反应。

化学药物分析方法验证的内容和评价质量可控是活性化合物成药及进行药品安全有效性评价的前提。
对药品的质量进行控制应该是多方面的,其中包括生产环境的控制、原辅料来源和质量的控制、生产工艺过程的控制,以及按照质量标准进行成品检验控制等。
但是,在药品研发过程中,揭示药品的品质、控制药品的质量,通常是要针对研制药品的特性 (主药的理化性质及制剂的质量要求等 )确定相应的研究测试项目,再根据测试项目的需要,建立适宜的分析方法 (包括方法的选择和方法的验证 ),最后是根据药品质量的要求及安全性研究结果确定各测试项目的限度,起草制订检验药品质量的质量标准。
分析方法是揭示药品品质的工具和手段,方法验证是判断采用的分析方法是否科学、可行的过程。
实际上,方法验证就是根据确定的检测项目的要求,预先设置一定的验证内容,并通过设计合理的试验来验证所采用的分析方法能否符合检测项目的要求。
下面就根据《化学药物质量控制分析方法验证技术指导原则》解读分析方法验证的内容和评价要点,在对目前申报资料中分析方法验证工作中存在的问题进行分析的基础上,以高效液相色谱法为例,阐述方法验证的思路及验证要点,希望能对药物研发者有所帮助。
一、方法验证的内容首先应该明确的是:方法验证的内容应根据检测项目的要求,同时结合所采用的分析方法的特点确定。
相同的分析方法用于不同的检测项目时,其验证要求是不同的。
例如,采用高效液相色谱法用于制剂的鉴别和杂质定量检查时的验证要求是不同的;前者重点要验证方法的专属性,而后者重点要验证方法的专属性、准确度和定量限。
通常需要验证的检测项目:鉴别、杂质检查 (限度试验、定量试验 )、定量测定 (含量测定、溶出度、释放度等 ),还有其他特定的检测项目 (粒径分布、分子量分布)等。
方法验证的内容包括专属性、线性、范围、准确度、精密度、检测限、定量限、耐用性 (粗放度 )和系统适用性等。
1、专属性专属性系指在其他成分 (如杂质、降解物、辅料等 )存在下,采用的分析方法能够正确鉴定、检出被测物的特性。


验证内容:准确度、精密度(包括重复性、中间精密度和重现性)、专属性、检测限、定量限、线性、范围和耐用性。
一、准确度:是指用该方法测定的结果与真实值或参考值接近的程度,一般以百分回收率表示。
至少用9次测定结果进行评价。
二、精密度:是指在规定的条件下,同一个均匀样品,经过多次取样测定所得结果之间的接近程度。
用偏差、标准偏差或相对标准偏差表示。
1、重复性:相同条件下,一个分析人员测定所得结果的精密度称为重复性。
至少9次。
2、中间精密度:一个实验室,不同时间不同分析人员用不同设备测定结果的精密度。
3、重现性:不同实验室,不同分析人员测定结果的精密度。
分析方法被法定标准采用应进行重现性试验。
三、专属性:指在其他成分可能存在的情况下,采用的方法能准确测定出被测物的特性,用于复杂样品分析时相互干扰的程度。
鉴别反应、杂质检查、含量测定方法,圴应考察专属性。
四、检测限:指试样中被测物能被检测出的最低量,无须定量。
用百分数、ppm或ppb 表示。
五、定量限:指样品中被测物能被定量测定的最低量,测定结果应具一定的精密度和准确度。
六、线性:系指在设计的范围内,测试结果与试样中被测物浓度直接呈正比关系的程度。
七、范围:能达到一定的精密度、准确度和线性的条件下,测试方法适用的高低限浓度或量的区间。
八、耐用性:指在一定的测定条件稍有变动时,测定结果不受影响的承受程度。
方法验证内容如下。
一、准确度准确度系指用该方法测定的结果与真实值或参考值接近的程度,一般用回收率(%)表示。
准确度应在规定的范围内测试。
1.含量测定方法的准确度原料药可用已知纯度的对照品或样品进行测定,或用本法所得结果与已知准确度的另一个方法测定的结果进行比较。
制剂可用含已知量被测物的各组分混合物进行测定。
如不能得到制剂的全部组分,可向制剂中加入已知量的被测物进行测定,或用本法所得结果与已知准确度的另一个方法测定结果进行比较。
如该分析方法已经测试并求出了精密度、线性和专属性,在准确度也可推算出来的情况下,这一项可不必再做。

液相色谱仪HPLC分析方法验证液相色谱解决方案为了保证分析检测结果精准、牢靠,必需对所接受的分析方法的精准性、科学性和可行性进行验证,以证明分析方法符合检测的目的和要求,这就是分析方法验证。
从本质上讲,方法验证就是依据检测项目的要求,预先设置确定的验证内容,并通过设计合理的试验来验证所接受的分析方法符合检测项目的要求。
方法验证在质量掌控上有紧要的作用和意义,只有经过验证的分析方法才能用于药品生产的分析检测,方法验证是订立质量标准的基础。
方法验证内容包括方法的专属性、线性、范围、精准度、精密度、检出限、定量限、耐用性和系统适用性等,检测目的不同验证要求也不尽相同。
1.专属性专属性是指分析方法能够将产品和杂质分开的特性,也称为选择性。
对于纯度检测,可在标准品中加入产品中的已知杂质,或者直接用粗品,考察产品峰是否受到杂质的干扰,对于过程跟踪,可用反应体系样品来考察有没有其它的杂质干扰。
必要时使用二极管阵列检测器或者质谱检测器进行色谱峰纯度检查。
一般要求产品和杂质之间的分别度大于2.0、2.线性线性是在设定的范围内,检测结果与样品中原材料或产品的浓度呈线性关系的程度。
线性是定量检测的基础,需要定量检测的项目都需要验证线性。
一般用储备液经过精密稀释,或分别精密称样,制备得到一系列被测物质的浓度(5个以上),按浓度从小到大运行序列,以峰面积和浓度的函数作图,用zui小二乘法进行线性回归计算,考察分析方法的线性。
3.范围范围指在能够达到确定的精准度、精密度和线性时,样品中被分析物的浓度区间。
简单的说,范围就是分析方法适用的样品中待测物的浓度zui大值和zui小值。
需要定量检测的分析方法都需要对范围进行验证,纯度检测时,范围应为测试浓度的80%~120%。
4.精准度精准度是指测定的结果与真实值之间接近的程度,所以也叫做真实度,需要定量得分析方法均需要验证精准度。
精准度应在规定的范围内建立,对于原材料药可用已知纯度的标准品或符合要求的原材料药进行测定,必要时可与另一个已建立精准度的方法比较结果。
分析方法验证指导原则验证的分析项目有:鉴别试验、杂质测定(限度或定量分析)、含量测定(包括特性参数和含量/效价测定,其中特性参数如:药物溶出度、释放度等)。
验证的指标有:专属性、准确度、精密度(包括重复性、中间精密度和重现性)、检测限、定量限、线性、范围和耐用性。
在分析方法验证中,须用标准物质进行试验。
由于分析方法具有各自的特点,并随分析对象而变化,因此需要视具体情况拟订验证的指标。
表1中列出的分析项目和相应的验证指标可供参考。
方法验证内容如下。
专属性专属性系指在其他成分(如杂质、降解产物、辅料等)可能存在下,采用的分析方法能正确测定出被测物的能力。
鉴别反应、杂质检查和含量测定方法,均应考察其专属性。
如方法专属性不强,应采用一种或多种不同原理的方法予以补充。
二、准确度准确度系指用所建立方法测定的结果与真实值或参比值接近的程度,一般用回收率(%)表示。
准确度应在规定的线性范围内试验。
准确度也可由所测定的精密度、线性和专属性推算出来。
在规定范围内,取同一浓度(相当于100%浓度水平)的供试品,用至少6份样品的测定结果进行评价;或设计至少3种不同浓度,每种浓度分别制备至少3份供试品溶液进行测定,用至少9份样品的测定结果进行评价,且浓度的设定应考虑样品的浓度范围。
两种方法的选定应考虑分析的目的和样品的浓度范围。
三、精密度精密度系指在规定的测定条件下,同一份均匀供试品,经多次取样测定所得结果之间的接近程度。
精密度一般用偏差、标准偏差或相对标准偏差表示。
在相同条件下,由同一个分析人员测定所得结果的精密度称为重复性;在同一实验室内的条件改变,如不同时间、不同分析人员、不同设备等测定结果之间的精密度,称为中间精密度;不同实验室测定结果之间的精密度,称为重现性。
含量测定和杂质的定量测定应考察方法的精密度。
1.重复性在规定范围内,取同一浓度(分析方法拟定的样品测定浓度,相当于100%浓度水平)的供试品,用至少6份的测定结果进行评价;或设计至少3种不同浓度,每种浓度分别制备至少3份供试品溶液进行测定,用至少9份样品的测定结果进行评价。
【药物分析方法学验证】分析方法的方法学验证分析方法的方法学验证一、方法验证1.准确度该指标主要是通过回收率来反映。
验证时一般要求分别配制浓度为80%、100%和120%的供试品溶液各三份,分别测定其含量,将实测值与理论值比较,计算回收率。
可接受的标准为:各浓度下的平均回收率均应在98.0%-102.0%之间,9个回收率数据的相对标准差(RSd)应不大于2.0%。
2.线性线性一般通过线性回归方程的形式来表示。
具体的验证方法为:在80%至120%的浓度范围内配制6份浓度不同的供试液,分别测定其主峰的面积,计算相应的含量。
以含量为横坐标(X),峰面积为纵坐标(Y),进行线性回归分析。
可接受的标准为:回归线的相关系数(R)不得小于0.998,Y轴截距应在100%响应值的2%以内,响应因子的相对标准差应不大于2.0%。
3.精密度1)重复性配制6份相同浓度的供试品溶液,由一个分析人员在尽可能相同的条件下进行测试,所得6份供试液含量的相对标准差应不大于2.0%。
2)中间精密度配制6份相同浓度的供试品溶液,分别由两个分析人员使用不同的仪器与试剂进行测试,所得12个含量数据的相对标准差应不大于2.0%。
4.专属性可接受的标准为:空白对照应无干扰,主成分与各有关物质应能完全分离,分离度不得小于2.0。
以二极管阵列检测器进行纯度分析时,主峰的纯度因子应大于980。
5.检测限主峰与噪音峰信号的强度比应不得小于3。
6.定量限主峰与噪音峰信号的强度比应不得小于10。
另外,配制6份最低定量限浓度的溶液,所测6份溶液主峰的保留时间的相对标准差应不大于2.0%。
7.耐用性分别考察流动相比例变化±5%、流动相pH值变化±0.2、柱温变化±5℃、流速相对值变化±20%时,仪器色谱行为的变化,每个条件下各测试两次。
可接受的标准为:主峰的拖尾因子不得大于2.0,主峰与杂质峰必须达到基线分离;各条件下的含量数据(n=6)的相对标准差应不大于2.0%。
【分析方法验证的内容】分析方法的验证分析方法的验证,就是对药品分析实验所采用的分析方法是否完全达到了预期目的,或证明由分析方法误差而导致试验结果判断错误的概率是否在允许范围之内,而进行的科学证明。
分析方法的验证以验证参数表示。
在制定药品质量标准时,可通过这些参数证明所建立的分析方法是否适当。
本文所述分析方法验证是指下述情况:药局方新收载品种质量标准的建立;药局方已收载品种质量标准的修订;根据药局方的通则建立替代方法。
1日本药局方收载分析方法所需资料1.1概要对分析方法作简要说明,包括所采用分析方法的必要性,特点与优点及有关验证的要点。
如系分析方法的修订,则需阐明新方法与原方法的区别以及新方法的优势。
1.2分析方法本项记载的有关分析方法的内容要足以能对分析方法进行评价,并且必要时可用复核试验进行评价。
分析方法主要记载内容包括:分析的步骤、标准品及样品的制备方法、试剂与试药的调配、注意事项、分析系统是否正常运转的检验证明方法(例如高效液相色谱法中的分离效率的研究)、分析结果的计算公式、测定次数等。
并且,如果使用了药局方以外的装置,还需详述有关内容;如果使用了新的标准品,则必须提供其物理、化学及生物学特征数据,并提供其质量标准。
1.3有关分析方法验证的资料本项应包括求导各验证参数的试验设计、试验数据、计算结果及检定结果等。
2验证参数(validationcharacterisitics)分析方法适当与否可通过验证参数进行评价,下面列举了最典型的分析方法验证参数的定义及其评价方法。
验证参数的有关术语及定义因分析方法的应用领域不同而不同,本文所使用的术语及定义仅限于日本药局方。
评价方法项下所述内容也仅为简要概述。
确定验证参数的方法很多,采用何种方法没有具体限制。
但是,验证参数的限值常因确定方法的不同而发生变化。
故此,确定验证参数的实验方法、实验数据、计算方法等应尽可能详细地记述。
本文分析方法验证中未包括验证参数适应性/牢固性(Robustness)的讨论,这是由于牢固性的研究主要在分析方法的开发设计阶段进行,其研究结果可以在方法的分析条件或注意事项中得到体现。