2018年高考化学真题分类汇编
- 格式:docx
- 大小:67.68 KB
- 文档页数:10

2018年高考化学真题分类汇编专题4 非金属及其化合物(必修1)Ⅰ—无机非金属材料的主角——硅(碳族元素)1.[2018江苏卷-3]下列有关物质性质与用途具有对应关系的是A. NaHCO3受热易分解,可用于制胃酸中和剂B. SiO2熔点高硬度大,可用于制光导纤维C. Al2O3是两性氧化物,可用作耐高温材料D. CaO能与水反应,可用作食品干燥剂【答案】D【解析】A项,NaHCO3受热易分解的原理是:2NaHCO3Na2CO3 +H2O +CO2↑,NaHCO3用于制胃酸中和剂的原理是:NaHCO3+HCl= NaCl+ H2O+ CO2↑,两者没有对应关系,A 错误;B项,SiO2传导光的能力非常强,用于制光导纤维,这与SiO2熔点高硬度大没有对应关系,B错误;C项,Al2O3的熔点很高,用作耐高温材料,这与Al2O3是两性氧化物没有对应关系,C错误;D项,CaO能与水反应,用于食品干燥剂,CaO用于食品干燥剂与CaO与水反应有对应关系,D正确。
【考点】常见无机物:NaHCO3、SiO2、Al2O3、CaO的性质和用途。
2.[2018天津卷-1] 以下是中华民族为人类文明进步做出巨大贡献的几个事例,运用化学知识对其进行的分析不合理的是A. 四千余年前用谷物酿造出酒和醋,酿造过程中只发生水解反应B. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎属于铜合金制品C. 汉代烧制出“明如镜、声如磬”的瓷器,其主要原料为黏士D. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作【答案】A【解析】A.谷物中的淀粉在酿造中发生水解反应只能得到葡萄糖,葡萄糖要在酒化酶作用下分解,得到酒精和二氧化碳。
酒中含有酒精,醋中含有醋酸,显然都不是只水解就可以生成的。
选项A不合理。
B.商代后期铸造出工艺精湛的后(司)母戊鼎属于青铜器,青铜是铜锡合金。
选项B合理。
C.陶瓷的制造原料为黏土。
选项C合理。
D.屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,是利用青蒿素在乙醚中溶解度较大的原理,将青蒿素提取到乙醚中,所以属于萃取操作。
2018年高考化学真题分类汇编专题8水溶液中的离子平衡(选修4)I—弱电解质的电离1. [2018天津卷-3]下列叙述正确的是A. 某温度下,一元弱酸HA的K a越小,则NaA的K h(水解常数)越小B. 铁管镀锌层局部破损后,铁管仍不易生锈C. 反应活化能越高,该反应越易进行D. 不能用红外光谱区分C2H5OH和CHOCH J【答案】B【解析】A.根据越弱越水解”的原理,HA的K a越小,代表HA越弱,所以A-的水解越强,应该是NaA 的心(水解常数)越大。
选项A错误。
B.铁管镀锌层局部破损后,易形成锌铁原电池,因为锌比铁活泼,所以锌为负极,对正极铁起到了保护作用,延缓了铁管的腐蚀。
选B正确。
C.反应的活化能越高,反应越难进行。
选项C错误。
D.红外光谱是用来检测有机物中的官能团或特定结构的,C2H5OH和CH S OCH S的官能团明显有较大差异,所以可以用红外光谱区分,选项D错误。
【考点】水解平衡常数与电离平衡常数的关系、金属的防护、活化能、红外光谱与化学键。
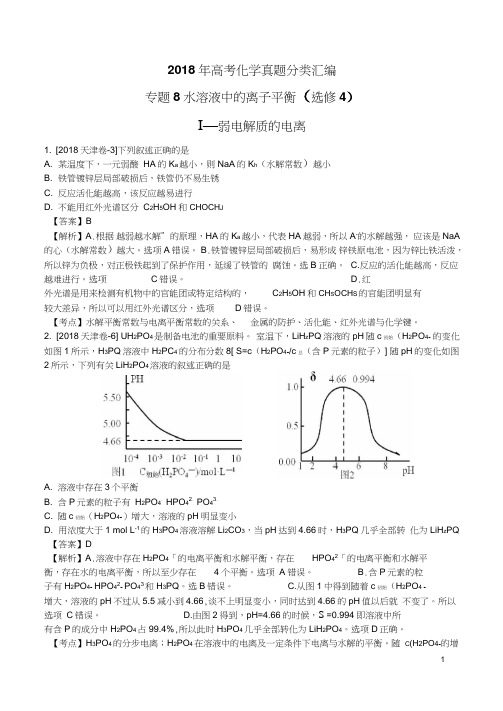
2. [2018天津卷-6] UH2PO4是制备电池的重要原料。
室温下,LiH z PQ溶液的pH随c初始(H2PO4- 的变化如图1所示,H3PQ溶液中H2PC4-的分布分数8[ S=c(H2PO4-/c总(含P元素的粒子)] 随pH的变化如图2所示,下列有关LiH2PO4溶液的叙述正确的是A. 溶液中存在3个平衡B. 含P元素的粒子有H2PO4-HPO42-PO43-C. 随c初始(H2PO4-)增大,溶液的pH明显变小D. 用浓度大于1 mol L-1的H3PO4溶液溶解Li2CO3,当pH达到4.66时,H3PQ几乎全部转化为LiH z PQ 【答案】D【解析】A.溶液中存在H2PO4「的电离平衡和水解平衡,存在HPO42「的电离平衡和水解平衡,存在水的电离平衡,所以至少存在4个平衡。
选项A错误。
B.含P元素的粒子有H2PO4- HPO42- PO43和H3PQ。

五年2018-2022年高考化学真题按知识点分类汇编-离子反应-电解质的电离(含答案解析)一、单选题1.(2022·浙江·统考高考真题)下列物质属于非电解质的是A.CH4B.KI C.NaOH D.CH3COOH 2.(2021·北京·高考真题)使用如图装置(搅拌装置略)探究溶液离子浓度变化,灯光变化不可能出现“亮→暗(或灭)→亮”现象的是A.A B.B C.C D.D 3.(2021·浙江·高考真题)下列物质属于弱电解质的是A.CO2B.H2O C.HNO3D.NaOH 4.(2021·浙江·统考高考真题)下列物质属于强电解质的是A.KOH B.H3PO4C.SO3D.CH3CHO 5.(2020·浙江·高考真题)下列物质在熔融状态下不导电...的是A.NaOH B.2CaCl C.HCl D.K SO24 6.(2020·浙江·统考高考真题)下列属于有机物,又是电解质的是()A.己烷B.乙酸C.葡萄糖D.纯碱7.(2019·北京·高考真题)下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示) NaCl 溶于水 电解CuCl 2溶液 CH 3COOH 在水中电离H 2与Cl 2反应能量变化A .AB .BC .CD .D8.(2019·全国·高考真题)离子交换法净化水过程如图所示。
下列说法中错误的是A .经过阳离子交换树脂后,水中阳离子的总数不变B .水中的3NO - 、24SO -、Cl −通过阴离子树脂后被除去C .通过净化处理后,水的导电性降低D.阴离子树脂填充段存在反应H++OH−H2O 9.(2018·浙江·校联考高考真题)下列属于电解质的是A.氯化钠B.蔗糖C.氯气D.铁参考答案:1.A【分析】水溶液中或熔融状态下能够导电的化合物称为电解质,包括酸、碱、大多数的盐都是电解质;在水溶液中和熔融状态下均不能导电的化合物为非电解质;据此解答。


2018年普通高等学校招生全国统一考试(江苏卷)化学可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Al 27 S 32 Cl 35.5 Ca 40 Fe 56Cu 64 Ag 108 I 127 Ba 137选择题单项选择题:本题包括10 小题,每小题2 分,共计20 分。
每小题只有一个....选项符合题意。
1.CO2是自然界碳循环中的重要物质。
下列过程会引起大气中CO2含量上升的是A.光合作用B.自然降雨C.化石燃料的燃烧D.碳酸盐的沉积2.用化学用语表示NH 3+ HCl NH4Cl中的相关微粒,其中正确的是O B.HCl 的电子式:A.中子数为8 的氮原子:87C.NH3的结构式:D.Cl−的结构示意图:3.下列有关物质性质与用途具有对应关系的是A.NaHCO3受热易分解,可用于制胃酸中和剂B.SiO2熔点高硬度大,可用于制光导纤维C.Al2O3是两性氧化物,可用作耐高温材料D.CaO能与水反应,可用作食品干燥剂4.室温下,下列各组离子在指定溶液中能大量共存的是A.0. 1 mol·L−1KI 溶液:Na+、K+、ClO−、OH−B.0. 1 mol·L−1Fe2(SO4)3溶液:Cu2+、NH4+、NO3−、SO42−C.0. 1 mol·L−1HCl 溶液:Ba2+、K+、CH3COO−、NO3−D.0. 1 mol·L−1NaOH溶液:Mg2+、Na+、SO42−、HCO3−5.下列有关从海带中提取碘的实验原理和装置能达到实验目的的是A.用装置甲灼烧碎海带B.用装置乙过滤海带灰的浸泡液C.用装置丙制备用于氧化浸泡液中I−的Cl2D.用装置丁吸收氧化浸泡液中I−后的Cl2尾气6.下列有关物质性质的叙述一定不正确的是A.向FeCl2溶液中滴加NH4SCN溶液,溶液显红色B.KAl(SO4) 2·12H2O溶于水可形成Al(OH)3胶体C.NH4Cl与Ca(OH)2混合加热可生成NH3D.Cu与FeCl3溶液反应可生成CuCl27. 下列指定反应的离子方程式正确的是A.饱和Na2CO3溶液与CaSO4固体反应:CO32−+CaSO4CaCO3+SO42−B.酸化NaIO 3和NaI的混合溶液:I− +IO3−+6H+I2+3H2OC.KClO碱性溶液与Fe(OH)3反应:3ClO−+2Fe(OH)32FeO42−+3Cl−+4H++H2OD.电解饱和食盐水:2Cl−+2H+通电Cl2↑+ H2↑8.短周期主族元素X、Y、Z、W 原子序数依次增大,X 是地壳中含量最多的元素,Y 原子的最外层只有一个电子,Z 位于元素周期表ⅢA族,W 与X属于同一主族。

五年2018-2022高考化学真题按知识点分类汇编7-氧化还原反应基本概念(含解析)一、单选题1.(2022·湖南·高考真题)科学家发现某些生物酶体系可以促进+H 和-e 的转移(如a 、b 和c),能将海洋中的2NO -转化为2N 进入大气层,反应过程如图所示。
下列说法正确的是A .过程Ⅰ中2NO -发生氧化反应B .a 和b 中转移的-e 数目相等C .过程Ⅱ中参与反应的()4+n(NO):n NH =1:4D .过程Ⅰ→Ⅲ的总反应为-+2422NO +NH =N +2H O ↑2.(2022·山东·高考真题)实验室制备4KMnO 过程为:①高温下在熔融强碱性介质中用3KClO 氧化2MnO 制备24K MnO ;②水溶后冷却,调溶液pH 至弱碱性,24K MnO 歧化生成4KMnO 和2MnO ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得4KMnO 。
下列说法正确的是A .①中用瓷坩埚作反应器B .①中用NaOH 作强碱性介质C .②中24K MnO 只体现氧化性D .2MnO 转化为4KMnO 的理论转化率约为66.7%3.(2022·山东·高考真题)古医典富载化学知识,下述之物见其氧化性者为 A .金(Au):“虽被火亦未熟"B .石灰(CaO):“以水沃之,即热蒸而解”C .石硫黄(S):“能化……银、铜、铁,奇物”D .石钟乳(3CaCO ):“色黄,以苦酒(醋)洗刷则白”4.(2022·浙江·统考高考真题)关于反应223242422Na S O H SO =Na SO S ++SO ++H O ↓↑,下列说法正确的是 A .24H SO 发生还原反应B .223Na S O 既是氧化剂又是还原剂C .氧化产物与还原产物的物质的量之比为2∶1D .2231mol Na S O 发生反应,转移4mol 电子5.(2022·浙江·统考高考真题)关于反应4CO 2+SiH 4 高温4CO+2H 2O+SiO 2,下列说法正确的是 A .CO 是氧化产物B .SiH 4发生还原反应C .氧化剂与还原剂的物质的量之比为1∶4D .生成1molSiO 2时,转移8mol 电子 6.(2021·江苏·高考真题)黑火药是中国古代四大发明之一,其爆炸反应为2KNO 3+S+3C=K 2S+N 2↑+3CO 2↑。
五年2018-2022年高考化学真题按知识点分类汇编-镁及其化合物(含答案解析)一、单选题1.(2022·海南·统考高考真题)依据下列实验,预测的实验现象正确的是A.A B.B C.C D.D 2.(2021·浙江·统考高考真题)下列说法不正确...的是A.铁粉与氧化铝发生的铝热反应可用于焊接铁轨B.镁燃烧会发出耀眼的白光,可用于制造信号弹和焰火C.熟石膏与水混合成糊状后能很快凝固,常用于制作模型和医疗石膏绷带D.工业上可用氨水消除燃煤烟气中的二氧化硫3.(2021·浙江·高考真题)下列说法不正确...的是A.硅酸钠是一种难溶于水的硅酸盐B.镁在空气中燃烧可生成氧化镁和氮化镁C.钠与水反应生成氢氧化钠和氢气D.常温下,铝遇浓硝酸或浓硫酸时会发生钝化4.(2021·重庆·统考高考真题)下列叙述错误的是A.Mg在空气中燃烧可生成MgOB.Fe2O3与Al发生铝热反应可生成FeC.BaCl2溶液与CO2反应可生成BaCO3D.Ca(OH)2溶液与Cl2反应可生成Ca(ClO)25.(2020·山东·高考真题)利用下列装置(夹持装置略)进行实验,能达到实验A .用甲装置制备并收集CO 2B .用乙装置制备溴苯并验证有HBr 产生C .用丙装置制备无水MgCl 2D .用丁装置在铁上镀铜6.(2020·浙江·高考真题)下列说法正确的是A .2Na O 在空气中加热可得固体22Na OB .Mg 加入到过量3FeCl 溶液中可得FeC .2FeS 在沸腾炉中与2O 反应主要生成3SOD .22H O 溶液中加入少量2MnO 粉末生成2H 和2O7.(2019·全国·高考真题)下列实验现象与实验操作不相匹配的是A .AB .BC .CD .D8.(2019·江苏·高考真题)在给定条件下,下列选项所示的物质间转化均能A .NaCl(aq)−−−→电解Cl 2(g)Fe(s)−−−→△FeCl 2(s) B .MgCl 2(aq)−−−→石灰乳Mg(OH)2(s)−−−→煅烧MgO (s) C .S(s)2O (g)−−−→点燃SO 3(g)2H O(l)−−−→H 2SO 4(aq) D .N 2(g)2H (g)−−−−−−→高温高压、催化剂NH 3(g)2CO (g)aq)−−−−→N aCl (Na 2CO 3(s) 9.(2019·浙江·高考真题)针对下列实验现象表述不正确...的是 A .用同一针筒先后抽取80 mL 氯气、20 mL 水,振荡,气体完全溶解,溶液变为黄绿色B .在表面皿中加入少量胆矾,再加入3 mL 浓硫酸,搅拌,固体由蓝色变白色C .向二氧化硫水溶液中滴加氯化钡溶液,再滴加双氧水,产生白色沉淀D .将点燃后的镁条伸入充满二氧化碳的集气瓶,镁条剧烈燃烧,有白色、黑色固体生成10.(2018·海南·高考真题)下列化合物中,能与Na 2CO 3溶液反应生成沉淀且沉淀可溶于NaOH 溶液的是A .MgCl 2B .Ca(NO 3)2C .FeSO 4D .AlCl 3二、元素或物质推断题11.(2018·浙江·校联考高考真题)某同学用含结晶水的正盐X(四种短周期元素组成的纯净物)进行了如下实验:实验中观测到:混合气甲呈无色并被蒸馏水全部吸收;固体乙为纯净物;在步骤③中,取1/10溶液丙,恰好中和需消耗0.00200molNaOH ;另取一定量的溶液丙,加入少量K 2FeO 4固体,产生黄绿色气体。
2018年高考化学试题分类汇编化学用语1.【2018全国2卷】化学与生活密切相关。
下列说法错误的是A.碳酸钠可用于去除餐具的油污B.漂白粉可用于生活用水的消毒C.氢氧化铝可用于中和过多胃酸D.碳酸钡可用于胃肠X射线造影检查【答案】D【解析】分析:A.碳酸钠溶液显碱性;B.漂白粉具有强氧化性;C.氢氧化铝能与酸反应;D.碳酸钡可溶于酸。
拓展:本题主要是考查常见化学物质的性质和用途判断,题目难度不大。
平时注意相关基础知识的积累并能灵活应用即可,注意碳酸钡与硫酸钡的性质差异。
2.【2018全国3卷】化学与生活密切相关。
下列说法错误的是A.泡沫灭火器可用于一般的起火,也适用于电器起火B.疫苗一般应冷藏存放,以避免蛋白质变性C.家庭装修时用水性漆替代传统的油性漆,有利于健康及环境D.电热水器用镁棒防止内胆腐蚀,原理是牺牲阳极的阴极保护法【答案】A【解析】分析:本题考查的是化学知识在具体的生产生活中的应用,进行判断时,应该先考虑清楚对应化学物质的成分,再结合题目说明判断该过程的化学反应或对应物质的性质即可解答。
拓展:本题是一道比较传统的化学与生产生活相关的问题,需要学生能够熟悉常见化学物质的性质和用途,同时能用化学原理解释生产生活中的某些过程。
需要指出的是,选项D中的牺牲阳极的阴极保护法,实际指的是形成原电池的保护方法。
3.【2018北京卷】下列我国科技成果所涉及物质的应用中,发生的不是..化学变化的是A.A B.B C.C D.D【答案】B【解析】分析:A项,甲醇低温制氢气有新物质生成,属于化学变化;B项,氘、氚用作核聚变燃料,是核反应,不属于化学变化;C项,偏二甲肼与N2O4反应生成CO2、N2和H2O,放出大量热,属于化学变化;D项,可燃冰是甲烷的结晶水合物,CH4燃烧生成CO2和H2O,放出大量热,属于化学变化。
详解:A项,甲醇低温制氢气有新物质生成,属于化学变化;B项,氘、氚用作核聚变燃料,是核反应,不属于化学变化;C项,偏二甲肼与N2O4反应生成CO2、N2和H2O,放出大量热,反应的化学方程式。
2018年高考真题之有机化学基础全国1卷11.环之间共用一个碳原子的化合物称为螺环化合物,螺[2,2]戊烷()是最简单的一种。
下列关于该化合物的说法错误的是A.与环戊烯互为同分异构体 B.二氯代物超过两种C.所有碳原子均处同一平面 D生成1 mol C5H12至少需要2 mol H2全国1卷36.[化学一选修5:有机化学基础](15分)化合物W可用作高分子膨胀剂,一种合成路线如下:回答下列问题:(1)A的化学名称为。
(2)②的反应类型是。
(2)反应④所需试剂,条件分别为。
(4)G的分子式为。
(5)W中含氧官能团的名称是。
(6)写出与E互为同分异构体的酯类化合物的结构简式(核磁共振氢谱为两组峰,峰面积比为1∶1)。
(7)苯乙酸苄酯()是花香型香料,设计由苯甲醇为起始原料制备苯乙酸苄酯的合成路线(无机试剂任选)。
全国2卷36.[化学——选修5:有机化学基础](15分)以葡萄糖为原料制得的山梨醇(A)和异山梨醇(B)都是重要的生物质转化平台化合物。
E是一种治疗心绞痛的药物,由葡萄糖为原料合成E的过程如下:回答下列问题:(1)葡萄糖的分子式为__________。
(2)A中含有的官能团的名称为__________。
(3)由B到C的反应类型为__________。
(4)C的结构简式为__________。
(5)由D到E的反应方程式为。
(6)F是B的同分异构体,7.30 g的F足量饱和碳酸氢钠可释放出2.24 L二氧化碳(标准状况),F的可能结构共有________种(不考虑立体异构),其中核磁共振氢谱为三组峰,峰面积比为3∶1∶1的结构简式为_________。
全国3卷36.[化学——选修5:有机化学基础](15分)近来有报道,碘代化合物E与化合物H在Cr-Ni催化下可以发生偶联反应,合成一种多官能团的化合物Y,其合成路线如下:已知:回答下列问题:(1)A的化学名称是________________。
(2)B为单氯代烃,由B生成C的化学方程式为。
五年2018-2022高考化学真题按知识点分类汇编18-碳元素及其化合物-二氧化硅(含解析)一、单选题1.(2022·山东·高考真题)实验室制备4KMnO 过程为:①高温下在熔融强碱性介质中用3KClO 氧化2MnO 制备24K MnO ;②水溶后冷却,调溶液pH 至弱碱性,24K MnO 歧化生成4KMnO 和2MnO ;③减压过滤,将滤液蒸发浓缩、冷却结晶,再减压过滤得4KMnO 。
下列说法正确的是A .①中用瓷坩埚作反应器B .①中用NaOH 作强碱性介质C .②中24K MnO 只体现氧化性D .2MnO 转化为4KMnO 的理论转化率约为66.7%2.(2022·湖南·高考真题)铝电解厂烟气净化的一种简单流程如下:下列说法错误的是A .不宜用陶瓷作吸收塔内衬材料B .采用溶液喷淋法可提高吸收塔内烟气吸收效率C .合成槽中产物主要有36Na AlF 和2CO D .滤液可回收进入吸收塔循环利用3.(2022·浙江·统考高考真题)关于化合物()3FeO OCH 的性质,下列推测不合理的是A .与稀盐酸反应生成3FeCl 、3CH OH 、2H OB .隔绝空气加热分解生成FeO 、2CO 、2H OC .溶于氢碘酸(HI),再加4CCl 萃取,有机层呈紫红色D .在空气中,与2SiO 高温反应能生成()233Fe SiO4.(2022·浙江·统考高考真题)下列说法不正确的是A .晶体硅的导电性介于导体和绝缘体之间,常用于制造光导纤维B .高压钠灯发出的黄光透雾能力强、射程远,可用于道路照明C .氧化铝熔点高,常用于制造耐高温材料D .用石灰石-石膏法对燃煤烟气进行脱硫,同时可得到石膏5.(2022·浙江·统考高考真题)尖晶石矿的主要成分为24MgAl O (含2SiO 杂质)。
已知:4222230MgAl O (s)+4Cl (g)=MgCl (s)l (g)+2O (A g) 2+l ΔH>C 。
个人资料整理,仅供个人学习使用2018年高考化学真题分类汇编专题5物质结构元素周期律(必修2)I —原子结构1. [2018江苏卷-8]短周期主族元素X、Y、Z、W原子序数依次增大,X是地壳中含量最多的元素,Y原子的最外层只有一个电子,Z位于元素周期表川A族,W与X属于同一主族。
下列说法正确的是矚慫润厲钐瘗睞枥庑赖。
矚慫润厲钐瘗睞枥庑赖賃。
A. 原子半径:r(W) > r(Z) > r(Y)B•由X、Y组成的化合物中均不含共价键C. Y的最高价氧化物的水化物的碱性比Z的弱D. X的简单气态氢化物的热稳定性比W的强【答案】D【解析】短周期主族元素X、Y、Z、W原子序数依次增大;X是地壳中含量最多的元素O,;Y原子的最外层只有一个电子,Y为Na;Z位于元素周期表中IIIA族,Z为Al; W与X属于同一主族,W为S。
聞創沟燴鐺險爱氇谴净。
聞創沟燴鐺險爱氇谴净祸。
A项,Na、Al、S都是第三周期元素,根据同周期从左到右主族元素的原子半径依次减小,原子半径:r (Y) r (Z) r (W), A错误;B项,由X、Y组成的化合物有Na2O、Na2O2, Na2O中只有离子键,Na2O2中既含离子键又含共价键,B错误;C项,金属性:Na (Y) > Al (Z) , Y的最高价氧化物的水化物的碱性比Z的强,C错误;D项,非金属性:O ( X) S( W), X的简单气态氢化物的热稳定性比W的强,D正确;残骛楼諍锩瀨濟溆塹籟。
残骛楼諍锩瀨濟溆塹籟婭。
【考点】元素周期表和元素周期律;化学键;金属性、非金属性的比较;2. [2018江苏卷-2]用化学用语表示NH3+ HCI=NH4CI中的相关微粒,其中正确的是A. 中子数为8的氮原子:87NB. HCl的电子式:卅C. NH3的结构式:]—门D. Cl-的结构示意图:[::【答案】C【解析】A.中子数为8的氮原子的质量数为15,表示为157N, A错误;B.HCI中只含共价■ *E-T键,HCI的电子式为H:「,B错误;C.NH3中含3个N-H键,NH3的结构式为C正确;D项,Cl-最外层有8个电子,D错误;答案选Co酽锕极額閉镇桧猪訣锥。
酽锕极額閉镇桧猪訣锥顧。
【考点】原子结构、离子结构示意图、电子式和结构式。
3. [2018全国卷U -10]W、X、Y和Z为原子序数依次增大的四种短周期元素。
W 与X可生成一种红棕色有刺激性气味的气体;丫的周期数是族序数的3倍;Z原子最外层的电子数与W的电子总数相同。
下列叙述正确的是彈贸摄尔霁毙攬砖卤庑诒。
A. X与其他三种元素均可形成两种或两种以上的二元化合物B. 丫与其他三种元素分别形成的化合物中只含有离子键C. 四种元素的简单离子具有相同的电子层结构D. W的氧化物对应的水化物均为强酸个人资料整理,仅供个人学习使用【答案】A【解析】W 、X 、丫和Z 为原子序数依次增大的四种短周期元素。
W 与X 可生成 一种红棕色有刺激性气味的气体, W 是N , X 是0; 丫的周期数是族序数的3 倍,因此丫只能是第三周期,所以丫是Na ; Z 原子最外层的电子数与 W 的电子 总数相同,Z 的最外层电子数是7个,Z 是Cl 。
A. X (0与其他三种元素(N 、Na 、 Cl )可形成(NO 、N02;Na2O Na202;CI2O CI2O3 CI2O5等二元化合物),A 正 确;B. Y (Na 与其他三种元素(N 、0、CI )形成的化合物中Na2O2含有离子键与共价键,B 错误; C.四种元素的简单离子,N3—、02—、Na+的电子层 结构相同,而C —的电子层结构与它们不相同,C 错误。
D. W (CI 的氧化物(CI2O CI203 CI2O5对应的水化物(HCIO HCI02 HCIO4等)HCIO 为弱酸,D 错误謀荞 抟箧飆鐸怼类蒋薔。
謀荞抟箧飆鐸怼类蒋薔點。
【考点】元素周期表和元素周期律;N02的物理性质(红棕色);原子结构;化 学键。
4. [2018北京卷-7]下列我国科技成果所涉及物质的应用中,发生的不是化学变化 的是【答案】B 【解析】A.甲醇低温所制氢气”说明氢气是新生成的物质,而化学变化最主要 的特点是有新物质生成,故 A 发生的是化学变化; B.氘、氚用作 人造太阳” 核聚变燃料” 核聚变”是核反应,改变的是原子核,不属于化学变化;C 偏二甲肼用作发射天宫二号”的火箭燃料,发生的反应为:(CH3)2NNH2+2N2O4=3N2+2CO2+4H2属于化学变化; D.可燃冰是甲烷的结构水合物, 甲烷燃烧,属于化学变化。
厦礴恳蹒骈時盡继價骚。
厦礴恳蹒骈時盡继價骚卺。
【考点】化学变化;核聚变;火箭燃料的燃烧反应;可燃冰。
n —元素周期表和元素周期律5. [2018江苏卷-8]短周期主族元素 X 、Y 、Z 、W 原子序数依次增大,X 是地壳中含量最多 的元素,Y 原子的最外层只有一个电子, Z 位于元素周期表川A 族,W 与X 属于同一主族。
A .甲醇低温所制氢气用于新能源汽车 B.氘、氚用作人造太 阳”核聚变燃料 C .偏二甲肼用作发射 天宫二号”的火箭燃 料 D .开采可燃 冰,将其作为 能源使用个人资料整理,仅供个人学习使用2 / 9个人资料整理,仅供个人学习使用下列说法正确的是茕桢广鳓鯡选块网羈泪。
茕桢广鳓鯡选块网羈泪镀。
A. 原子半径:r(W) > r(Z) > r(Y)B •由X 、Y 组成的化合物中均不含共价键C. Y 的最高价氧化物的水化物的碱性比Z 的弱 D. X 的简单气态氢化物的热稳定性比 W 的强 【答案】D【解析】短周期主族元素 X 、Y 、Z 、W 原子序数依次增大;X 是地壳中含量最多的元素 0,; Y 原子的最外层只有一个电子, Y 为Na ; Z 位于元素周期表中IIIA 族,Z 为Al ; W 与X 属于 同一主族, W 为S 。
鹅娅尽損鹌惨歷茏鴛賴。
鹅娅尽損鹌惨歷茏鴛賴縈。
A 项,Na 、Al 、S 都是第三周期元素,根据同周期从左到右主族元素的原子半径依次 减小,原子半径:r ( Y ) r (Z ) r ( W ),A 错误;B 项,由X 、Y 组成的化合物有 Na20、 Na2O2,Na20中只有离子键,Na2O2中既含离子键又含共价键,B 错误;C 项,金属性: Na ( Y ) > Al (Z ),Y 的最高价氧化物的水化物的碱性比Z 的强,C 错误;D 项,非金属性: 0( X ) S( W ),X 的简单气态氢化物的热稳定性比W 的强,D 正确;籟丛妈羥为贍债蛏练淨。
籟丛妈羥为贍债蛏练淨槠。
【考点】元素周期表和元素周期律;化学键;金属性、非金属性的比较;6. [2018天津卷-2]下列有关物质性质的比较,结论正确的是A. 溶解度:Na2CO3<NaHCO3B.热稳定性:HCKPH3C.沸点:C2H5SH<C2H5OHD.碱性:LiOH<Be(OH)2【答案】C【解析】A .碳酸钠的溶解度大于碳酸氢钠,选项A 错误。
B.同周期由左向右非金属的气 态氢化物的稳定性逐渐增强,所以稳定性应该是:HCI> PH3。
选项B 错误。
C . C2H5OH 分 子中有羟基,可以形成分子间的氢键,从而提高物质的沸点。
选项C 正确。
D .同周期由 左向右最高价氧化物的水化物的碱性逐渐减弱,所以碱性应该是:LiOH > Be(OH)2。
选项D 错误。
預頌圣鉉儐歲龈讶骅籴。
預頌圣鉉儐歲龈讶骅籴買。
【考点】碳酸钠及碳酸氢钠的溶解度;气态氢化物的稳定性;氢键及氢键对物质沸点的影 响;碱的碱性强弱比较。
C. W 的非金属性比Z 的强,所以 W 氢化物的沸点比Z 的高D. Z 的最低价单核阴离子的失电子能力比Y 的强【答案】C 【解析】四种短周期元素 X 、Y 、Z 和W 在周期表中的位置如图所示,原子序数之和为48。
设X 的原子序数为x ,则Y 、Z 和W 的原子序数分别为 x+1、x+9、x+10,则x+(x+1)+(x+9)+(x+10)=48解得 x=7,故知 X(N)、Y(O)、Z(S)和 W(Cl)。
所以,A.原子半径(r) 大小比较r(X) > r(Y);正确; B.X 和W 可形成共价化合物 XW3(NCI3); B 正确; C.W 的非 金属性比Z 的强,但非金属性的强弱与氢化物的沸点没必然联系; C 错误;D.Z 的最低价 单核阴离子(S2-)的失电子能力比 Y(O2-)的强;D 正确渗釤呛俨匀谔鱉调硯錦。
渗釤呛俨匀谔鱉调硯錦 鋇。
【考点】原子半径大小比较;共价化合物的概念;非金属性强弱比较;阴离子的还原性比较。
7. [2018浙江卷-12]四种短周期元素 X 、Y 、 数之和为48。
下列说法不正确的是A. 原子半径(r)大小比较r(X)> r(Y)B. X 和W 可形成共价化合物 XW3 Z 和W 在周期表中的位置如图所示,原子序个人资料整理,仅供个人学习使用8. [2018全国卷I -12]主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W、X、Z最外层电子数之和为10;W与Y同族;W与Z形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃。
下列说法正确的是铙誅卧泻噦圣骋贶頂廡。
铙誅卧泻噦圣骋贶頂廡缝。
A. 常温常压下X 的单质为气态B. Z 的氢化物为离子化合物C. Y 和Z 形成的化合物水溶液呈碱性D. W 与Y 具有相同的最高化合价【答案】B【解析】主族元素W、X、Y、Z的原子序数依次增加,且均不大于20。
W与Z 形成的化合物可与浓硫酸反应,其生成物可腐蚀玻璃,故生成物是HF,因此W 是F,Z是Ca, W与Y同族,贝U Y是C l。
W、X、Z的最外层电子数之和为10, 则X的最外层电子数为10—7- 2= 1,所以X是Na。
根据以上分析可知W、X、Y、Z分别是F、Na、Cl、C Q擁締凤袜备訊顎轮烂蔷。
擁締凤袜备訊顎轮烂蔷報。
则:A.金属钠常温常压下是固态而非气态,A错误; B.CaH2中含有离子键,属于离子化合物,B正确; C.Y与Z形成的化合物是氯化钠,其水溶液显中性而非碱性,C错误;D.F是最活泼的非金属,没有正价,Cl元素的最高价是+7 价,D 错误。
答案选B。
贓熱俣阃歲匱阊邺镓騷。
贓熱俣阃歲匱阊邺镓騷鯛。
【考点】原子结构、元素周期律、元素周期表;氢氟酸、二氧化硅(玻璃)的性质;CaF2与浓硫酸反应制HF ;盐溶液的酸碱性;氢化物、离子化合物的概念。
其中氟化钙与浓硫酸反应属于学生不熟悉的知识点。
坛摶乡囂忏蒌鍥铃氈淚。
坛摶乡囂忏蒌鍥铃氈淚跻。
9. [2018全国卷川-13]W、X、Y、Z均为短周期元素且原子序数依次增大,元素X 和Z同族。