第五章分子发光分析法
- 格式:ppt
- 大小:1.25 MB
- 文档页数:19


第5章分子发光—荧光、磷光和化学发光法(Molecular Emisssion and Luminescence)(3学时)教学目的和要求:1.学会分子发光——荧光、磷光和化学发光原理。
2.了解分子发光——荧光、磷光和化学发光法的特点和应用。
教学要点和所涵盖的知识点:荧光、磷光和化学发光原理、仪器、分析方法及应用重点和难点:荧光的原理、仪器、分析方法及应用。
分子发光:处于基态的分子吸收能量(电、热、化学和光能等)被激发至激发态,然后从不稳定的激发态返回至基态并发射出光子,此种现象称为发光。
发光分析包括荧光、磷光、化学发光、生物发光等。
物质吸收光能后所产生的光辐射称之为荧光和磷光。
第一节荧光分析法一、概述分子荧光分析法是根据物质的分子荧光光谱进行定性,以荧光强度进行定量的一种分析方法。
荧光分析的特点:灵敏度高:视不同物质,检测下限在0.1~0.001μg/mL之间。
可见比UV-Vis 的灵敏度高得多。
选择性好:可同时用激发光谱和荧光发射光谱定性。
结构信息量多:包括物质激发光谱、发射光谱、光强、荧光量子效率、荧光寿命等。
应用不广泛:主要是因为能发荧光的物质不具普遍性、增强荧光的方法有限、外界环境对荧光量子效率影响大、干扰测量的因素较多。
二、基本原理1、分子荧光的产生处于分子基态单重态中的电子对,其自旋方向相反,当其中一个电子被激发时,通常跃迁至第一激发态单重态轨道上,也可能跃迁至能级更高的单重态上。
这种跃迁是符合光谱选律的,如果跃迁至第一激发三重态轨道上,则属于禁阻跃迁。
单重态与三重态的区别在于电子自旋方向不同,激发三重态具有较低能级。
在单重激发态中,两个电子平行自旋,单重态分子具有抗磁性,其激发态的平均寿命大约为10-8s;而三重态分子具有顺磁性,其激发态的平均寿命为10-4~1s以上(通常用S和T分别表示单重态和三重态)。
处于激发态的电子,通常以辐射跃迁方式或无辐射跃迁方式再回到基态。
辐射跃迁主要涉及到荧光、延迟荧光或磷光的发射;无辐射跃迁则是指以热的形式辐射其多余的能量,包括振动弛豫( VR)、内部转移(IR)、系间窜跃(IX)及外部转移(EC)等,各种跃迁方式发生的可能性及程度,与荧光物质本身的结构及激发时的物理和化学环境等因素有关。


01. 溶液有颜色是因为它吸收了可见光中特定波长范围的光。
若某溶液呈蓝色,它吸收的是什么颜色的光?若溶液无色透明,是否表示它不吸收光?答:溶液呈蓝色,表明其吸收了蓝光的互补光,即黄光(若答是吸收了黄光外的所有可见光,不能说错,但是这样的情况过于巧合,少见!)。
若溶液无色透明,仅能说明其不吸收可见波段的光。
2. 分别在己烷和水中测定某化合物UV-Vis 光谱,发现该化合物的某个吸收峰由285 nm (己烷)蓝移至275 nm (水),(1)判断产生该吸收峰的跃迁类型;(2)试估算该化合物与水生成氢键的强度。
答:(1)溶剂极性增大,λmax 蓝移,表明该吸收峰是由n →π*跃迁产生的。
(2)()()⎪⎪⎭⎫⎝⎛λ-λ⋅⋅=己烷氢键max O H max A 11hc N E 2 ⎪⎭⎫ ⎝⎛⨯⨯⨯⨯⨯⨯⨯⨯=--99834-23102851-102751100.31063.61002.61mol J 28.15-⋅=3. 按从小到大顺序对下列化合物的λmax 排序,并简单说明理由(不要想得太复杂)A. NO 2B. NO 2t-C 4H 9t-C 4H 9 C.NO 2CH 3 D. NO 2C 2H 5答:B<D<C<A (空间位阻依次减小,共轭程度依次增加,λmax 红移)4. 某化合物分子式为C 10H 16,用其他仪器方法已经证明有双键和异丙基存在,其紫外光谱λmax =230 nm (ε=9000),1mol 该化合物只能吸收2 mol H 2,加氢后得到1-甲基-4异丙基环己烷,试确定该化合物的可能结构。
答: 1mol 该化合物只能吸收2 mol H 2,且其紫外光谱λmax =230 nm (ε=9000)可知该化合物含两个共轭但非同环双键(同环共轭双键基值为253 nm );该化合物含异丙基(双键不会出现在异丙基上),根据加氢后产物结构可推出该化合物可能结构如下:根据Woodward 规则可计算出该化合物的λmax =214+5(环外双键)+5⨯2(烷基取代)=229 nm ,与所测值相符。

分子发光分析法与分子吸收分光光度
分子发光分析法和分子吸收分光光度法(MMS)是物理化学中测定物质含量和生物物质含
量的两种常用方法。
它们之间有共同点和不同之处,本文主要就这二者的原理和方法进行
介绍。
分子发光分析法(MALS)是用物质中的激发态分子把紫外线能量转换为可见光,用以表征
物质的测定方法。
该方法工作原理为紫外线照射激发态分子,激发态分子把紫外线能量转
变为可见光,然后通过光电器件检测发出的可见光,最终得出物质的测定结果。
MALS技术的优点在于检测结果准确,具有快速性,还可以检测生物样本中物质含量。
而分子吸收分光光度(MMS)是通过测量物质吸收入射光的程度,来表征物质的检测方法。
这种技术工作原理是将光源照射在样本上,样本中的物质会吸收一部分入射的紫外线,而
剩下的光经过反射和透射而到达检测器,最终通过计算获得物质的测定数值。
比较MMS和MALS,MMS技术具有更高的灵敏度,可以进行更细小物质的检测,而且不受多种物质的干扰,也可以检测生物样本中的物质含量。
总之,MALS和MMS都是通过激发态分子转换紫外线能量为可见光,然后通过光电器件检测可见光,来判断物质的含量的两种常用技术,它们的优点和特点主要是MALS检测结果准确,具有快速性,而MMS则具有更高的灵敏度,可以进行更细小物质的检测,也可以检测
生物样本中的物质含量。

第五章 分子发光分析法: 基态分子吸收了一定能量后,跃迁至激发态,当激发态分子以辐射跃迁形式将其能量释放返回基态时,便产生分子发光。
第一节 荧光分析法一、概 述 :分子荧光分析法是根据物质的分子荧光光谱进行定性,以荧光强度进行定量的一种分析方法。
与分光光度法相比,荧光分析法的最大优点是灵敏度高和选择性高。
二、荧光产生的基本原理(一)分子荧光的产生(二)荧光效率及其影响因素1.荧光效率2.荧光与分子结构的关系(1)产生荧光的条件①必须含有共轭双键这样的强吸收基团,并且体系越大, 电子的离域性越强,越容易被激发产生荧光;大部分荧光物质都含有一个以上的芳香环,且随共轭芳环的增大,荧光效率越高,荧光波长越长。
②分子的刚性平面结构有利于荧光的产生③.取代基对荧光物质的荧光特征和强度的影响 给电子基团:-OH 、-NH2、-NR2和-OR 等可使共轭体系增大,导致荧光增强。
吸电子基团:-COOH 、-NO 和-NO2等使荧光减弱。
随着卤素取代基中卤原子序数的增加,使系间窜跃加强,物质的荧光减弱,而磷光增强。
3.环境因素对荧光强度的影响(1)溶剂极性对荧光强度的影响: 一般来说,电子激发态比基态具有更大的极性。
溶剂的极性增强,对激发态会产生更大的稳定作用,结果使物质的荧光波长红移,荧光强度增大. 奎宁在苯、乙醇和水中荧光效率的相对大小为1、30和1000。
(2)温度荧光强度的影响: 一般情况下,辐射跃迁的速率基本不随温度而改变,而非辐射跃迁的速率随温度升高而显著增大。
对大多数的荧光物质而言,升高温度会使非辐射跃迁概率增大,荧光效率降低。
由于三重态的寿命比单重激发态寿命更长,温度对于磷光的影响比荧光更大。
(3)pH 对荧光强度的影响:共轭酸碱两种体型具有不同的电子氛围,往往表现为具有不同荧光性质的两种体型,各具有自己特殊的荧光效率和荧光波长。
另外,溶液中表面活性剂的存在,可以使荧光物质处于更有序的胶束微环境中,对处于激发单重态的荧光物质分子起保护作用,减小非辐射跃迁的概率,提高荧光效率。

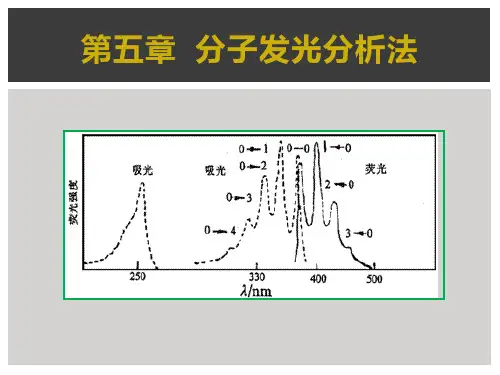

分子发光分析法基态分子吸收了一定能量后,跃迁至激发态,当激发态分子以辐射跃迁形式将其能量释放返回基态时,便产生分子发光(Molecular Luminescence)。
依据激发的模式不同,分子发光分为光致发光、热致发光、场致发光和化学发光等。
光致发光按激发态的类型又可分为荧光和磷光两种。
本章讨论分子荧光(Molecular Fluorescence)、分子磷光(Molecular Phosphorescence)和化学发光(Chemiluminescence)分析法。
第一节荧光分析法一、概述分子荧光分析法是根据物质的分子荧光光谱进行定性,以荧光强度进行定量的一种分析方法。
早在16世纪,人们观察到当紫外和可见光照射到某些物质时。
这些物质就会发出各种颜色和不同强度的光,而当照射停止时,物质的发光也随之很快消失。
到1852年才由斯托克斯(Stokes)给予了解释,即它是物质在吸收了光能后发射出的分子荧光。
斯托克斯在对荧光强度与浓度之间的关系进行研究的基础上,于1864年提出可将荧光作为一种分析手段。
1867年Goppelsroder应用铝—桑色素络合物的荧光对铝进行了测定。
进入20世纪,随着荧光分析仪器的问世,荧光分析的方法和技术得到了极大发展,如今已成为一种重要且有效的光谱分析手段。
荧光分析法的最大优点是灵敏度高,它的检出限通常比分光光度法低2~4个数量级,选择性也较分光光度法好。
虽然能产生强荧光的化合物相对较少,荧光分析法的应用不如分光光度法广泛,但由于它的高灵敏度以及许多重要的生物物质都具有荧光性质。
使得该方法在药物、临床、环境、食品的微量、痕量分析以及生命科学研究各个领域具有重要意义。
二、基本原理(一)分子荧光的产生大多数分子含有偶数电子。
根据保里不相容原理,基态分子的每一个轨道中两个电子的自旋方向总是相反的,因而大多数基态分子处于单重态(2S+1=1),基态单重态以S0表示。
当物质受光照射时,基态分子吸收光能就会产生电子能级跃迁而处于第一、第二电子激发单重态,以S1、S2表示。
