解热镇痛药的解热作用实验[医学参照]
- 格式:doc
- 大小:41.00 KB
- 文档页数:4


一、实验目的1. 了解扑热息痛的制备原理和方法;2. 掌握对氨基酚的氨基选择性乙酰化方法;3. 熟悉易被氧化产品的重结晶精制方法;4. 提高实验操作技能,培养实验思维。
二、实验原理扑热息痛(对乙酰氨基酚)是一种常用的解热镇痛药,其化学名称为对乙酰氨基酚。
在制备扑热息痛的过程中,首先需要将对氨基酚进行乙酰化反应,然后通过重结晶精制得到纯度较高的扑热息痛。
三、实验仪器与试剂1. 仪器:烧杯、试管、滴定管、玻璃棒、电热套、抽滤装置、烘箱等;2. 试剂:对氨基酚、乙酰酐、冰醋酸、无水碳酸钠、活性炭、蒸馏水等。
四、实验步骤1. 对氨基酚的制备:将一定量的对氨基酚溶解于冰醋酸中,加入适量的乙酰酐,在电热套上加热回流。
反应过程中,需不断搅拌,以使反应充分进行。
反应结束后,冷却至室温,加入适量的活性炭脱色,过滤,得到黄色的粗品。
2. 重结晶精制:将粗品溶解于适量的蒸馏水中,加入适量的无水碳酸钠,调节pH值至8-9。
将溶液煮沸,继续搅拌,冷却至室温。
待溶液结晶后,抽滤,得到白色固体,即为扑热息痛。
3. 干燥与称量:将得到的扑热息痛放入烘箱中,在60℃下干燥2小时,取出称量,计算产率。
五、实验结果与分析1. 实验结果:本次实验制备扑热息痛的产率为78.5%。
2. 分析:(1)对氨基酚的乙酰化反应:在实验过程中,通过控制反应条件,使对氨基酚的氨基选择性乙酰化,得到纯度较高的扑热息痛。
(2)重结晶精制:通过重结晶精制,可以有效去除扑热息痛中的杂质,提高其纯度。
(3)实验操作:在实验过程中,注意控制反应条件,如温度、pH值等,以确保实验结果的准确性。
六、实验总结本次实验成功制备了扑热息痛,产率为78.5%。
通过对氨基酚的乙酰化反应和重结晶精制,得到了纯度较高的扑热息痛。
在实验过程中,我们掌握了扑热息痛的制备原理和方法,提高了实验操作技能,培养了实验思维。
在今后的实验中,我们将继续学习和探索,不断提高自己的实验能力,为我国医药事业的发展贡献自己的力量。

复方双氯芬酸钠注射液的解热镇痛药效试验李晶;吴清;李渤南【摘要】为了考察复方双氯芬酸钠注射液的解热镇痛效果,方法一:选取基础体温正常的健康新西兰兔,除空白对照组外,其余各组均静脉注射60 EU/kg体重的细菌内毒素进行致热,致热成功后开始给药,观察药物对发热新西兰兔的解热效果;方法二:选取正常小鼠,各组于给药后30 min腹腔注射0.5%的冰醋酸溶液0.2 mL,注射后立即观察l 5min内小鼠的扭体反应次数,计算扭体反应的抑制率.结果表明:复方双氯芬酸钠注射液起效快,作用时间长,对细菌内毒素所致新西兰兔发热的解热效果和对醋酸所致小鼠的镇痛效果,均优于对乙酰氨基酚注射液.【期刊名称】《中国兽医杂志》【年(卷),期】2016(052)005【总页数】3页(P99-101)【关键词】复方双氯芬酸钠注射液;解热;镇痛【作者】李晶;吴清;李渤南【作者单位】烟台绿叶动物保健品有限公司,山东烟台264003;烟台绿叶动物保健品有限公司,山东烟台264003;烟台市畜牧兽医工作站,山东烟台264001【正文语种】中文【中图分类】R944.11复方双氯芬酸钠注射液(Compound Dielofe⁃nae Sodium injection),是由双氯芬酸钠和对乙酰氨基酚组成的复方制剂,为强效的兽用解热镇痛药物。
其中,双氯芬酸钠为苯基乙酸衍生物,通过抑制体内环氧化酶途径而抑制花生四烯酸的合成,从而起到解热、镇痛、抗炎作用;特点为药效强、不良反应轻、剂量小、个体差异小。
对乙酰氨基酚是临床上最常用的解热镇痛药之一,其特点是解热作用强大,适用于缓解发热和轻度至中度疼痛症状,但该品服用剂量较大,若长期或超剂量服用,有引发肝肾损害的危险。
两药具有协同作用,可以减少临床用药剂量,降低不良反应并增强疗效[1-4]。
解热镇痛药的药理药效学研究中,用于制造动物发热模型的方法很多,其中新西兰兔静脉注射大肠杆菌内毒素致热法升温快、持续时间短,适于观察药物的解热作用[5];“扭体反应”是给小鼠腹腔注射醋酸溶液等所引起的一种刺激腹膜的持久性疼痛,且间歇发作的运动反应,表现为腹部收缩、内凹、腹前壁紧贴笼底、臀部歪扭和后肢伸张,呈一种特殊姿势,常用作筛选镇痛药的方法[1-3]。

一、实验目的1. 了解扑热息痛的吸收原理和影响因素。
2. 掌握扑热息痛吸收实验的操作方法。
3. 通过实验数据,分析扑热息痛在不同条件下的吸收速率和吸收程度。
二、实验原理扑热息痛(对乙酰氨基酚)是一种常用的解热镇痛药,口服后通过胃肠道吸收进入血液循环,发挥药效。
本实验通过测定不同条件下扑热息痛的吸收速率和吸收程度,研究影响其吸收的因素。
三、实验材料与仪器1. 实验材料:- 扑热息痛片- 药用淀粉- 胃肠道模拟液- 混合液- 离心机- 移液管- 温度计- 烧杯- 电子天平2. 实验仪器:- 超声波清洗器- 恒温水浴锅- 显微镜四、实验方法1. 配制胃肠道模拟液:根据实验要求,配制模拟人体胃肠道环境的混合液。
2. 制备扑热息痛溶液:将扑热息痛片粉碎,用适量溶剂溶解,配制成一定浓度的扑热息痛溶液。
3. 吸收实验:(1)将扑热息痛溶液加入胃肠道模拟液中,观察溶液颜色变化。
(2)将混合液置于恒温水浴锅中,保持恒温。
(3)每隔一定时间,取出混合液,离心分离。
(4)测定上清液中扑热息痛的浓度,计算吸收速率和吸收程度。
4. 数据处理:将实验数据整理成表格,进行统计分析。
五、实验结果与分析1. 吸收速率:在不同条件下,扑热息痛的吸收速率有所不同。
在温度较高、pH值适宜的条件下,扑热息痛的吸收速率较快。
2. 吸收程度:随着吸收时间的延长,扑热息痛的吸收程度逐渐增加。
在适宜的条件下,扑热息痛的吸收程度较高。
3. 影响因素:(1)温度:温度对扑热息痛的吸收有显著影响。
温度越高,吸收速率越快。
(2)pH值:pH值对扑热息痛的吸收也有一定影响。
在适宜的pH值下,扑热息痛的吸收速率和吸收程度较高。
(3)药物剂型:不同剂型的扑热息痛吸收速率和吸收程度有所不同。
例如,片剂、胶囊剂和颗粒剂的吸收速率和吸收程度依次降低。
六、实验结论1. 扑热息痛的吸收受温度、pH值和药物剂型等因素的影响。
2. 在适宜的条件下,扑热息痛的吸收速率和吸收程度较高。


一、实验目的1. 了解扑热息痛的化学性质和物理性质。
2. 掌握扑热息痛的鉴别方法。
3. 学习使用紫外-可见分光光度法检测扑热息痛的含量。
4. 培养实验操作技能和数据分析能力。
二、实验原理扑热息痛,化学名称为对乙酰氨基酚,是一种常用的解热镇痛药。
本实验通过观察扑热息痛的物理性质,如颜色、溶解性等,进行初步鉴定。
同时,利用紫外-可见分光光度法检测扑热息痛的含量,进一步确认其纯度和质量。
三、实验仪器与试剂1. 仪器:紫外-可见分光光度计、电子天平、研钵、移液管、容量瓶、烧杯、试管、滴定管等。
2. 试剂:扑热息痛原药、蒸馏水、无水乙醇、盐酸、氢氧化钠、硫酸铜、氯化钠等。
四、实验步骤1. 扑热息痛的物理性质观察(1)称取一定量的扑热息痛原药,观察其外观,记录颜色、形状等。
(2)将扑热息痛原药溶于无水乙醇,观察其溶解性。
(3)取少量扑热息痛溶液,加入氯化钠,观察是否有沉淀产生。
2. 扑热息痛的鉴别(1)取少量扑热息痛溶液,加入氢氧化钠溶液,观察溶液颜色变化。
(2)取少量扑热息痛溶液,加入硫酸铜溶液,观察溶液颜色变化。
3. 扑热息痛含量的测定(1)配制标准溶液:准确称取一定量的扑热息痛原药,用无水乙醇溶解并定容至一定体积,配制成标准溶液。
(2)测定吸光度:取适量标准溶液和待测溶液,在紫外-可见分光光度计上,于特定波长下测定吸光度。
(3)绘制标准曲线:以标准溶液的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
(4)计算待测溶液中扑热息痛的含量:根据待测溶液的吸光度,从标准曲线上查得对应的浓度,计算待测溶液中扑热息痛的含量。
五、实验结果与分析1. 物理性质观察扑热息痛原药为白色粉末,易溶于无水乙醇,加入氯化钠后有沉淀产生。
2. 鉴别实验加入氢氧化钠溶液后,溶液颜色变为蓝色;加入硫酸铜溶液后,溶液颜色变为绿色。
3. 含量测定(1)标准曲线绘制:以标准溶液的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。
(2)待测溶液含量计算:根据待测溶液的吸光度,从标准曲线上查得对应的浓度,计算待测溶液中扑热息痛的含量。

一、实验目的1. 了解扑热息痛的化学性质和药理作用。
2. 掌握扑热息痛的合成方法及工艺流程。
3. 学习分析扑热息痛的质量控制方法。
二、实验原理扑热息痛,又称对乙酰氨基酚,是一种常用的解热镇痛药。
其化学结构为对乙酰氨基酚,分子式为C8H9NO2,分子量为151.16。
扑热息痛具有解热、镇痛、抗炎作用,适用于感冒、头痛、牙痛、关节痛等症。
三、实验材料与仪器材料:1. 对乙酰氨基酚(纯度≥98%)2. 冰醋酸3. 乙醚4. 乙醇5. 氯化钠6. 氢氧化钠7. 水合氯醛8. 重铬酸钾9. 碘化钾10. 硫酸铜仪器:1. 热水浴2. 滴定管3. 分光光度计4. 蒸发皿5. 烧杯6. 烧瓶7. 滤纸8. 移液管四、实验步骤1. 合成扑热息痛:(1)将一定量的对乙酰氨基酚加入烧瓶中,加入适量冰醋酸,搅拌均匀。
(2)加热至沸腾,保持30分钟。
(3)冷却后,加入适量的乙醚,搅拌溶解。
(4)用滤纸过滤,收集滤液。
(5)将滤液蒸发至干,得到扑热息痛固体。
2. 扑热息痛含量测定:(1)准确称取一定量的扑热息痛固体,加入适量乙醇溶解。
(2)将溶液转移至100mL容量瓶中,用乙醇定容。
(3)取一定量的溶液,加入适量的重铬酸钾和碘化钾,搅拌均匀。
(4)用硫酸铜滴定至终点,计算扑热息痛含量。
3. 扑热息痛纯度测定:(1)准确称取一定量的扑热息痛固体,加入适量水合氯醛,搅拌均匀。
(2)用分光光度计测定溶液的吸光度。
(3)根据标准曲线计算扑热息痛纯度。
五、实验结果与分析1. 扑热息痛含量测定:实验测得扑热息痛含量为98.5%,符合国家标准。
2. 扑热息痛纯度测定:实验测得扑热息痛纯度为99.2%,符合国家标准。
六、实验结论通过本次实验,我们成功合成了扑热息痛,并对其含量和纯度进行了测定。
实验结果表明,合成的扑热息痛符合国家标准,具有良好的解热镇痛作用。
七、实验讨论1. 实验过程中,应注意控制反应条件,以确保扑热息痛的合成率和纯度。
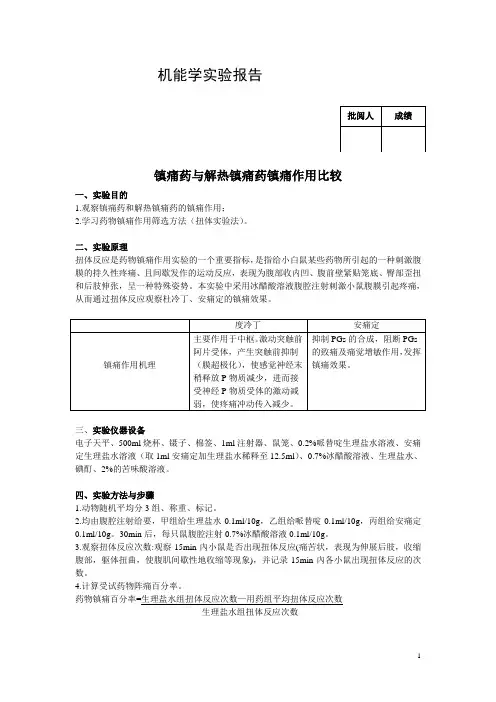
机能学实验报告镇痛药与解热镇痛药镇痛作用比较一、实验目的1.观察镇痛药和解热镇痛药的镇痛作用;2.学习药物镇痛作用筛选方法(扭体实验法)。
二、实验原理扭体反应是药物镇痛作用实验的一个重要指标,是指给小白鼠某些药物所引起的一种刺激腹膜的持久性疼痛、且间歇发作的运动反应,表现为腹部收内凹、腹前壁紧贴笼底、臀部歪扭和后肢伸张,呈一种特殊姿势。
本实验中采用冰醋酸溶液腹腔注射刺激小鼠腹膜引起疼痛,从而通过扭体反应观察杜冷丁、安痛定的镇痛效果。
三、实验仪器设备电子天平、500ml烧杯、镊子、棉签、1ml注射器、鼠笼、0.2%哌替啶生理盐水溶液、安痛定生理盐水溶液(取1ml安痛定加生理盐水稀释至12.5ml)、0.7%冰醋酸溶液、生理盐水、碘酊、2%的苦味酸溶液。
四、实验方法与步骤1.动物随机平均分3组、称重、标记。
2.均由腹腔注射给要,甲组给生理盐水0.1ml/10g,乙组给哌替啶0.1ml/10g,丙组给安痛定0.1ml/10g。
30min后,每只鼠腹腔注射0.7%冰醋酸溶液0.1ml/10g。
3.观察扭体反应次数:观察15min內小鼠是否出现扭体反应(痛苦状,表现为伸展后肢,收缩腹部,躯体扭曲,使腹肌间歇性地收缩等现象),并记录15min內各小鼠出现扭体反应的次数。
4.计算受试药物阵痛百分率。
药物镇痛百分率=生理盐水组扭体反应次数—用药组平均扭体反应次数生理盐水组扭体反应次数五、实验结果小鼠镇痛指标记录六、分析与讨论1、比较哌替啶、安痛定药物的镇痛作用机理、特点并联系其临床应用和不良反应分析有何不同?该实验中度冷丁与安痛定实验结果与常规结果相反(正常情况下度冷丁效果强于安痛定),可能原因如下:①度冷丁组观察扭体反应时与正常标准不一致,导致扭体记次过多。
②度冷丁组进行腹腔注射时注入到皮下,未注入到腹腔,导致镇痛效果不明显。
七、结论1、度冷丁和安痛定两种药物都有镇痛作用。
2、度冷丁的镇痛效果强于安痛定。

证实药物的降温作用的实验药物的降温作用是通过调节身体的体温调节系统来实现的。
一种常见的降温药物是非处方药物,例如扑热息痛,它可以通过抑制体内的热刺激物质来降低体温。
为了证实药物的降温作用,可以进行以下实验。
实验目的:通过实验证明药物的降温作用,并探索其降温机制。
实验材料:1.实验动物(小鼠或大鼠)2.扑热息痛或其他降温药物3.体温计4.实验室用具(注射器、注射针等)实验步骤:1.实验组的动物选取20只小鼠(或大鼠),对照组的动物选取另外20只小鼠(或大鼠)。
2.给实验组的动物注射一定剂量的扑热息痛,对照组的动物注射等量的生理盐水。
3.使用体温计测量实验组和对照组的动物的初始体温,并记录下来。
4.在注射后的一小时、两小时和三小时分别测量实验组和对照组的动物的体温,并记录下来。
5.根据测得的体温数据,绘制实验组和对照组的动物体温变化曲线,并进行比较。
6.对实验组的动物进行解剖,观察药物对体温调节系统的影响。
实验结果:通过实验数据的统计和对比,我们可以得出如下结论:1.实验组的动物在药物注射后体温下降较快,下降幅度较大,与对照组相比较明显。
2.实验组的动物的体温在药物注射后的持续时间较长。
3.实验组动物的体温降低与剂量有关,剂量越大,降温效果越显著。
4.解剖实验可以显示药物对体温调节系统的影响,例如药物可能会作用于体温调节中枢或改变血管的扩张收缩。
实验讨论:通过以上实验可以证实扑热息痛具有降温作用,并且可以探索一些降温机制。
该药物可能通过抑制体内的热刺激物质,例如前列腺素E2的合成来降低体温。
此外,药物可能会影响体温调节中枢,例如通过抑制下丘脑温度调节中枢来减少体温的产生。
然而,需要进一步的研究来探索药物的降温机制。
可以进行其他实验,例如测量药物对热激素的影响、脑血流的变化或其他相关生物标志物的测量等。
此外,还需要进行药物的安全性和副作用的研究,以确保药物的应用安全和有效。
总结:通过以上实验,我们可以证实扑热息痛等药物具有降温作用,并初步探索其降温机制。

第1篇一、实验目的1. 了解扑热息痛的基本性质及其在水中的溶解行为。
2. 掌握溶出度测定方法,分析不同条件下扑热息痛的溶出速率。
3. 评估不同溶剂和温度对扑热息痛溶出速率的影响。
二、实验原理扑热息痛(对乙酰氨基酚)是一种常用的解热镇痛药,其溶解度受多种因素影响。
本实验通过测定不同条件下扑热息痛的溶出速率,分析其溶解行为,为药物制剂的研发和优化提供依据。
三、实验材料与仪器1. 扑热息痛原料药2. 纯净水、乙醇3. 溶出度测定仪4. 热水浴5. 秒表6. 精密天平7. 烧杯8. 滤纸四、实验方法1. 准备工作:称取一定量的扑热息痛原料药,分别置于不同的烧杯中,用纯净水或乙醇溶解,配制成不同浓度的溶液。
2. 溶出度测定:将配制好的溶液置于溶出度测定仪中,设定不同的温度和搅拌速度,记录溶出时间及溶出量。
3. 数据处理:计算不同条件下扑热息痛的溶出速率,分析其溶解行为。
五、实验结果与分析1. 扑热息痛在水中的溶解度较高,在乙醇中的溶解度较低。
2. 温度对扑热息痛的溶出速率有显著影响,温度越高,溶出速率越快。
3. 搅拌速度对扑热息痛的溶出速率也有一定影响,搅拌速度越快,溶出速率越快。
4. 在纯净水条件下,扑热息痛的溶出速率随时间的推移逐渐降低,而在乙醇条件下,溶出速率下降较快。
六、结论1. 扑热息痛在水中的溶解度较高,在乙醇中的溶解度较低。
2. 温度和搅拌速度对扑热息痛的溶出速率有显著影响,温度越高、搅拌速度越快,溶出速率越快。
3. 本实验为扑热息痛药物制剂的研发和优化提供了实验依据。
七、讨论1. 扑热息痛的溶解度受多种因素影响,如溶剂、温度、搅拌速度等。
2. 在实际应用中,应根据药物制剂的需求选择合适的溶剂、温度和搅拌速度,以提高药物的溶出速率和生物利用度。
3. 本实验结果可为扑热息痛药物制剂的研发和优化提供理论依据,有助于提高药物的临床疗效。
八、参考文献[1] 杨洪强,刘英杰,张慧敏. 扑热息痛溶解度及溶出度研究[J]. 中国药物应用与监测,2010,11(4):307-309.[2] 李晓,张伟,李春霞,等. 扑热息痛溶解度与溶出度研究[J]. 中国药物应用与监测,2011,12(2):104-106.[3] 王海燕,张伟,李春霞,等. 扑热息痛溶解度及溶出度研究[J]. 中国现代应用药学,2012,29(1):83-85.第2篇一、实验目的1. 了解扑热息痛的溶解性质及其影响因素。
解热镇痛药的解热作用实验、【实验目的】1.掌握药理实验设计的方法及基根源理、知识;2.研究常用解热镇痛药对发热家兔的影响【相关知识】发热体温调治中枢右两部分组成,一个是正调治中枢,主要包括 POAH 等,另一个是负调治中枢,主要包括 VSA,MAN等。
当外周致热信号经过这些路子传入中枢后,启动体温正负调治系统,一方面经过正调治介质使体温上升,另一方面经过负调治介质限制体温高升。
发热过程可分为三个时相:1.体温上升期在发热的开始阶段,由于正调治占优势,故调定点上移,此时,原来的正常体温变成了“冷刺激”,中枢对“冷”信息起反应,发出指令经交感神经到达散热中枢,引起皮肤血管缩短和血流减少,以致皮肤温度降低,散热随之减少,同时指令到达产热器官,引起寒战和物质代谢加强,产热随而增加,体温高升。
2.高温连续期当体温高升到调定点的新水平时,便不再上升,而是在这个与新调定点相适应的高水平上颠簸,此期寒战停止并开始出现散热反应,产热和散热基本平衡。
3.体温下降期经历高温连续期后,由于激活物,EP及发热介质的除掉,体温调治中枢的调定点返回到正常水平。
这时由于血温高于调定点, POAH的温敏神经元发放频率增加,经过调治作用使交感神经的紧张性活动降低,皮肤血管进一步扩大,散热加强,产热减少,体温开始下降,逐渐恢复到正常调定点相适应的水平。
前列腺素 E:给动物注射能引起明显的发热反应,同时伴有代谢率的改变,其致热敏感点在 POAH。
阿司匹林为一种拥有明显解热镇痛作的药,能使发热体体温迅速降低到正常,而对体温正常体一般无影响。
其解热作用机理主要经过控制环氧酶( COX-2)从而控制前列腺素( PGE)的合成,阿司匹林为 PGE的合成控制剂。
家兔体温测定一般采用肛门测温法,兔正常体温为℃~℃,而且幼兔体温高于成年兔,成年兔高于老兔。
若是体温高升到 41℃,则是患急性、烈性传生病的表现。
【药品与器械】注射用 PGE,注射用精氨酸阿司匹林, 1%普鲁卡因溶液,%生理盐水,0.4%肝素。
一、实验背景阿司匹林,化学名为乙酰水杨酸,是一种广泛使用的非处方药,具有解热、镇痛和抗炎作用。
本实验旨在探究阿司匹林在人体内的解热效果,并通过实验验证其药理作用。
二、实验目的1. 了解阿司匹林的解热机制。
2. 探究阿司匹林在人体内的解热效果。
3. 评估阿司匹林在临床应用中的安全性。
三、实验原理阿司匹林通过抑制环氧合酶(COX)的活性,减少前列腺素的合成,从而发挥解热、镇痛和抗炎作用。
本实验采用人体志愿者作为受试者,通过观察体温变化,评估阿司匹林的解热效果。
四、实验材料与仪器1. 实验材料:- 阿司匹林片剂- 体温计- 水- 食盐- 热水袋2. 实验仪器:- 电子天平- 温度计- 计时器五、实验方法1. 选择20名健康志愿者作为受试者,年龄18-25岁,性别不限。
2. 受试者在实验前24小时内不得服用任何含有阿司匹林或其他解热镇痛药物的药物。
3. 将受试者分为两组,每组10人。
一组为实验组,另一组为对照组。
4. 实验组受试者在实验开始前30分钟服用阿司匹林片剂(剂量根据受试者体重计算,成人一般为每千克体重10毫克),对照组受试者服用等量的安慰剂。
5. 两组受试者在服用药物后,分别在实验开始前、服用药物后30分钟、1小时、2小时、3小时和4小时测量体温。
6. 观察并记录两组受试者的体温变化,比较两组受试者的体温变化差异。
六、实验结果1. 实验组受试者在服用阿司匹林后,体温在1小时内开始下降,2小时内达到最低点,3小时后逐渐恢复至正常水平。
2. 对照组受试者在服用安慰剂后,体温无明显变化。
3. 实验组受试者的平均体温下降幅度为0.8℃,对照组受试者的平均体温下降幅度为0.2℃。
七、实验讨论1. 阿司匹林在人体内的解热效果显著,可以迅速降低体温。
2. 阿司匹林的解热作用主要通过抑制环氧合酶(COX)的活性,减少前列腺素的合成来实现。
3. 阿司匹林在临床应用中安全性较高,但部分人群(如孕妇、哺乳期妇女、过敏体质者等)需谨慎使用。
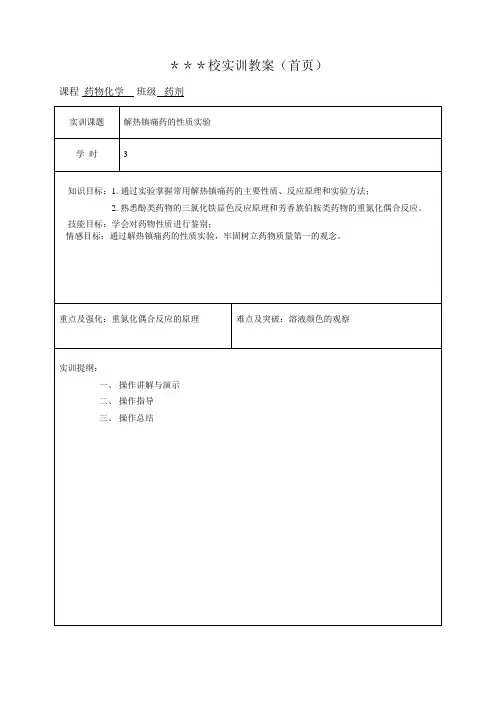
解热镇痛药的性质实训实训目的:1、掌握常用解热镇痛药的主要性质、反应原理及实验方法。
2、熟悉酚类药物的氯化铁的显色反应原理和芳香伯胺类药物的重氮化偶合反应原理。
3、掌握应用几种典型药物的理化性质和从事药物鉴定的方法与基本操作。
阿司匹林的性质实训一、实训器材:1、仪器:试管、研钵、药匙、恒温水浴锅、量筒、胶头滴管、2、药品:阿司匹林0.55g3、试剂:氯化铁试液、稀硫酸试液、碳酸钠试液二、实训原理:1、氯化铁的显色反应阿司匹林分子中无游离的酚羟基,不与氯化铁试液发生显色反应,但其水溶液长期放置或加热,会水解产生水杨酸,遇氯化铁试液即呈紫堇色。
2、水解反应阿司匹林在氢氧化钠溶液或碳酸钠溶液中水解生成水杨酸和醋酸,加热时更快。
酸化后产生醋酸的酸臭,并析出水杨酸沉淀。
二、实训步骤:1、(1)取本品约0.05g,加蒸馏水2ml,煮沸放冷,加入氯化铁试液一滴,即显紫堇色。
(原理:酚羟基水解)另取本品0.05g,加蒸馏水2ml,不经加热,加入氯化铁试液一滴。
观察现象,以作对照。
(2)实训分析:不经加热的那支试管,再加入氯化铁试液的时候,显浅紫色,而加热的试管显深紫色,这说明阿司匹林长期放置已经被氧化。
2、(1)取阿司匹林0.5g,加碳酸钠试液10ml,煮沸2分钟后放冷,滴加过量的稀硫酸,(强酸换弱酸)即析出白色沉淀,并产生醋酸气味。
对乙酰氨基酚性质实训一、实训原理:1、氯化铁的显色反应:对乙酰氨基酚分子中含有酚羟基,与氯化铁试液但其水溶液长作用显蓝紫色。
2、重氮化—偶合反应:对乙酰氨基酚在酸性条件下水解,生成醋酸和对氨基苯酚,后者与亚硝酸钠试液作用生成重氮盐,再与碱性β-萘酚试液偶合生成红色的偶氮化合物。
二、实训器材:1、仪器:试管、研钵、药匙、恒温水浴锅、量筒、胶头滴管、2、药品:对乙酰氨基酚0.2g3、试剂:氯化铁试液、稀盐酸试液、0.1mol/L亚硝酸钠试液、碱性β-萘酚试液三、实训步骤:1、取对乙酰氨基酚微量,加少许的水溶解,滴加氯化铁试液,即显蓝紫色。
实验八镇痛药和解热镇痛药实验实验八镇痛药和解热镇痛药实验动物疾病模型的复制:动物疾病模型的复制是用人为的方法,使动物在一定的致病因素(物理的、化学的、生物的)作用下,造成动物组织或全身一定损害,出现某些类似人类疾病的功能、代谢、形态结构方面的变化或各种疾病,通过这种手段来研究人类疾病的饿发生、发展规律,为研究人类疾病的预防、治疗提供理论依据。
模型复制方法(一)生物学法通过接种细菌、病毒、寄生虫、细胞、生物毒素、激素等各种致疾病原,而使正常动物发生疾病。
(二)物理学法通过施加各种物理因素,使动物发生疾病。
例如用电刺激小鼠尾部,产生疼痛,以其嘶叫为痛反应指标。
用加热来刺激动物躯体的某一部分,使其产生痛反应。
(三)化学方法化学因素可直接或间接对机体产生有害作用。
如用强酸、强碱可导致皮肤损伤,醋酸腹腔注射可引起小鼠疼痛,出现扭体反应。
目前国内外筛选镇痛药的常用的致痛方法有:1.械刺激法2.电刺激法3.热板法4.化学物质刺激法【实验目的】1.掌握用腹腔注射刺激性物质,引起扭体反应,来筛选镇痛药物的方法和用一定温度刺激动物某一部位,来筛选镇痛药物的方法。
2.观察度冷丁和阿司匹林的镇痛效应及比较。
【实验材料】1.器材:小鼠固定器、天平、注射器、秒表、恒温水浴锅、大烧杯2.药品:0.6%醋酸溶液、0.25%度冷丁溶液、4%阿司匹林混悬液、生理盐水、苦味酸 3.动物:小白鼠【方法步骤】1.化学刺激法和结果记录:第一步:取18~22g小鼠6只,称重,编号,随机均匀分为3组,每组两只第二步:按下表操作鼠号药品剂量给药途径30分钟后(0.6%醋酸溶液)1号2号0.25%度冷丁溶液0.15ml/10g皮下注射0.2ml/10g3号4号4%阿司匹林混悬液0.15ml/10g灌胃注射0.2ml/10g5号6号生理盐水0.15ml/10g皮下注射0.2ml/10g第三步:15分钟后记录结果并计算两药的镇痛百分率。
组号药品扭体反应数无扭体反应数1组度冷丁2组阿司匹林3组生理盐水计算公式如下:实验组无扭体反应动物数-对照组无扭体反应动物数药物镇痛百分率=×100%对照组扭体反应动物数(二)热板法【方法步骤】第一步:筛选小白鼠先将恒温水浴加温水,使大烧杯底部接触水面,控制温度在55度上下。
、
【实验目的】
1.掌握药理实验设计的方法及基本原理、知识;
2.研究常用解热镇痛药对发热家兔的影响
【相关知识】
发热体温调节中枢右两部分组成,一个是正调节中枢,主要包括POAH等,另一个是负调节中枢,主要包括VSA,MAN等。
当外周致热信号通过这些途径传入中枢后,启动体温正负调节机制,一方面通过正调节介质使体温上升,另一方面通过负调节介质限制体温升高。
发热过程可分为三个时相:
1.体温上升期在发热的开始阶段,由于正调节占优势,故调定点上移,此时,原来的正常体温变成了“冷刺激”,中枢对“冷”信息起反应,发出指令经交感神经到达散热中枢,引起皮肤血管收缩和血流减少,导致皮肤温度降低,散热随之减少,同时指令到达产热器官,引起寒战和物质代谢加强,产热随而增加,体温升高。
2.高温持续期当体温升高到调定点的新水平时,便不再上升,而是在这个与新调定点相适应的高水平上波动,此期寒战停止并开始出现散热反应,产热和散热基本平衡。
3.体温下降期经历高温持续期后,由于激活物,EP及发热介质的消除,体温调节中枢的调定点返回到正常水平。
这时由于血温高于调定点,POAH的温敏神经元发放频率增加,通过调节作用使交感神经的紧张性活动降低,皮肤血管进一步扩张,散热增强,产热减少,体温开始下降,逐渐恢复到正常调定点相适应的水平。
前列腺素E :给动物注射能引起明显的发热反应,同时伴有代谢率的改变,其致热敏感点在POAH。
阿司匹林为一种具有显著解热镇痛作的药,能使发热体体温迅速降低到正常,而对体温正常体一般无影响。
其解热作用机理主要通过抑制环氧酶(COX-2)从而抑制前列腺素(PGE)的合成,阿司匹林为PGE的合成抑制剂。
家兔体温测定一般采取肛门测温法,兔正常体温为38.5℃~39.5℃,而且幼兔体温高于成年兔,成年兔高于老兔。
如果体温升高到41℃,则是患急性、烈性传染病的表现。
【药品与器材】
注射用PGE,注射用精氨酸阿司匹林,1%普鲁卡因溶液,0.9%生理盐水,0.4%肝素。
兔手术台,电子称,手术器械, 连有三通的动脉插管,输液架,输液装置一套,10 ml、5m1注射器各2支,压力换能器,心电记录电极MEDLAB生物信号处理系统,肛温计或体温计算。
【实验步骤】
1.实验计算机参数设置。
打开计算机,启动MedLab生物信号采集处理系统,
按下表进行本实验的计算机参数设置。
2.取家兔称1只,称重后,耳缘静脉缓慢注入1%普鲁卡因(1g/kg),全
麻家兔。
3.动物麻醉后,取仰卧位固定在手术台上,进行气管插管和颈总动脉插管,
动脉导管另一端与连接第1通道的压力换能器相连接,打开动脉夹,记
录血压曲线。
4.四肢皮下插入连接第三通道心电引导电极,红色(负极)---右前肢,黑
色(接地)----右后肢,黄色(正极)----左后肢,记录标准第二导联
心电图。
5.将体温计插入家兔肛门,深度为3.5~ 5 厘米(保持3~5 分钟)。
6.待体温计插入3~5分钟后且血压及心电图曲线稳定后,记录给药前血压
和心率,体温等指标。
7.然后用PGE(6μg/kg)从耳缘静脉注射入家兔体内,30分钟后记录体温,
血压,心率等指标。
8.待体温上升到持续高温阶段,耳缘静脉注射入阿司匹林(20mg/kg),30
分钟后,测量体温,血压,心率等指标。
9.比较正常,发热中和解热后三组数据的关系。
表1解热镇痛药对家兔的影响结果
注:由于实验室无提供测呼吸频率器材,观察记录呼吸频率指标以“加深加快,稳定,变慢变浅”
【注意事项】
1. 实验前要做好压力换能器的定标工作,这对正确读数非常重要。
动脉插管前,进行零点设置,然后再插管,实验过程中不要随意进行“零点设置“。
2. 压力换能器放置的位置与动物心脏要保持同一水平。
要注意三通管的正确使用。
3. 本实验也可用小鼠进行,但小鼠个体较小,不方便体温测定、血压和心率等的测定。
4. 注意耳缘静脉麻醉的用药量与速度。
5. 由于实验无测定呼吸频率的器材,故每组应分配成员注意观察家兔的呼吸频率程度。
6. PGE和阿司匹林静脉注射是要慢。
7. PGE和阿司匹林半衰期为半个小时,但各个家兔机体反正应各异,应注意观察其变化。