分子克隆实验最全面解决方案设计综述
- 格式:ppt
- 大小:1.62 MB
- 文档页数:27

分子克隆技术实验报告姓名:班级:学号:指导老师:pUC19外源1.5kbDNA片段亚克隆于pUC1301摘要:分别从大肠杆菌菌液中提取质粒pUC19和pUC1301,两种质粒都使用Bam HI+Kpn I两种限制性内切酶进行切割。
回收pUC1301质粒中1.5kb片段,使用连接酶将它与切开的pUC19连接,转化感受态大肠杆菌,利用标记基因amp r、kan r和α—互补筛选阳性克隆。
实验获得了很好的酶切效果,但最后没有筛选出阳性克隆。
关键词:pUC19、pUC1301、亚克隆、限制性内切酶、感受态1前言初始克隆中的外源DNA片段往往较大,含有许多目的基因以外的片段,在诸如表达、序列标签和突变等操作中不变进行,因此必须将目的基因所对应的小片段DNA找出来,这个过程叫做亚克隆。
本实验是将pU1301中一段来自水稻1.5kb的片段亚克隆到pUC19上。
首先需要提取所需的质粒。
在大肠杆菌中质粒又大又小、拷贝数又多又要少,因此分离的方法也多种多样。
在实践中最常见的是通过将裂解法提取高拷贝的小质粒以及基于此方法的纯化技术,其他方法还有试剂盒分离纯化等,本实验通过试剂盒分离纯化E.coil质粒DNA。
将质粒提取出来后需要检测所获质粒的质量,方法有吸光值检测、凝胶电泳检测等。
要获得目的片段然后亚克隆与其他载体上,需使用两种工具酶:限制性内切酶、连接酶。
限制性酶切酶主要有三类,目前使用最多的是Ⅱ型。
限制性内切酶的使用需要在合适的条件下,当条件不合适时往往会出现星星活性。
限制性内切酶产生的黏性末端将导致载体自连,为了防止其自连,可以使用双酶切、去磷酸化、末端补平等方法。
连接酶是将两段核酸连接起来的酶,常用的有T4DNA连接酶、大肠杆菌DNA连接酶、TaqDNA连接酶、T4RNA连接酶。
目的片段和载体在连接酶作用下连接成一个整体,需借助一定方法导入受体细胞,首先需要制备感受态细胞,这类细胞处在易吸收外源DNA 条件下,然后通过电转化、CaCl2转化法将外源DNA导入受体细胞。

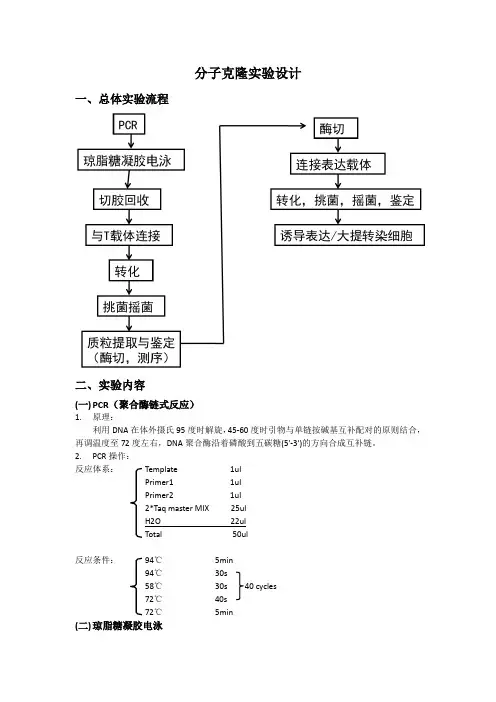
分子克隆实验设计一、总体实验流程二、实验内容(一)PCR(聚合酶链式反应)1.原理:利用DNA在体外摄氏95度时解旋,45-60度时引物与单链按碱基互补配对的原则结合,再调温度至72度左右,DNA聚合酶沿着磷酸到五碳糖(5'-3')的方向合成互补链。
2.PCR操作:反应体系:Template 1ulPrimer1 1ulPrimer2 1ul2*Taq master MIX 25ulH2O 22ulTotal 50ul反应条件:94℃5min94℃30s58℃30s 40 cycles72℃40s72℃5min(二)琼脂糖凝胶电泳1.原理:琼脂糖凝胶具有网络结构,分子通过时会受到阻力,大分子物质在涌动时受到的阻力大,因此在凝胶电泳中,带电颗粒的分离不仅取决于净电荷的性质和数量,而且还取决于分子大小。
2.凝胶电泳步骤:1)称取0.5g琼脂糖至50ml 电泳缓冲液(TAE)中,摇匀;同时装置制胶架。
2)加热至琼脂糖完全融化,期间停止加热摇动3次,即无可见漂浮物,澄清为止。
3)加入1ulEB染液,充分摇匀。
4)缓慢倒入制胶架内,冷却30-60min,至凝胶充分凝固,放入电泳槽中即可使用。
5)使用时,将样品点入相应的加样孔内,即可开始电泳,待指示剂位于整块凝胶2/3位置时,停止电泳,在紫外灯下观察样品条带。
(三)切胶回收(天根生化公司凝胶回收试剂盒)1. 将空小离心管称重。
将回收的带DNA 片段的凝胶放入其中、再次称重,确定凝胶净重。
2. 将离心管中的凝胶捣碎以助于凝胶溶解。
按胶的重量加入三倍体积的Extraction buffer (1mg凝胶加3μl Extraction buffer )。
3. 55℃恒温加热直到凝胶完全融化(5-15 分钟),每隔2-3分钟需将管内混悬液混匀一次。
4. 按照1:1比例加入异丙醇(1mg凝胶加1μl异丙醇),混匀。
5. 将混合液全部移入Spin column、6000rpm离心1分钟,弃去接液管中的液体。


在大肠杆菌中表达克隆化基因导言方案 1.用IPTG诱导启动子在大肠杆菌中表达克隆化基因方案 2.用T7噬菌体启动子在大肠杆菌中表达克隆化基因方案 3.用λ噬菌体P L启动子在大肠杆菌中表达克隆化基因方案 4.用碱性磷酸酶启动子(pho A)和信号序列在大肠杆菌中分泌表达外源蛋白------附加方案:phoA融合蛋白的亚细胞定位方案 5.谷胱甘肽琼脂糖亲和层析纯化融合蛋白方案 6.直链淀粉树脂亲和层析纯化麦芽糖结合融合蛋白方案7.用固化Ni2+吸收色谱纯化带有组氨酸标签的蛋白------替代方案:用pH递降的缓冲液从金属亲和柱洗脱多聚组氨酸标签蛋白------附加方案:NTA- Ni2+琼脂糖再生方案8.从包涵体中纯化表达蛋白------附加方案:重折叠从包涵体提取的溶解蛋白方案9.9信息栏克隆基因的表达大肠杆菌表达系统LacZ融合离液剂导言方案 1.用IPTG诱导启动子在大肠杆菌中表达克隆化基因(一)引言带异丙基-β-D硫代半乳糖苷(IPTG)诱导启动子的质粒表达外源蛋白的总量可以达到全菌蛋白的30%以上。
这些质粒非常适于实验室小规模操作,但IPTG价格昂贵,不能用于大规模制备外源蛋白。
(二)实验方案A.材料1.缓冲液和溶液a)考马斯亮蓝染色溶液或银染溶液b)IPTG (1mmol/L)c)1*SDS凝胶加样缓冲液d)10% SDS-PAGE2.载体和细菌菌株a)带有lacI q或lacI q1等位基因的适于转化的大肠杆菌菌株带有lacI q等位基因的IPTG诱导表达质粒可以转化实验室的任何大肠杆菌菌株(如JM1, DH5F’,TG1等)。
b)IPTG诱导的表达载体c)阳性对照质粒(表达已知大小的LacZ融合蛋白的IPTG诱导载体)3.培养基(如何配制?---分子克隆附录及科技出版社。
)a)含氨苄(50μg/ml)的LB琼脂平板b)含氨苄(50μg/ml)的LB培养基c)含氨苄(50μg/ml)的LB培养液4.专用设备a)沸水浴b)振荡培养箱5.细胞和组织6.附加试剂B.方法含重组表达载体的大肠杆菌菌株的构建1.PCR2.含3.重组质粒4.通过诱导靶蛋白表达的优化5.对照菌和重组菌分别挑取1~2个菌落,接入1ml含氨苄青霉素(50μg/ml)的LB培养液,适当温度(20~37℃)培养过夜(~16h)。

第1篇一、实验目的本实验旨在学习分子克隆技术的基本原理和操作步骤,掌握目的基因的扩增、克隆及表达,为后续相关研究奠定基础。
二、实验原理分子克隆技术是指将目的DNA片段从供体细胞中分离出来,通过体外重组、转化和转导等方法,将其插入到克隆载体中,再将其引入宿主细胞进行复制和扩增。
本实验采用无缝克隆技术,通过T5核酸外切酶、DNA聚合酶和DNA连接酶三种酶的共同作用,实现单片段或多片段与载体连接。
三、实验材料1. 试剂:限制性内切酶、DNA连接酶、T5核酸外切酶、DNA聚合酶、dNTPs、Taq DNA聚合酶、PCR引物、载体DNA、目的基因DNA、质粒提取试剂盒、琼脂糖凝胶电泳试剂盒等。
2. 仪器:PCR仪、凝胶成像仪、电泳仪、紫外灯、超净工作台、离心机、恒温水浴锅、移液器等。
四、实验步骤1. 目的基因扩增(1)设计引物:根据目的基因的序列设计特异性引物,引物长度一般在18-25bp,5'端添加限制酶切位点。
(2)PCR反应:配制PCR反应体系,加入引物、模板DNA、dNTPs、Taq DNA聚合酶等,进行PCR反应。
2. 载体线性化(1)酶切:使用限制性内切酶对载体DNA进行酶切,获得线性化的载体。
(2)去磷酸化:对单酶切得到的线性化载体进行去磷酸化处理。
3. 目的基因与载体连接(1)同源臂连接:将目的基因PCR产物和线性化载体进行同源臂连接,确保目的基因正确插入载体。
(2)连接反应:配制连接反应体系,加入目的基因PCR产物、线性化载体、DNA连接酶等,进行连接反应。
4. 转化与筛选(1)转化:将连接产物转化至宿主细胞中。
(2)筛选:通过抗生素筛选、酶切鉴定和测序等方法筛选出含有目的基因的克隆。
5. 目的基因表达(1)重组质粒提取:从筛选出的阳性克隆中提取重组质粒。
(2)重组质粒转化:将重组质粒转化至表达宿主细胞中。
(3)表达产物检测:通过Western blot、ELISA等方法检测目的蛋白的表达水平。

如何构建一个大肠杆菌高效表达的分子克隆?影响基因在大肠杆菌中表达的因素是多方面的,以下我就从载体选择、启动子、终止子、核糖体结合位点、密码子、质粒拷贝数、表达产物的稳定性、受体细胞代谢等方面说明构建大肠杆菌高效表达的方法。
一、表达载体表达载体应具有以下条件:1、能够独立复制。
根据载体复制的特点,可分为严谨型和松弛型。
严谨型载体伴随宿主染色体的复制而复制,在宿主中拷贝数很少(1~3个);松弛型的复制而不依赖于宿主染色体,在宿主细胞中的拷贝数可多达3000个。
2、应具有灵活得多克隆位点和方便的筛选标记,便于外源基因的克隆、鉴定和筛选。
而且多克隆位点应位于启动子序列之后,以使外源基因表达。
3、应具有很强的启动子,能被大肠杆菌的RNA聚合酶识别。
4、应具有使启动子受抑制的阻遏子,只有在受到诱导时才能进行转录。
阻遏子的阻遏作用可由物理(如温度)、化学(如IPTG、IAA等)因素进行调节,这样可人为地选择启动子启动转录mRNA的时机。
因外源基因的高效表达往往会抑制宿主细胞的生长、增殖。
而阻遏子可使宿主细胞免除此不良影响。
例如可使宿主细胞快速生长增殖到相当量,再通过瞬时消除阻遏,使所表达的蛋白质在短时间内大量积累,同时可减少表达产物的降解。
5、应具有很强的终止子,以便使RNA聚合酶集中力量转录克隆的外源基因,而不转录其他无关基因。
同时强终止子所产生的mRNA较为稳定。
诱导表达时,由于强终止子所致的高水平转录反过来会影响质粒DNA自身的复制,从而引起质粒的不稳定或脱质粒现象。
因此在外源基因的下游安置强终止子可以克服由质粒转录引起的质粒不稳定。
6、所产生的mRNA必须有翻译的起始信号,即起始密码AUG和SD序列。
二、启动子启动子是表达载体最重要的组成成分,这是因为启动子控制了基因表达的第一个阶段,决定了mRNA合成的速度。
启动子是在转录水平上影响基因表达。
转录的最大速率取决于启动子中碱基的组成,往往会因为一个碱基的不同,启动子效率可能提高上千倍。

分子克隆及细胞培养基本实验方法1.载体构建实用操作技术1.1菌种的保存—20%甘油菌2体积菌液与1体积70%的甘油混合后,储存于-20℃或-70℃备用。
(甘油菌中甘油的浓度为20-30%均可)1.2甘油菌复苏、培养方法一、挑取甘油菌一环,接种在含100ug/ml Amp的LB固体培养基上(活化菌种),37℃培养过夜(约16小时);挑取一个菌落转接在含100ug/ml Amp的LB液体培养基中,37℃振荡过夜(约12~16小时)。
方法二、直接吸取10~20ul甘油菌,接种在含100ug/ml Amp的LB液体培养基中,37℃振荡过夜(约12~16小时)。
1.3小规模制备质粒DNA(QIA miniprep kit )适于从1~5ml 菌液中制备20ug高拷贝质粒⑴收集菌液,离心1000rpm,1分,弃上清⑵以250ul P1重悬细菌(P1中已加RNase)⑶加入250ul P2,颠倒4~6次轻混,约2~3分(轻混以免剪切基因组DNA,并免长时间消化)⑷加入350ul N3,迅速颠倒4~6次轻混;离心10分,13 000rpm⑸上清入QIAprep柱,离心30~60秒,滤液弃之⑹加入0.5ml PB洗,离心30~60秒⑺加入0.75ml PE洗,离心30~60秒,弃滤液,再离心1分⑻换新管,加入50ul EB,静置1分(EB 37℃预热),离心1分。
1.4酶切反应⑴体系构成(反应体系尽可能小!)pGEM3ZF-huCTLA4-Ig(ul)pAdTrack-CMV(ul)①dd.H2O 17 17②10×NEbuff 2 3 3③10×BSA 3 3④底物DNA 5 5⑤内切酶HindⅢ 1 1XbaⅠ 1 1Total : 30 ul 30ul⑵37℃水浴1~2小时,必要时延长酶切时间至12小时⑶酶切2小时后,取5-10ul 电泳观察酶解是否完全⑷65℃灭活内切酶⑸-20℃保存备用1.5回收目的片段(QIAquick Gel extraction Protocol)⑴胶,尽可能去除多余的胶,称重;⑵加入适量buff QG(300ul QG /100mg胶);>2%的胶,应加大QG用量(600ulQG /100mg);⑶水浴50℃,10min,每2-3min混匀一次,使胶完全溶解!必要时延长水浴时间,胶完全溶解后混合物颜色应为黄色,与buff QG 相似;⑷当DNA片段在<500bp或>4kb时,应加入异戊醇100ul/100mg胶,以提高产物量。

分子克隆技术实验讲义黑龙江大学生命科学学院3月甜菜M14品系BvM14-glyI基因的克隆与鉴定一・实验目的1、熟悉和了解目的基因克隆与鉴定的过程和方法。
2、学习和掌握质粒、T载体的特点。
3、学习和掌握TA克隆的连接体系及操作要点。
4、学习和掌握X® I酶切制备T载体的过程及方法。
5、学习和掌握CaC12法制备大肠杆菌感受态细胞的原理和方法。
6、学习并掌握热激法转化技术的原理和操作步骤。
7、学习并掌握重组子鉴定和筛选的原理及蓝白筛选的原理和方法。
8、学习并掌握碱法小量制备质粒DNA的原理及操作步骤。
二.相关知识(一)T载体的制备PMD18-T Vector 种高效克隆PCR产物(T-A Cloning)的商业化专用载体,由pMC 18载体改建而成。
在pMC 18多克隆位点处的Xbal和Sa/I 识别位点之间插入了EcoRV识别位点,用EcoRV进行酶切反应后,再左两侧的3,端添加” T”而成,能够大大提高PCR产物的连接.克隆效率。
相关知识点:(1)质粒的提取;(2)酶切;(3) PCR等。
(二)DNA的重组与连接(PCR产物的克隆)把DNA片段从某一类型的载体无性繁殖到启一类型载体中,例如从某种质粒克隆到另一种质粒,这个过程称为亚克隆。
所谓重组,就是把外源目的基因''装进"载体的过程,即DNA的重新组合。
为了将目的基因重组于载体分子中,需要将载体DNA和目的基因分别进行适当处理,一般采用内切酶法将载体DNA分子切割成可与外源基因连接的线性分子,使其与相同酶切过的载体分子相互连接,彼此成为配伍末端(compatible end),以产生末端连接。
现在一些生物公司也开发了针对不同插入DNA片段的专用载体,如专门用于克隆PCR产物的载体,大大方便了实验操作。
相关知识点:(1)克隆与亚克隆;(2) DNA重组;(3)内切酶;(4)粘性末端与平末端;(5)连接酶;(6)连接酶的分类及功能等。

分⼦克隆全攻略分⼦克隆⼀、载体与外源⽚段(PCR产物)的双酶切为了保证做连接反应时有⾜够的量,应该加⼊1ug的DNA进⾏酶切反应;两种酶分别加1ul,10*buffer 2ul,1ug的DNA,加⽔⾄20ul。
(因此要跑胶分析DNA以及载体的浓度,取1-2ul,电泳检测其含量。
1ul量太少,可以加将其稀释在9ul⽔中,再加loading buffer。
6ul 15000bp的maker,2500bp条带的亮度约是100ng DNA。
可对⽐maker的亮度算出酶切回收的DNA的浓度,以便于连接反应的⽤量。
Image J软件可以做灰度分析。
)双酶切反应结束后,使⽤PCR cleanup试剂盒回收DNA与载体。
回收完之后⽤同样的⽅法分析其浓度。
(也可以⽤分光光度计直接测量DNA的浓度,但是,⼀般酶切反应之后浓度会⽐较⼩,取1ul 稀释100倍之后浓度很低,可能已经低于仪器的测量范围,⽽电泳灵敏度很⾼,还可⼀排除杂带、RNA、蛋⽩质等对浓度的⼲扰。
)⼆、连接反应载体100ng,DNA⽚段根据⼤⼩,1ul buffer,1ul T4连接酶,加⽔⾄10ul;16°连接12-16h。
载体(约0.03pmol)与外源DNA的摩尔⽐⼤约1:3~1:10之间,根据载体与DNA⽚段的长度,可算出需要的量。
扫胶的电脑上有个⽂件:连接反应.xls,按要求填写即可得出连接反应的⽤量。
因为载体的⼤⼩⼀般在5kb-10kb,因此,严格的算出0.03pmol的载体的质量意义不⼤,⼤约100ng即可。
如果时间⽐较紧张,可以25°连接15min,之后可取5ul进⾏转化,剩余5ul 16°继续连接。
三、质粒转化到感受态⼤肠杆菌中从-70°中取出感受态,在⼿⼼融化后⽴即插⼊冰上,5ul连接产物+100ul感受态⼤肠杆菌,混匀。
冰浴30min,然后42°热激90s,热激时不要晃动EP管。
然后⽴即插⼊冰上,静置2min。

分子克隆技术DNA重组技术是在分子水平对基因进行体外操作,因而也称为分子克隆(Molecular Cloning)或基因克隆,是在体外对DNA分子按照既定的目的进行人工重组,并导入到合适的受体细胞中,使其在细胞中扩增和繁殖,以获得DNA 分子大量复制,并使受体细胞获得新的遗传特征的过程。
其基本原理是:将编码某一多肽或蛋白质的基因(外源基因)经过特定限制性酶切割以及与目标载体连接,组装到细菌质粒(质粒是细菌染色体外的双链环状DNA分子)中,再将这种质粒(重组质粒)转入大肠杆菌体内,这样重组质粒就随大肠杆菌的增殖而复制,从而表达出外源基因编码的相应多肽或蛋白质,并且来源于一个菌株的质粒是一个分子克隆,而随质粒复制出的外源基因也就是一个分子克隆。
分子克隆技术的成就对于工业、农牧业和医学产生深远影响,并将为解决世界面临的能源、食品和环保三大危机开拓一条新的出路。
实验前准备实验开始前,需准备好所需的试剂,如PCR扩增及酶切,连接所需酶类试剂及相应的buffer,均为TaKaRa产品分装,Buffer、dNTP、引物试剂等需要从-20℃取出至室温融化、涡旋震荡混匀离心后使用,酶类试剂从-20℃取出瞬时离心(小于4000 rpm)放置冰浴中备用。
还有各项实验所需的药品(如琼脂糖),以及配置好培养基,抽提质粒用的溶液一、二、三等试剂。
本次实验所涉及的常规仪器及耗材有:Thermo Scientific Arktik PCR仪,水平电泳槽,超净工作台,恒温水浴锅,紫外照胶仪,赛默飞公司提供的F1,F2和F3一系列量程的单道移液器等仪器,1.5ml离心管,玻璃试管,赛默飞公司提供的QSP盒装吸头及15ml离心管等。
接下来进入实验部分,本实验操作流程为:首先在GenBank中查询目的基因序列,然后根据得到的序列进行酶切位点分析及引物的设计,通过RT-PCR获取目的基因,酶切以及与载体连接,转化进入宿主菌中,针对得到的菌落进行菌落PCR快速筛选,得到初步的阳性克隆,最后通过质粒提取及鉴定,得到的阳性克隆,测序分析及得到正确的重组质粒。
第1篇一、实验目的1. 学习分子生物学中最基本的技术——分子克隆的操作过程。
2. 掌握基因克隆的概念,了解基因克隆的基本原理和方法。
3. 熟练掌握DNA提取、限制性内切酶切割、DNA连接、转化、筛选和鉴定等分子克隆实验操作。
4. 提高实验操作技能,培养严谨的科学态度。
二、实验原理分子克隆是指将目的基因(或DNA片段)与载体DNA连接,使其在宿主细胞中复制和表达的过程。
本实验采用分子克隆组装技术,将目的基因插入载体中,实现基因克隆。
三、实验材料1. 基因组DNA提取试剂盒2. 限制性内切酶3. DNA连接酶4. 载体DNA5. 目的基因片段6. 转化宿主细胞7. LB培养基、琼脂糖、氨苄青霉素等四、实验步骤1. 提取目的基因片段和载体DNA(1)取适量基因组DNA,按照试剂盒说明书进行提取。
(2)取适量载体DNA,按照试剂盒说明书进行提取。
2. 限制性内切酶切割(1)将目的基因片段和载体DNA分别用限制性内切酶进行切割。
(2)酶切反应体系:10×酶切缓冲液5μl,限制性内切酶1μl,DNA模板5μl,加双蒸水至50μl。
(3)酶切条件:37℃反应2小时。
3. DNA连接(1)将酶切后的目的基因片段和载体DNA进行连接。
(2)连接反应体系:10×连接缓冲液5μl,DNA连接酶1μl,酶切后的目的基因片段5μl,酶切后的载体DNA5μl,加双蒸水至50μl。
(3)连接条件:16℃反应4小时。
4. 转化宿主细胞(1)将连接产物转化大肠杆菌DH5α感受态细胞。
(2)转化条件:42℃热激45秒。
5. 筛选和鉴定(1)将转化后的细胞涂布于含有氨苄青霉素的LB培养基平板上,37℃培养过夜。
(2)挑取单克隆菌落,提取质粒DNA。
(3)对提取的质粒DNA进行PCR扩增,检测目的基因是否插入载体。
(4)对阳性克隆进行测序,验证插入序列的正确性。
五、实验结果1. 成功提取目的基因片段和载体DNA。
2. 目的基因片段和载体DNA经限制性内切酶切割后,酶切图谱与预期相符。
分子克隆实验报告实验名称:分子克隆、分子杂交、基因表达检测实验类型:综合性****:***班级: A**:***学号:*************实验时间:2015/8/19—2015/8/25实验一分子克隆DNA重组技术包括载体及外源DNA片段的酶切消化、目的片段的获得及纯化、目的片段与克隆载体的体外连接、重组子的筛选和鉴定等内容。
DNA片段的克隆技术是分子操作的核心部分实验原理及方法DNA提取:(CTAB法) CTAB是一种非离子去污剂,植物材料在CTAB的处理下,结合65︒C水浴使细胞裂解、蛋白质变性、DNA被释放出来。
CTAB与核酸形成复合物,此复合物在高盐(>0.7mM)浓度下可溶,并稳定存在,但在低盐浓度(0.1-0.5mM NaCl)下CTAB-核酸复合物就因溶解度降低而沉淀,而大部分的蛋白质及多糖等仍溶解于溶液中。
经离心弃上清后,CTAB-核酸复合物再用70-75%酒精浸泡可洗脱掉CTAB。
再经过氯仿/异戊醇(24:1) 抽提去除蛋白质、多糖、色素等来纯化DNA,最后经异丙醇或乙醇等DNA沉淀剂将DNA沉淀分离出来。
感受态细胞的制备及质粒的转化质粒提取:在pH 12.0 ~ 12.6碱性环境中,细菌大分子量染色体DNA变性分开,而共价闭环的质粒DNA虽然变性但仍处于拓扑缠绕状态。
将pH调至中性并有高盐存在及低温的条件下,大部分染色体DNA、大分子量的RNA和蛋白质在去污剂SDS的作用下形成沉淀,而质粒DNA仍然为可溶状态。
通过离心,可除去大部分细胞碎片、染色体DNA、RNA及蛋白质,质粒DNA尚在上清中,然后用酚、氯仿抽提进一步纯化质粒DNACaCl2法:利用冰冷的CaCl2处理对数生长期的细胞,可以诱导其产生短暂的“感受态”,易于摄取外源DNA。
106 ~ 107转化子/μg DNA。
酶切酶连:限制性内切酶可识别特定位点并切割DNA产生粘性末端或平末端的外源片段,经纯化处理后的DNA用于连接反应;选择克隆载体pUC19多克隆位点上相应的限制性内切酶切割,并用碱性磷酸酶处理防止载体自连;在连接酶的作用下将外源片段连接到载体上,实现外源片段的克隆。
Standard Operation Procedure—分子克隆一. PCR(polymerase chain reaction ,PCR)的基本原理及操作(一) PCR的基本原理PCR技术又称聚合酶链反应(Polymerase Chain Reaction)技术,是一种在体外扩增核酸的技术。
该技术模拟体内天然DNA的复制过程。
其基本原理是在模板、引物、4种dNTP 和耐热DNA聚合酶存在的条件下,特异扩增位于两段已知序列之间的DNA区段的酶促合成反应。
每一循环包括变性、退火、延伸三步反应。
每一循环的产物作为下一个循环的模板,如此循环30次。
PCR技术的特异性取决于引物与模板结合的特异性。
(二).PCR的操作步骤1.引物处理引物在使用前,将其稀释为10µM,具体稀释的方法:将装有引物的EP管 12000rpm 离心2min,向管中加入PH8.0的灭菌水,体积(µL)=10×nmol数, 将其稀释为100µM实验前取5µM,加入45µL H2O(PH8.0)混匀后使用。
2.PCR的反应体系及条件PCR的反应体系可以选择50µL或25µL。
PCR扩增需要的体系中包括:模板(cDNA),5’primer 引物,3’primer 引物,dNTP ,Taq酶,酶的相应Buffer,双蒸灭菌水(pH8.0)。
以50µL体系为例:反应体系:模板 2µL5’primer 引物(10µM) 1µL3’primer 引物(10µM) 1µLdNTP(2.5µM) 6或8µLBuffer 稀释成1*Taq酶 0.25-0.5µLH2O 50µL -以上体积和总体积 50µL反应条件:94℃ 3 min 1 cycle94℃ 40 sec退火温度 40 sec Pyrobest, PrimeSTAR 28 cycles; LA-Taq 30 cycles72℃延伸时间72℃ 10min 1 cycle4℃∞体系中各试剂按照从多到少的顺序加入到PCR管中, 94℃ 3 min后,中止PCR反应,迅速加入Taq酶,在加入酶时注意不要将枪头碰到PCR管壁,应迅速将枪头插入PCR管底部,不必按下枪,酶在热的环境中会自动进入反应液中。
分子克隆技术实验讲义黑龙江大学生命科学学院2016年3 月甜菜M14 品系BvM14-glyI 基因的克隆与鉴定、实验目的1、熟悉和了解目的基因克隆与鉴定的过程和方法。
2、学习和掌握质粒、T 载体的特点。
3、学习和掌握TA 克隆的连接体系及操作要点。
4、学习和掌握Xcm l酶切制备T载体的过程及方法。
5、学习和掌握CaCb法制备大肠杆菌感受态细胞的原理和方法。
6、学习并掌握热激法转化技术的原理和操作步骤。
7、学习并掌握重组子鉴定和筛选的原理及蓝白筛选的原理和方法。
8、学习并掌握碱法小量制备质粒DNA 的原理及操作步骤。
二、相关知识(一)T 载体的制备pMD18-T Vector是一种高效克隆PCR产物(T-A Cloning )的商业化专用载体,由p M C 18载体改建而成。
在p M C 18多克隆位点处的Xba l和Sall识别位点之间插入了Eco R V识别位点,用Eco R V进行酶切反应后,再左两侧的3'端添加“ T”而成,可以大大提高PCR产物的连接、克隆效率。
相关知识点:(1)质粒的提取;(2)酶切;(3) PCR等。
(二)DNA的重组与连接(PCR产物的克隆)把DNA 片段从某一类型的载体无性繁殖到另一类型载体中,例如从某种质粒克隆到另一种质粒,这个过程称为亚克隆。
所谓重组,就是把外源目的基因“装进”载体的过程,即DNA 的重新组合。
为了将目的基因重组于载体分子中,需要将载体DNA 和目的基因分别进行适当处理,一般采用内切酶法将载体DNA 分子切割成可与外源基因连接的线性分子,使其与相同酶切过的载体分子相互连接,彼此成为配伍末端(compatible end),以产生末端连接。
现在一些生物公司也开发了针对不同插入DNA片段的专用载体,如专门用于克隆PCR产物的载体,大大方便了实验操作。
相关知识点: (1)克隆与亚克隆; (2) DNA 重组;(3)内切酶;( 4)粘性末端与平末端;(5)连接酶;( 6)连接酶的分类及功能等。