酸碱盐的溶解性表
- 格式:docx
- 大小:13.63 KB
- 文档页数:9
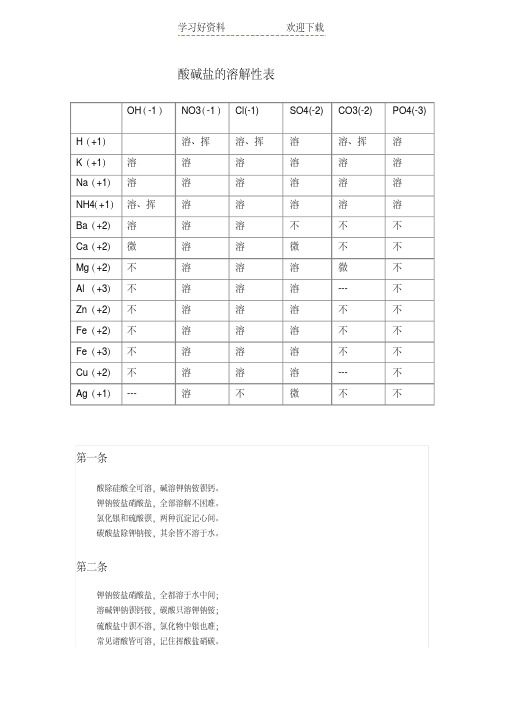
酸碱盐的溶解性表
OH(-1)NO3(-1)Cl(-1) SO4(-2)CO3(-2) PO4(-3) H(+1)溶、挥溶、挥溶溶、挥溶
K(+1)溶溶溶溶溶溶
Na(+1)溶溶溶溶溶溶
NH4(+1)溶、挥溶溶溶溶溶
Ba(+2)溶溶溶不不不
Ca(+2)微溶溶微不不
Mg(+2)不溶溶溶微不
Al(+3)不溶溶溶--- 不
Zn(+2)不溶溶溶不不
Fe(+2)不溶溶溶不不
Fe(+3)不溶溶溶不不
Cu(+2)不溶溶溶--- 不
Ag(+1)--- 溶不微不不
第一条
酸除硅酸全可溶,碱溶钾钠铵钡钙。
钾钠铵盐硝酸盐,全部溶解不困难。
氯化银和硫酸钡,两种沉淀记心间。
碳酸盐除钾钠铵,其余皆不溶于水。
第二条
钾钠铵盐硝酸盐,全都溶于水中间;
溶碱钾钠钡钙铵,碳酸只溶钾钠铵;
硫酸盐中钡不溶,氯化物中银也难;
常见诸酸皆可溶,记住挥酸盐硝碳。
第三条
碱有钾钠铵钡溶,氢氧化钙是微溶。
碳酸铝铁银碱无,钾钠铵硝盐全溶。
硫酸不溶只有钡,硫酸钙银盐微溶。
微溶还有碳酸镁,盐酸只有银不溶。
注:[特殊不溶解:氯化银、硫酸钡不溶于稀硝酸] 第四条
氯盐只有银不溶,碱镁铝锰锌铁铜。
硫酸钡钙银不溶,碳酸钾钠氢氨溶。
氢氧化钙是微溶,钾钠钡铵碱可溶。
红褐铁,蓝絮铜,其它沉淀呈白色。

高中阶段常见酸碱盐溶解性表(25℃, 101.3kPa)
OHˉNO3ˉClˉSO42
ˉS
2
ˉSO32ˉCO32ˉSiO32ˉPO43ˉ
H+溶、挥溶、挥溶溶、挥溶、挥溶、挥难溶
NH4+溶、挥溶溶溶溶溶溶—溶
K+溶溶溶溶溶溶溶溶溶
Na+溶溶溶溶溶溶溶溶溶
Ba2+溶溶溶难—微难难难
Ca2+微溶溶微—难难难难
Mg2+难溶溶溶—微微难难
Al3+难溶溶溶———难难
Mn2+难溶溶溶难难难难难
Zn2+难溶溶溶难难难难难
Cr3+难溶溶溶———难难
Fe2+难溶溶溶难难难难难
Fe3+难溶溶溶———难难
Sn2+难溶溶溶难———难
Pb2+难溶微微难难难难难
Cu2+难溶溶溶难溶—难难
Hg2+—溶溶溶难难——难
Ag+—溶难微难难难难难
注:“溶”表示该物质溶解度大于1g/100g 水,“微”表示溶解度介于0.01g/100g 水到 1g/100g 水之间,“难”表示溶解度小于0.01g/100g 水,“-”表示该物质不能在水溶液中稳定存在。

名称化学式溶解性溶液及沉淀颜色硝酸 HNO3 溶、挥无色硝酸铵 NH4NO3 溶无色硝酸钾 KNO3 溶无色硝酸钠 NaNO3 溶无色硝酸钡 Ba(NO3)2 溶无色硝酸钙 Ca(NO3)2 溶无色硝酸镁 Mg(NO3)2 溶无色硝酸铝 Al(NO3)3 溶无色硝酸锰 Mn(NO3)2 溶无色硝酸锌 Zn(NO3)2 溶无色硝酸铁 Fe(NO3)3 溶黄色硝酸亚铁 Fe(NO3)2 溶浅绿色硝酸铜 Cu(NO3)2 溶蓝色硝酸银 AgNO3 溶无色氯化氢 HCl 溶、挥无色氯化铵 NH4Cl 溶无色氯化钾 KCL 溶无色氯化钠 NaCl 溶无色氯化钡 BaCl 溶无色氯化钙 CaCl 溶无色氯化镁 MgCl2 溶无色氯化铝 AlCl3 溶无色氯化锰 MnCl2 溶无色氯化锌 ZnCl2 溶无色氯化铁 FeCl3 溶黄色氯化亚铁 FeCl2 溶浅绿色氯化铜 CuCl2 溶蓝绿色氯化银 AgCl 不白色硫酸 H2SO4 溶无色硫酸铵 (NH4)2SO4 溶无色硫酸钾 K2SO4 溶无色硫酸钠 Na2SO4 溶无色硫酸钡 BaSO4 不白色硫酸钙 CaSO4 微无色、白色硫酸镁 MgSO4 溶无色硫酸铝 Al2(SO4)3 溶无色硫酸锰 MnSO4 溶无色硫酸锌 ZnSO4 溶无色硫酸铁 Fe2(SO4)3 溶黄色硫酸亚铁 FeSO4 溶浅绿色硫酸铜 CuSO4 溶蓝色硫酸银 Ag2SO4 微无色、白色碳酸 H2CO3 溶、挥无色碳酸氨 (NH4)2CO3 溶无色碳酸钾 K2CO3 溶无色碳酸钠 Na2CO3 溶无色碳酸钡 BaCO3 不白色碳酸钙 CaCO3 不白色碳酸镁 MgCO3 微无色、白色碳酸铝 /碳酸锰 MnCO3 不白色碳酸锌 ZnCO3 不白色碳酸铁 /碳酸亚铁 FeCO3 不白色碳酸铜 CuCO3 不蓝色碳酸银 Ag2CO3 不白色一水合氨 NH3.H2O 溶、挥无色氢氧化钾 KOH 溶无色氢氧化钠 NaOH 溶无色氢氧化钡 Ba(OH)2 溶无色氢氧化钙 Ca(OH)2 微无色、白色氢氧化镁 Mg(OH)2 不白色氢氧化铝 Al(OH)3 不白色氢氧化锰 Mn(OH)2 不白色氢氧化锌 Zn(OH)2 不白色氢氧化铁 Fe(OH)3 不红褐色氢氧化亚铁 Fe(OH)2 不白色氢氧化铜 Cu(OH)2 不蓝色氢氧化银 /。

酸碱盐溶解性表钾钠铵盐硝酸银,永远溶解不沉淀!碳酸盐不溶钡、钙、银!硫酸钡氯化银!四大强碱记心间!(特别说明:上述沉淀全部为白色沉淀!)重要化学知识三大强酸:盐酸;HCL硫酸:H2SO4硝酸:HNO3四大强碱:氢氧化钾:KOH氢氧化钠:NaOH氢氧化钙:Ca(OH)2氢氧化钡:Ba(OH)2常见微溶物:(微溶物指该物质溶解度很低,不能大量存在,当生成的量过多时会有白色沉淀析出)硫酸钙CaSO4、硫酸银Ag2SO4碳酸镁MgCO3氢氧化钙Ca(OH)2中学重要的带有颜色的沉淀:氢氧化亚铁(白色沉淀)Fe(OH)2氢氧化铁(红褐色沉淀)Fe(OH)3氢氧化铜(蓝色沉淀)Cu(OH)2溴化银(浅黄色沉淀)AgBr碘化银(黄色沉淀)AgI常见的有色离子是Cu2+(蓝色)、Fe2+(浅绿色)、Fe3+(黄棕色)、MnO4-锰酸根离子(紫色)不能大量共存的离子1、生成难溶物或微溶物:SO42-与Ba2+、Ag+;OH-与Cu2+、Fe3+、Mg2+、Al3+;Ag+与Cl-、CO32-、SO32-(亚硫酸根离子)、S2-(硫离子);Mg2+、Ba2+、Ca2+与CO32-、SO32-(亚硫酸根离子)、PO43-(磷酸根离子)等不能大量共存.2、生成气体或挥发性物质:如NH4+与OH-,H+与CO32-、HCO3-(碳酸氢根离子)等不能大量共存。
3、生成水:OH-与H+不能大量共存。
碱性溶液中肯定不存在与OH-起反应的离子;酸性溶液中肯定不存在与H+起反应的离子。
酸性溶液、pH=1的溶液、能使pH试纸变红的溶液、使石蕊试液变红等,在分析各选项组的离子时,还需考虑H+的存在;碱性溶液、pH=14的溶液、能使pH试纸变蓝的溶液,使石蕊试液变蓝或使酚酞试液变红的溶液等;在分析各选项组的离子时,还需考虑OH-的存在;练习:1、下列各组离子在溶液中一定能大量共存的是()A.H+、Cl-、OH- B. H+、SO42-、HCO3-C. Ba2+、H+、SO42-D.Cu2+、Cl-、NO3-2、下列各组物质能在同一溶液中大量共存的是()A.NaCl、HCl、MgSO4、Cu(NO3)2B.AgNO3、NaCl、Mg(NO3)2、NaOHC.Ca(OH)2、NaNO3、Na2CO3、NH4ClD.HCl 、K2SO4、NaOH、NaNO33、分别将下列各组物质同时加到足量的水中,能得到无色透明溶液的是()A. NaNO3、Ba(OH)2、HNO3B. H2SO4、NaNO3、Na2SO4C. H2SO4、NaNO3、FeSO4D.CaCl2、Na2SO4、BaCl24、化学兴趣小组的同学在分析某种含有三种溶质的无色透明溶液时,得出了以下结论,其中的三种溶质可能正确的是()A. CuCl2、Ba(OH)2、NaClB. Na2SO4、HCl、Ba(NO3)2C. KCl、HCl、Al2(SO4)3D. HCl、NaCO3、Na2SO45、下列各组物质能在PH为1的溶液中大量共存,且溶液为无色透明的是()A. CaCl2、NaNO3、KOH、MgCl2 B. CuSO4、NaCl、H2SO4、KNO3C. Na2CO3、NaCl 、KNO3、NH4ClD. ZnSO4、MgCl2、NaNO3、KCl。
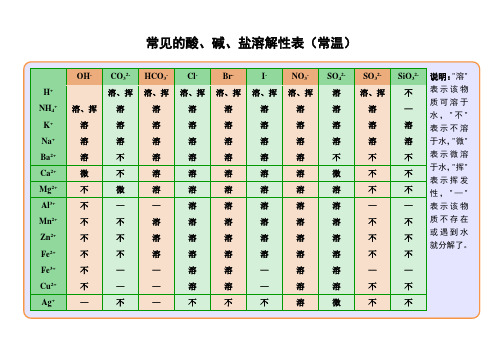

说明:
1、此为20℃时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“——”表示那种物质不存在或遇到水就分解了。
2、记住初中阶段可能常用到的不溶性物质(已重点框出),知道几个微溶性物质(有底色处)。
其余不溶物一般不常考,除此之外就都是可溶性物质了。
3、微溶性物质:在反应物可视为可溶,在生成物可视为不溶,适用于除杂、鉴别题型。
4、白色沉淀:氯化银、碳酸钙、碳酸钡、硫酸钡、氢氧化铝、氢氧化镁
红褐色沉淀:氢氧化铁(Fe(OH)3)
蓝色沉淀:氢氧化铜(Cu(OH)2)
有色离子:溶液中若有
铜离子(Cu2+):呈蓝色亚铁离子(Fe2+):呈浅绿色铁离子(Fe3+):呈黄色适用于物质推断题型。
5、特殊不溶解:氯化银、硫酸钡既不溶于水,也不溶于稀硝酸。
注:以上所有离子符号的电荷数及正负应写在右上方且本身不加括号、化学式中的数字角码
应写在右下方,这里是为了方便打字,请谅解。
部分酸碱盐溶解性背诵口诀
①钾钠铵盐硝酸盐,
完全溶解不困难。
②硫酸盐中钡不溶,
盐酸盐中只银难,
硫酸钡和氯化银,
两种沉淀记心间。
③碳酸盐溶钾钠铵,
碳酸铝铁银碱无。
④硫酸钙银盐微溶,
微溶还有碳酸镁。
⑤碱有钾钠铵钡溶,
氢氧化钙是微溶,
其他全都不能溶。
⑥常见诸酸皆可溶,
记住挥酸盐硝碳。
注:口诀仅供参考,本身并不完全准确,但是能促进记忆。
酸碱盐的溶解性表说明:此为20 C时的情况。
“溶”表示那种物质可溶于水,“不”表示不溶于水,“微”表示微溶于水,“挥”表示挥发性,“---”表示那种物质不存在或遇到水就分解了背诵口诀1. 钾钠铵盐都可溶,氯化物不溶氯化银硫酸盐钙银微溶钡不溶硝酸盐遇水影无踪碳酸盐除钾钠铵都不溶钾钠钡钙碱可溶红褐铁,蓝絮铜其它沉淀白色呈注:1.初中用够了,红褐铁,代表铁盐沉淀为红褐色【fe(oh)2氢氧化亚铁除外】,蓝絮铜代表,铜盐为蓝色絮状沉淀。
2.氯化银【不溶酸】,碳酸钙,碳酸钡,硫酸钡【不溶酸】,氢氧化铝,氢氧化镁,为白色沉淀。
氢氧化铁(红褐色)氢氧化铜(蓝色)说明【】内为前一物质的特点2. 钾钠铵盐全都溶碳酸除镁是微溶其他全都不能溶AgCI、BaS04酸也不溶磷酸盐,更不溶一、氧气的性质:(1)单质与氧气的反应:(化合反应)1.镁在空气中燃烧:2Mg+O2 点燃2MgO2.铁在氧气中燃烧:3Fe+2O2 点燃Fe3O43.铜在空气中受热:2Cu+O2 加热2CuO4.铝在空气中燃烧:4Al+3O2 点燃2Al2O35. 氢气中空气中燃烧:2H2+O2点燃2H2O6. 红磷在空气中燃烧(研究空气组成的实验):4P+5O2点燃2P2O57. 硫粉在空气中燃烧:S+O2点燃SO28. 碳在氧气中充分燃烧:C+O2点燃CO29. 碳在氧气中不充分燃烧:2C+O2点燃2CO(2 )化合物与氧气的反应:10. 一氧化碳在氧气中燃烧:2CO+O2点燃2CO211. 甲烷在空气中燃烧:CH4+2O2 点燃CO2+2H2O12. 酒精在空气中燃烧:C2H5OH+3O2 点燃2CO2+3H2O(3)氧气的来源:13 .玻义耳研究空气的成分实验2HgO加热Hg+02 T14 .加热高锰酸钾:2KMnO4加热K2MnO4+MnO2+O2 f (实验室制氧气原理1)15 .过氧化氢在二氧化锰作催化剂条件下分解反应:H2O2MnO22H2O+O2 f (实验室制氧气原理2)二、自然界中的水:16 .水在直流电的作用下分解(研究水的组成实验):2H2O通电2H2 1+02 f17 .生石灰溶于水:CaO+H2O==Ca(OH)218 .二氧化碳可溶于水:H2O+CO2==H2CO3三、质量守恒定律:19 .镁在空气中燃烧:2Mg+O2 点燃2Mg020 .铁和硫酸铜溶液反应:Fe+CuSO4===FeSO4+Cu21 .氢气还原氧化铜:H2+CuO加热Cu+H2O22. 镁还原氧化铜:Mg+CuO加热Cu+MgO四、碳和碳的氧化物:(1)碳的化学性质23. 碳在氧气中充分燃烧:C+O2点燃CO224 .木炭还原氧化铜:C+2CuO高温2Cu+CO2 f25 .焦炭还原氧化铁:3C+2Fe2O3高温4Fe+3CO2 f(2 )煤炉中发生的三个反应:(几个化合反应)26 .煤炉的底层:C+02点燃C0227 .煤炉的中层:CO2+C高温2CO28 .煤炉的上部蓝色火焰的产生:2CO+O2点燃2CO2(3)二氧化碳的制法与性质:29 .大理石与稀盐酸反应(实验室制二氧化碳):CaCO3+2HCI==CaCI2+H2O+CO2 T30 .碳酸不稳定而分解:H2CO3==H2O+CO2 T31 .二氧化碳可溶于水:H2O+CO2==H2CO332 .高温煅烧石灰石(工业制二氧化碳):CaCO3高温CaO+CO2 T33 .石灰水与二氧化碳反应(鉴别二氧化碳):Ca(OH)2+CO2===CaCO3 >H2O(4)一氧化碳的性质:34 .一氧化碳还原氧化铜:CO+CuO加热Cu+CO235 .一氧化碳的可燃性:2CO+O2点燃2CO2其它反应:36 .碳酸钠与稀盐酸反应(灭火器的原理):Na2CO3+2HCI==2NaCI+H2O+CO2 T五、燃料及其利用:37 .甲烷在空气中燃烧:CH4+2O2点燃CO2+2H2O38 .酒精在空气中燃烧:C2H5OH+3O2 点燃2CO2+3H2O39 .氢气中空气中燃烧:2H2+O2 点燃2H2O六、金属(1)金属与氧气反应:40 .镁在空气中燃烧:2Mg+O2 点燃2MgO41 .铁在氧气中燃烧:3Fe+2O2点燃Fe3O442. 铜在空气中受热:2Cu+O2加热2CuO43. 铝在空气中形成氧化膜:4AI+3O2=2AI2O3(2 )金属单质+酸------ 盐+氢气(置换反应)44. 锌和稀硫酸Zn+H2SO4=ZnSO4+H2 T45. 铁和稀硫酸Fe+H2SO4=FeSO4+H2 T46. 镁和稀硫酸Mg+H2SO4=MgSO4+H2 T47. 铝和稀硫酸2AI+3H2SO4=AI2(SO4)3+3H2 T48. 锌和稀盐酸Zn+2HCI==ZnCI2+H2 T49. 铁和稀盐酸Fe+2HCI==FeCI2+H2 T50. 镁和稀盐酸Mg+2HCI==MgCI2+H2 T51 .铝和稀盐酸2AI+6HCI==2AICI3+3H2 T(3 )金属单质+盐(溶液) -------- 新金属+新盐52. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu53. 锌和硫酸铜溶液反应:Zn+CuSO4==ZnSO4+Cu54. 铜和硝酸汞溶液反应:Cu+Hg(NO3)2==Cu(NO3)2+Hg (3)金属铁的治炼原理:55 . 3CO+2Fe2O3 高温4Fe+3CO2 T七、酸、碱、盐1、酸的化学性质(1 )酸+金属------ 盐+氢气(见上)(2 )酸+金属氧化物------ 盐+水56. 氧化铁和稀盐酸反应:Fe2O3+6HCI==2FeCI3+3H2O57. 氧化铁和稀硫酸反应:Fe2O3+3H2SO4==Fe2(SO4)3+3H2O58. 氧化铜和稀盐酸反应:CuO+2HCI==CuCI2+H2O59. 氧化铜和稀硫酸反应:CuO+H2SO4==CuSO4+H2O(3 )酸+碱------ 盐+水(中和反应)60 .盐酸和烧碱起反应:HCI+NaOH==NaCI+H2O61. 盐酸和氢氧化钙反应:2HCI+Ca(OH)2==CaCI2+2H2O62. 氢氧化铝药物治疗胃酸过多:3HCI+AI(OH)3==AICI3+3H2O63. 硫酸和烧碱反应:H2SO4+2NaOH==Na2SO4+2H2O(4 )酸+盐------ 另一种酸+另一种盐64 .大理石与稀盐酸反应:CaCO3+2HCI==CaCI2+H2O+CO2 T65 .碳酸钠与稀盐酸反应:Na2CO3+2HCI==2NaCI+H2O+CO2 T66. 碳酸氢钠与稀盐酸反应:NaHCO3+HCI==NaCI+H2O+CO2 T67. 硫酸和氯化钡溶液反应:H2SO4+BaCI2==BaSO4 >2HCI2、碱的化学性质(1 )碱+非金属氧化物------ 盐+水68 .苛性钠暴露在空气中变质:2NaOH+CO2==Na2CO3+H2O69 .苛性钠吸收二氧化硫气体:2NaOH+SO2==Na2SO3+H2O70 .苛性钠吸收三氧化硫气体:2NaOH+SO3==Na2SO4+H2O71 .消石灰放在空气中变质:Ca(OH)2+CO2==CaCO3 J+H2O72. 消石灰吸收二氧化硫:Ca(OH)2+SO2==CaSO3 J+H2O(2 )碱+酸------ 盐+水(中和反应,方程式见上)(3)碱+盐 ------ 另一种碱+另一种盐73. 氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3 >2NaOH3、盐的化学性质(1 )盐(溶液)+金属单质——另一种金属+另一种盐74. 铁和硫酸铜溶液反应:Fe+CuSO4==FeSO4+Cu(2 )盐+酸------ 另一种酸+另一种盐75 .碳酸钠与稀盐酸反应:Na2CO3+2HCI==2NaCI+H2O+CO2 T碳酸氢钠与稀盐酸反应:NaHCO3+HCI==NaCI+H2O+CO2 T(3 )盐+碱------ 另一种碱+另一种盐76.氢氧化钙与碳酸钠:Ca(OH)2+Na2CO3==CaCO3 >2NaOH(4 )盐+盐-----两种新盐77 .氯化钠溶液和硝酸银溶液:NaCI+AgN03==AgCI >NaNO378 .硫酸钠和氯化钡:Na2SO4+BaCI2==BaSO4 J+2NaCI钾钠硝铵均可溶,盐酸盐不溶AgCI,硫酸盐不溶BaSO4,碳酸盐能溶钾钠铵,钾钠钙钡可溶碱。
溶解性口诀一钾钠铵盐溶水快,①硫酸盐除去钡铅钙。
②氯化物不溶氯化银,硝酸盐溶液都透明。
③口诀中未有皆下沉。
④注:①钾钠铵盐都溶于水;②硫酸盐中只有硫酸钡、硫酸铅、硫酸钙不溶;③硝酸盐都溶于水;④口诀中没有涉及的盐类都不溶于水;溶解性口诀二钾、钠、铵盐、硝酸盐;氯化物除银、亚汞;硫酸盐除钡和铅;碳酸、磷酸盐,只溶钾、钠、铵。
溶解性口诀三钾钠铵硝皆可溶、盐酸盐不溶银亚汞;硫酸盐不溶钡和铅、碳磷酸盐多不溶。
多数酸溶碱少溶、只有钾钠铵钡溶溶解性口诀四钾、钠、硝酸溶,(钾盐、钠盐和硝酸盐都溶于水。
)盐酸除银(亚)汞,(盐酸盐里除氯化银和氯化亚汞外都溶。
)再说硫酸盐,不容有钡、铅,(硫酸盐中不溶的是硫酸钡和硫酸铅。
)其余几类盐,(碳酸盐、亚硫酸盐、磷酸盐、硅酸盐和硫化物)只溶钾、钠、铵,(只有相应的钾盐、钠盐和铵盐可溶)最后说碱类,钾、钠、铵和钡。
(氢氧化钾、氢氧化钠、氢氧化钡和氨水可溶)溶解性口诀五钾钠铵盐硝酸盐完全溶解不困难氯化亚汞氯化银硫酸钡和硫酸铅生成沉淀记心间氢硫酸盐和碱类碳酸磷酸硝酸盐可溶只有钾钠铵。