羰基化合物的α-烷基化和催化烷基化反应
- 格式:ppt
- 大小:607.00 KB
- 文档页数:72



羰基阿尔法位烷基化
羰基阿尔法位烷基化(β-Ketoenol α-Alkylation)是一种化学反应,由羰基酯与叔丁基烷基或三甲基烷基反应构建羰基阿尔法烷基产物。
羰基阿尔法位烷基化反应主要用于有机合成中,是合成羰基烯、烷、醇、酮和天冬酰脲等化合物的重要化学路线。
本反应是加成反应,生成的烯化合物易于形成对称的酮、醇等合成中间体。
羰基阿尔法位烷基化反应的催化剂主要有两类,一种是活性羰基酸催化剂(如金,铂,等),另一种是以碘化物为活性位点的热稳定催化剂。
在羰基阿尔法位烷基化反应中,活性羰基酸催化剂和热稳定催化剂的机理是一样的,都是羰基酯的活化,使叔丁基烷基或三甲基烷基可以与它发生反应。
羰基酯的活化会改变它的结构,促使叔丁基烷基或三甲基烷基发生加成反应,形成羰基阿尔法位烷基。
然而,这种反应受到温度和酸催化剂水溶液的影响,当反应体系受任何一种影响时,反应产物易发生水解而产生羰基醛,因此温度和pH值需要调节以得到所需的反应效果。
羰基阿尔法位烷基化反应是重要的合成路线,其中活性羰基酸催化剂和热稳定催化剂都很有效,可以合成多种化合物、中间体和介电材料。
此外,在复杂反应体系中,可以进行多步反应,形成更复杂的有机物。



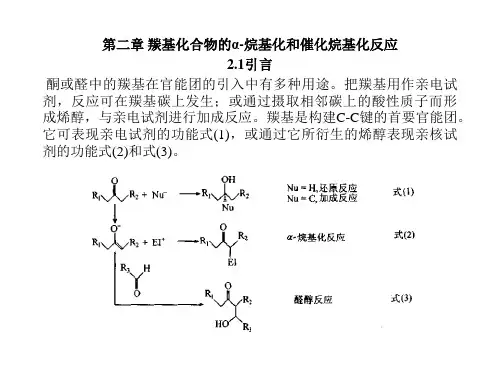
烷基化反应有机化合物分子中连在碳、氧和氮上的氢原子被烷基所取代的反应。
碳原子上的烷基化①羰基的a碳上氢的烷基化。
羰基的a碳上的氢呈弱酸性,羰基的a碳原子在强碱(如氨基钠、氢化钠)的作用下,能与卤代烷发生烷基化反应,生成a碳烷基化产物:酮和酯的直接烷基化会发生自身缩合;也会发生多烷基化反应。
要获得a-碳单烷基化产物,可用四氢吡咯、吗啉等仲胺制成烯胺,再与活泼的卤代烷(碘甲烷、卤代苄等)反应,生成取代的烯胺,经水解即得烷基化的羰基化合物:②活泼亚甲基的烷基化。
处于两个活性基团之间的亚甲基比较活泼,在醇钠作用下容易烷基化。
活性基团可以是硝基、羰基、酯基或氰基等。
例如取代的丙二酸酯合成法和乙酰乙酸酯合成法:H2C(COOC2H5)2+C2H5O-Na+CH(COOC2H5)2-Na++C2H5OHCH(COOC2H5)2-Na+RXRCH(COOC2H5)2+NaXCH3COCH2COOC2H5+C2H5O-Na+(CH3COCHCOOC2H5)-Na++C2H5OH式中R为烷基;X为卤素。
取代的丙二酸酯、乙酰乙酸酯水解后容易脱羧、分解成取代乙酸或酮,此反应广泛用于有机合成。
这些烷基化反应都是在无水条件下进行的。
③相转移催化的烷基化。
利用相转移催化剂使处于两个互不相溶的液相系统中的反应物进行反应。
无需在无水条件下操作,可以用浓氢氧化钠水溶液代替无水醇钠。
反应条件温和,操作简便。
常用的催化剂有四级铵盐(Q+X-),如(n-C4H9)4N+HSO4-、四级磷盐[(C2H5)3P+CH2C6H5]Cl-或冠醚等。
反应物于界面处与碱作用,生成负碳离子。
后者与四级铵盐正离子形成离子对,转移到有机相中,与卤代烷进行烷基化反应。
例如:氧原子上的烷基化醇钠与卤代烷反应生成醚,这是合成不对称醚的重要方法:RONa+R′XROR′+NaX酚的酸性较醇强,采用氢氧化钠可生成芳香氧负离子,然后进行烷基化。
例如:硫酸二酯类也是常用的烷基化试剂,其活性比卤代烷高,反应条件温和,一般只有一个烷基参加反应。


有机化学基础知识点整理烷基化反应与烷化反应机制【有机化学基础知识点整理】烷基化反应与烷化反应机制烷基化反应是有机化学中一类重要的反应,主要涉及底物中的氢原子被烷基基团取代的过程。
烷化反应机制则是指在此类反应中所形成的反应中间体和过渡态的详细变化过程。
本文将整理烷基化反应的几个基础知识点,并探讨其中常见的烷化反应机制。
一、烷基化反应的基本概念烷基化反应是有机化学中最为常见和广泛应用的一类反应,其中最常见的就是烷基磺酸盐的合成。
其原理是通过引入一个“烷基基团”,将底物中的氢原子取代。
烷基化反应可以形成新的碳-碳键或碳-氧键,产生新的有机化合物。
二、烷基化反应的分类烷基化反应根据反应过程的类型和反应底物的不同,可以分为以下几类:1.质子接受型烷基化反应:底物中的质子被烷基离子或烷基金属试剂取代。
2.质子捐赠型烷基化反应:底物中的烷基基团将质子给予另一分子,形成新的碳-碳键。
3.亲电取代型烷基化反应:底物中的亲电试剂与烷基基团发生亲电取代反应。
4.自由基烷基化反应:底物中的烷基离子与自由基试剂发生反应,形成新的碳-碳键。
三、常见的烷化反应机制1.质子接受型烷基化反应机制:在质子接受型烷基化反应中,底物中的质子被烷基离子或烷基金属试剂取代。
这类反应通常采用强碱作为反应试剂,如氢氧化钠(NaOH)。
反应机理如下:底物 + 烷基离子/烷基金属试剂→ 产物 + 相应的离子/金属盐该反应机制属于亲核取代反应,质子首先被碱中的氢氧根离子去质子化,然后进一步与烷基离子或金属离子发生亲核取代反应,最终形成新的碳-碳键。
2.自由基烷基化反应机制:在自由基烷基化反应中,底物中的烷基离子与自由基试剂发生反应,形成新的碳-碳键。
这类反应通常通过热、光或自由基引发剂来产生自由基,如过氧化氢(H2O2)或过氧化苯甲酰(Benzoyl peroxide)。
反应机理如下:底物 + 自由基试剂→ 产物该反应机制属于自由基取代反应,首先由自由基引发剂产生自由基,然后自由基与底物反应,形成新的碳-碳键。
![[理学]第六章 羰基化合物的反应](https://uimg.taocdn.com/f28edb13f111f18583d05a59.webp)

叔丁醇钾做羰基α位烷基化
叔丁醇钾可以用来进行羰基α位烷基化反应。
这个反应是通过在叔丁醇钾存在下与醛或酮反应,将烷基基团连接到羰基化合物的α位。
反应机理一般涉及到以下几个步骤:
1. 叔丁醇钾通过失去一个甲基离子生成 tert-BuO-。
2. tert-BuO-攻击羰基化合物的α位,形成一个负离子中间体。
3. 中间体经过质子转移生成碳碳键。
4. 质子化生成产物。
这个反应通常在室温下进行,由于叔丁醇钾具有较高的碱性,可以加速反应的进行。
此外,反应选择性较高,可以通过调整反应条件和底物结构来实现所需产物的选择。
1、药物合成工艺路线设计方法:类型反应法分子对称法追溯求源法模拟类推法2、类型反应法:指利用常见的典型有机化学与合成方法进行合成路线设计的方法。
分子对称法:具有分子对称性的化合物往往由两个相同的分子经化学合成反应制得,或可以在同一步反应中将分子的相同部分同时构建起来。
追溯求源法(倒推法、逆向合成分析):从药物分子的化学结构出发,将其化学合成过程一步一步逆向推导进行寻缘的思考方法。
模拟类推法:从初步的设想开始,通过文献调研,改进他人尚不完善的概念和方法来进行药物工艺路线设计。
3、平顶型反应:反应条件易于控制,可减轻操作人员的劳动强度。
P39 图2-1尖顶型反应:反应条件苛刻,条件稍有变化收率就会下降;与安全生产技术、三废防治、设备条件等密切相关。
4、一勺烩(一锅合成):在合成步骤改变中,若一个反应所用的溶剂和产生的副产物对下一步反应影响不大时,可将两步或几步反应按顺序,不经分离,在同一反应罐中进行,习称“一勺烩”5、常见的设备材质:铁、铸铁、搪玻璃、陶瓷、不锈钢6、①可逆反应:特点:正反应速率随时间逐渐减少,逆反应速率随时间逐渐增大,直到两个反应速率相等,反应物和生成物浓度不再随时间而发生变化。
可以用移动方法来破坏平衡,以利于正反应的进行,即设法改变某一物料的浓度来控制反应速率。
平行反应(竞争性反应):级数相同的平行反应,其反应速率之比为一定常数,与反应物浓度及时间无关。
即不论反应时间多长,各生成物的比例是一定的。
可通过改变温度、溶剂、催化剂等来调节生成物的比例。
②工业生产的合适配料比确定:A凡属可逆反应,可采取增加反应物之一的浓度(即增加其配料比),或从反应系统中不断除去生成物之一的办法,以提高反应速率和增加产物的收率。
B当反应生成物的生成量取决于反应液中某一反应物的浓度时,则增加其配料比。
C倘若反应中,有一反应物不稳定,则可增加其用量,以保证有足够量的反应物参与反应。
D当参与主、副反应的反应物浓度不尽相同时,利用这一差异,增加某一反应物的用量,以增加主反应的竞争能力。
一、概述羰基的加成反应是有机化学中一种重要的反应类型,具有广泛的应用价值。
本文将探讨羰基的加成反应在有机合成中的应用。
二、羰基的加成反应基本原理1. 羰基的结构特点羰基是含有碳氧双键的有机化合物官能团,一般表示为“C=O”。
羰基通常分为醛、酮和羧酸三种类型,它们具有较强的电性,是有机合成中常见的反应物和产物。
2. 羰基的加成反应羰基的加成反应是指具有亲核试剂(如胺、醇等)与羰基发生亲核加成反应,形成加成产物的过程。
这种反应通常在碱性或酸性条件下进行,产物可以是醇、醛、酮、羧酸等化合物。
三、羰基的加成反应在有机合成中的应用1. 羰基的还原羰基的加成反应可用于醛酮的还原反应,常见的还原试剂有金属氢化物(如氢化钠、氢化铝锂等)和还原醇(如醇、胺等)等。
借助该反应,可以将醛酮还原为相应的醇,扩大有机合成的应用范围。
2. 羰基的羟化反应在羰基的加成反应中,羟胺(氨和水的混合物)可以与醛酮发生羟化反应,形成羟醇。
这种反应被广泛应用于药物合成和其他有机合成领域,具有重要的化学和生物活性。
3. 羰基的羟胺加成在温和的酸性条件下,羟胺可以与羰基形成加成产物。
该反应常用于合成β-羟基酮或β-羟基醛的过程中,产物可以进一步转化为药物分子或生物活性分子。
4. 羰基的羟胺甲酰化在适当的反应条件下,羰基与羟胺发生甲酰化反应,生成羰基甲酰胺。
这种反应在药物合成和有机合成中具有重要的应用价值,可以构建含氨基酰胺结构的化合物。
5. 羰基的醇加成在碱性条件下,醇可以与羰基形成加成产物。
这种反应常用于合成醛醇或酮醇的过程中,产物在有机合成中具有重要的应用价值。
6. 羰基的氧化反应在适当的氧化条件下,羰基可以与氧化剂发生氧化反应,形成羧酸。
这种反应在生物活性分子或有机合成中具有重要的应用价值。
7. 羰基的胺加成在适当的酸性条件下,胺可以与羰基形成加成产物。
这种反应在合成酰胺类化合物中具有重要的应用价值,是有机合成中一种有效的方法。
四、结论羰基的加成反应在有机合成中具有广泛的应用价值,可以用于合成各种类型的有机化合物,包括醇、醛、酮、羧酸等。
有机物α位β位γ位有机物是指由碳、氢、氧、氮、硫等元素组成的化合物,它们广泛存在于自然界中,包括生物体内和地球表面的各种环境中。
有机物的结构复杂多样,其中的一些特定位置对于它们的性质和用途具有重要影响。
本文将着重介绍有机物中的α位、β位和γ位,以及它们在有机化学中的重要性。
α位是有机物中最重要的位置之一,它指的是与官能团相连的碳原子上的那个碳原子。
这个位置的化学性质通常比较稳定,因为它与官能团之间有较强的σ键作用力。
许多有机反应中,α位是反应的主要位置,因为它的反应性较高。
例如,酮类化合物在酸性条件下会发生α位羟基化反应,生成α-羟基酮。
这个反应可以通过羰基化合物的质子化来促进。
此外,α位还可以进行α-取代反应,例如通过酸催化或金属催化剂促进的α-烷基化和α-芳基化反应。
β位是与α位相邻的碳原子位置,也是有机化学中非常重要的位置之一。
β位的性质通常比α位更加活泼,因为它与α位之间的碳-碳单键比较弱,容易发生断裂。
在许多有机反应中,β位是反应的次要位置。
例如,α-烯酸酯在酸性条件下可以进行β-消除反应,生成烯烃。
这个反应可以通过β位的质子化来促进。
此外,β位还可以进行β-取代反应,例如通过金属催化剂促进的β-烷基化和β-芳基化反应。
γ位是与β位相邻的碳原子位置,它的化学性质比α位和β位更加不稳定。
在许多有机反应中,γ位往往是反应的次次要位置。
例如,酮类化合物在酸性条件下可以发生γ-位羟基化反应,生成γ-羟基酮。
这个反应可以通过酮类化合物的质子化来促进。
此外,γ位还可以进行γ-取代反应,例如通过金属催化剂促进的γ-烷基化和γ-芳基化反应。
有机物中的α位、β位和γ位在有机化学中具有重要的意义。
它们可以通过特定的反应进行取代或转化,从而改变有机物的性质和用途。
例如,α-烯酸酯的β-消除反应可以用于制备烯烃,这些烯烃可以用于制备聚合物和医药中间体。
γ-位羟基化反应可以用于合成γ-羟基酮,这些化合物具有抗病毒和抗癌活性。
作者: 刘永红;刘晓岚
作者机构: 兰州大学化学系3023信箱
出版物刊名: 天水师范学院学报
页码: 36-57页
主题词: 烷基化反应;羰基化合物;不对称;高立体选择性;手性试剂;光学产率;化学产率;有机合成;手性中心;Michael加成反应
摘要: 本文从羰基化合物α—碳的不对称烷基化所采用的方法(采用手性及潜手性试剂、底物,手性熔剂,手性催化剂以及为提高光学产率而采用空间体积大的骨架、引入抗衡离子、引入螫合环稳定构型或构象等等)为出发点,根据此类反应中间体的特点,把1988年至1994年间羰基化合物α—碳的不对称烷基化分为:通过锂、钠、钾、锌、钛等金属的烯醇盐,通过烯醇硫盐,通过烯醇硅醚,以及通过烯胺、亚胺、腙等含氮有机化合物为中间体等四部分进行简要的评述.。