第四章羰基化合物的反应及碳负离子
- 格式:ppt
- 大小:4.33 MB
- 文档页数:100


![羰基化合物[精品ppt课件]](https://uimg.taocdn.com/dbc0b4ce04a1b0717fd5dd58.webp)







碳负离子在有机合成中的应用翟迈豪化基7班 2013301040201摘要:在某些有机化学反应中,经常遇到C-H键的断裂的情形,裂解出来的质子为反应体系中的碱或Lewis碱所接受,所留下来的+3价的碳原子像胺类化合物一样带有一对孤对电子,这就是碳负离子。
本文综述了碳负离子的各类反应,反应机理及其在有机合成中的应用,并对一些反应做出了必要的分析。
关键词:碳负离子反应有机合成应用一、碳负离子的形成1.碳氢酸脱质子作用2.亲核试剂对活性烯烃的加成作用3.活性烯烃亲核反应逆反应逆的Michael加成、逆羟醛缩合、逆的Claisen酯缩合,都是由碱引起了原来缩合反应的逆反应而重新生成反应物和碳负离子4.还原金属化作用烷基和芳基锂化物及格氏试剂都象碳负离子那样起作用,在醚溶液中它们成离子对形式而存在5.溶解金属还原(自由基反应)金属溶解时就发生电子加成作用,首先形成负离子基,然后形成双负离子。
二、碳负离子的反应1.亲核加成反应(包括加成-消除反应)(1)羟醛缩合反应在碱的催化作用下,一分子带有α-氧的酸或酮失去质子形成碳负离子,与另一分子酸或酮发生亲核加成反应生成β-经基醛或酮,然后在高温或者强酸/碱条件下脱水而生成α,β-不饱和酸酮。
(2)普尔金(Perkin)反应由不含有α-H的芳香醛(如苯甲醛)在强碱弱酸盐(如碳酸钾、醋酸钾等)的催化下,与含有α-H的酸酐(如乙酸酐、丙酸酐等)所发生的缩合反应,并生成α,β-不饱和羧酸盐,后者经酸性水解即可得到α,β-不饱和羧酸。
(3)脑文格(Knoevenagel)反应在Perkin反应的基础上进行了改进,把产生碳负离子的酸酐换成带有吸电子基的活泼亚甲基化合物,碱由羧酸盐改为有机碱(如吡啶、六氢吡啶、一级胺、二级胺等),溶剂一般为苯和甲苯,反应得到α,β-不饱和化合物。
弱碱的使用避免了醛、酮等化合物自身羟醛缩合副反应发生,因此优化条件后底物的范围得到极大的拓展,芳香醛,酮,脂肪醛均能够发生反应。
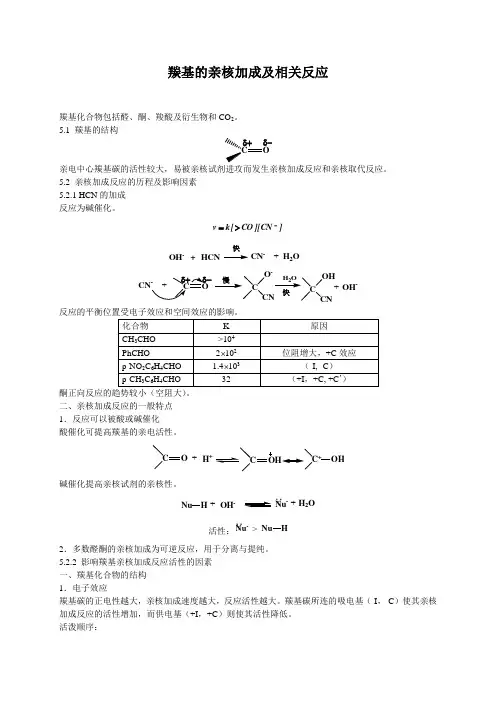
羰基的亲核加成及相关反应羰基化合物包括醛、酮、羧酸及衍生物和CO 2。
5.1 羰基的结构CO δ+δ-亲电中心羰基碳的活性较大,易被亲核试剂进攻而发生亲核加成反应和亲核取代反应。
5.2 亲核加成反应的历程及影响因素 5.2.1 HCN 的加成 反应为碱催化。
]CN ][CO [k v ->=OH -+HCNCN -+ H 2O快-COδ+δ-CO -CNCOHCN+OH - 反应的平衡位置受电子效应和空间效应的影响。
酮正向反应的趋势较小(空阻大)。
二、亲核加成反应的一般特点 1.反应可以被酸或碱催化酸催化可提高羰基的亲电活性。
CO +H ++OH碱催化提高亲核试剂的亲核性。
NuH +OH --+H 2ONu H ->2.多数醛酮的亲核加成为可逆反应,用于分离与提纯。
5.2.2 影响羰基亲核加成反应活性的因素 一、羰基化合物的结构 1.电子效应羰基碳的正电性越大,亲核加成速度越大,反应活性越大。
羰基碳所连的吸电基(-I ,-C )使其亲核加成反应的活性增加,而供电基(+I ,+C )则使其活性降低。
活泼顺序:ClCHO > HCHO > RCHO > CH 3COR > RCOOR' > RCONR'2 > RCOO --I > +C(+C)(+C,空阻)( +C > -I)(+C)CO RR'活性极低(1)π-π共轭效应(增加其稳定性);(2)+C 效应(降低羰基碳的正电性);(3)加成产物失去共轭能,反应活化能高;(4)产物的张力大幅增加。
2.立体效应CO -sp 2活性:O CHH OC CH 3H OC CH 3CH 3O OC CH 3CH 2CH 2CH 3OC Ph Ph>>>>>二、试剂的亲核性对同一羰基化合物,试剂的亲核性越大,平衡常数越大,亲核加成越容易。
1.带负电荷的亲核试剂比起共轭酸(中性分子)的亲核性强。
碳负离⼦在有机合成中的应⽤碳负离⼦在有机合成中的应⽤翟迈豪化基7班 2013301040201摘要:在某些有机化学反应中,经常遇到C-H键的断裂的情形,裂解出来的质⼦为反应体系中的碱或Lewis碱所接受,所留下来的+3价的碳原⼦像胺类化合物⼀样带有⼀对孤对电⼦,这就是碳负离⼦。
本⽂综述了碳负离⼦的各类反应,反应机理及其在有机合成中的应⽤,并对⼀些反应做出了必要的分析。
关键词:碳负离⼦反应有机合成应⽤⼀、碳负离⼦的形成1.碳氢酸脱质⼦作⽤2.亲核试剂对活性烯烃的加成作⽤3.活性烯烃亲核反应逆反应逆的Michael加成、逆羟醛缩合、逆的Claisen酯缩合,都是由碱引起了原来缩合反应的逆反应⽽重新⽣成反应物和碳负离⼦4.还原⾦属化作⽤烷基和芳基锂化物及格⽒试剂都象碳负离⼦那样起作⽤,在醚溶液中它们成离⼦对形式⽽存在5.溶解⾦属还原(⾃由基反应)⾦属溶解时就发⽣电⼦加成作⽤,⾸先形成负离⼦基,然后形成双负离⼦。
⼆、碳负离⼦的反应1.亲核加成反应(包括加成-消除反应)(1)羟醛缩合反应在碱的催化作⽤下,⼀分⼦带有α-氧的酸或酮失去质⼦形成碳负离⼦,与另⼀分⼦酸或酮发⽣亲核加成反应⽣成β-经基醛或酮,然后在⾼温或者强酸/碱条件下脱⽔⽽⽣成α,β-不饱和酸酮。
(2)普尔⾦(Perkin)反应由不含有α-H的芳⾹醛(如苯甲醛)在强碱弱酸盐(如碳酸钾、醋酸钾等)的催化下,与含有α-H的酸酐(如⼄酸酐、丙酸酐等)所发⽣的缩合反应,并⽣成α,β-不饱和羧酸盐,后者经酸性⽔解即可得到α,β-不饱和羧酸。
(3)脑⽂格(Knoevenagel)反应在Perkin反应的基础上进⾏了改进,把产⽣碳负离⼦的酸酐换成带有吸电⼦基的活泼亚甲基化合物,碱由羧酸盐改为有机碱(如吡啶、六氢吡啶、⼀级胺、⼆级胺等),溶剂⼀般为苯和甲苯,反应得到α,β-不饱和化合物。
弱碱的使⽤避免了醛、酮等化合物⾃⾝羟醛缩合副反应发⽣,因此优化条件后底物的范围得到极⼤的拓展,芳⾹醛,酮,脂肪醛均能够发⽣反应。