第七章羰基化合物的反应
- 格式:ppt
- 大小:3.47 MB
- 文档页数:104






高等有机化学第七章亲核加成反应食品学院应用化学系郑福平杨绍祥第七章亲核加成反应一、碳-碳双键的亲核加成反应二、碳-碳三键的亲核加成反应三、羰基亲核加成反应四、羧酸衍生物与亲核试剂的反应五、金属氢化物与羰基的亲核加成反应六、α,β-不饱和羰基化合物的亲核加成反应七、碳-氮重键的亲核加成反应八、分子内的自催化亲核加成反应2一、碳吸电子取代基(一)氰乙基化反应(二)Micheal二、碳C CC正电荷处于p轨道属于杂化碳电负性大,难以容纳正电荷。
叁键比双键易于亲核加成的原因1. 碳原子杂化状态不同。
叁键碳sp杂化,双键碳sp2杂化。
叁键碳s轨道成分多,电子云更靠近原子核,不易给出电子,易接受电子。
2. 亲核加成活性中间体稳定性不同。
决定性作用。
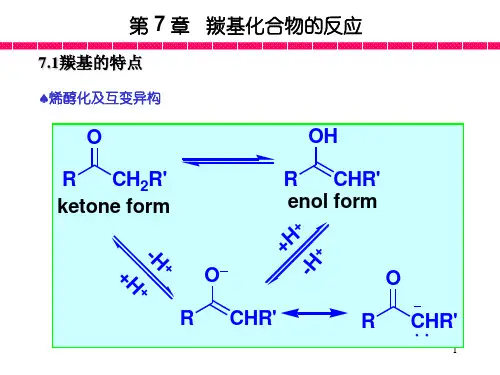
12三、羰基亲核加成反应15(一)羰基的亲核加成反应历程酸除了使羰基质子化外,还能与羰基形成氢键:2注意:不论是酸还是碱催化的反应,控制反应速度的一步都是亲核试剂进攻碳原子这一步,故它们都是亲核加成。
19(二)影响羰基亲核加成反应的因素当(2)2.(3)(三)羰基加成反应中立体化学(四)羰基化合物的亲核加成反应实例1、杂原子亲核试剂的加成除NaHSO外,一般K<1。
3许多羰基化合物与含杂原子亲核试剂发生不同程度的加成。
半缩醛(酮)天然产物中有重要作用。
链状K<1,环状K>1(葡萄糖,开链式占0.003%,主要以α和β-吡喃环式存在。
)31①39醛:第一步负碳离子的生成为速控步骤,第二步为快反应,第一步不可逆。
酮:速控步骤为第二步。
C -进攻酮比进攻醛羰基碳难得多。
碱催化利于有醛的缩合,而不利于酮的缩合。
②四、羧酸衍生物与亲核试剂的反应(二)结构与活性的关系作为酰基化试剂,其活性为:RCOCl>RCOSR'>(RCO)2O>RCOOR>RCONH2 X: 具有-I效应,C-Cl键的极性大。
酯中烷氧基具有+C效应,增大了酰基与烷氧基间的电子云密度,使酰氧键难于断裂。

第七章 醛酮醌思考与练习7-1 写出分子式为C 5H 10O 的醛、酮的所有异构体。
7-2 命名下列化合物。
⑴ 2,4-二甲基己醛 ⑵ 5-甲基-4-己烯-3-酮 ⑶ 1-环己基-2-丙酮 ⑷ 4-苯基-2-戊烯醛 ⑸ 3-氯-2,5-己二酮 ⑹β-萘甲醛 7-3 写出下列化合物的构造式。
⑴ ⑵ ⑶⑷ ⑸ ⑹7-4 试用合适的原料合成下列化合物。
可用相应醇氧化或用付—克酰基化反应制得。
7-5 将下列化合物的沸点按由高到低的顺序排列,并说明理由。
丙醇>丙酮>甲乙醚>丙烷 主要考虑:有无氢键形成和分子极性的大小。
7-6 乙醛能与水混溶,而正戊醛则微溶于水,为什么?低级醛和酮在水中有相当大的溶解度,这是因为醛和酮分子中羰基上的氧原子可以与水分子中的氢原子形成氢键。
但随着分子中碳原子数的增加,羰基在分子中所占的比例减小,形成氢键难度加大,醛和酮在水中溶解度也逐渐减小。
7-7 羰基化合物和哪些试剂容易发生加成反应?遵循什么规律?羰基化合物与HCN 、NaHSO 3、ROH 、RMgX 、H 2N-Y 等试剂易发生加成反应。
遵循亲核加成反应规律,即羰基中的碳原子形成反应的正电中心,受到亲核试剂的进攻。
7-8在与氢氰酸加成反应中,丙酮和乙醛哪一个反应比较快?为什么?乙醛快;比较醛和酮羰基加成反应的难易,通常考虑两个方面:①由于烷基的给电性,羰基上连接的烷基越多,给电性越强,羰基碳原子正电性越小,越不利于亲核试剂的进攻,使得加成反应速度减慢。
②羰基上连接的烃基越大,则位阻效应越大,亲核试剂就越不容易接近,反应也不易进行。
所以在许多亲核加成反应中,酮一般不如醛活泼。
7-9 醛和酮与格氏试剂加成反应主要适用于哪些物质的合成?醛和酮与格氏试剂(RMgX )加成,可生成比原来醛或酮增加了碳原子的伯、仲、叔醇。
7-10 下列化合物哪些能和HCN 发生加成反应?并写出其反应产物。
⑴、⑵、⑶、⑸; ⑴CH 3CH 2CH 2CH 2CHOCH 3CH 2CHCHOCH 3CH 3CHCH 2CHOCH 3CH 3C CH 3CH 3CHOCH 3C O CH 2CH 2CH 3CH 3C O CHCH 3CH 3CH 3CHCH 2CHO 3CH CHCHOOC 2H 5CH 3CH 3CH 3CH CHCHBr C OCH 3CHO OHCH 2C O OHCH 2CHCH 2CHO CH 2CHCH 2CHCN CH 3CH 2CCH 2CH 3O⑵ ⑶⑸7-11 丙酮中混有少量丙醛,如何提纯丙酮。

一、名词解释1.氧化反应:有机化合物分子中,凡失去电子或电子偏移,使碳原子上电子密度降低的反应称为氧化反应。
狭义地说,是指化合物分子增加氧或失去氢的反应,或两者兼而有之。
2. 沃氏氧化反应:仲醇或伯醇在异丙醇铝催化下,用过量酮(丙酮或环己酮等)作为电子受体,可被氧化成相应的羰基化合物,该反应成为沃氏氧化反应。
3.消除反应: 从一个有机化合物分子中同时除去两个基团(或原子)而形成一个新的分子的反应称为消除反应。
4.达参反应:邻位或对位有羟基的芳醛或芳酮,在碱性条件下用过氧化氢氧化生成多羟基化合物的反应称为达参反应。
5.沃氏氧化反应(Oppenauer氧化):仲醇或伯醇在异丙醇铝催化下,用过量酮(丙酮或环己酮等)作为电子受体,可被氧化成相应的羰基化合物,该反应成为沃氏氧化反应。
二、填空题1. 高锰酸盐为强氧化剂,在酸性、中性及碱性条件下均能起氧化作用。
常在中性或碱性溶液中使用。
2. 过量的高锰酸钾可以用亚硫酸钠等还原剂将其分解掉。
过滤,除去不溶性的二氧化锰后,将羧酸盐的水溶液用无机酸酸化,即可得到较纯净的产物。
3. 重铬酸钠容易潮解,但是比重铬酸钾的价格便宜得多,在水中的溶解度大,故在工业上应用广泛。
目前,由于重铬酸盐价格较贵,含铬废液的处理费用较高,因此已逐渐被其他氧化法所代替。
4. 三氧化铬—吡啶络合物又称为Collins试剂,其制备方法是将一份三氧化铬缓慢分次加入10份吡啶中,逐渐提高温度至30℃,最后得到黄色络合物,将三氧化铬—吡啶络合物从吡啶中分离出来,干燥后再溶于二氯甲烷中组成溶液。
它于无水条件下氧化醇,可得收率较高的醛或酮。
5. 过氧化氢俗称双氧水,是一种缓和氧化剂,其最大特点是反应后不残留杂质,因而产品纯度高。
市售的过氧化氢试剂通常浓度为30%,它的氧化反应可在中性、酸性和碱性或催化剂存在下进行。
过氧化氢最大优点是在反应完成后本身变成水,无有害残留物。
但是过氧化氢不够稳定,只能在低温下使用,这就限制了它的使用范围。

高等有机化学第七章亲核加成反应食品学院应用化学系郑福平杨绍祥第七章亲核加成反应一、碳-碳双键的亲核加成反应二、碳-碳三键的亲核加成反应三、羰基亲核加成反应四、羧酸衍生物与亲核试剂的反应五、金属氢化物与羰基的亲核加成反应六、α,β-不饱和羰基化合物的亲核加成反应七、碳-氮重键的亲核加成反应八、分子内的自催化亲核加成反应2一、碳吸电子取代基(一)氰乙基化反应(二)Micheal二、碳C CC正电荷处于p轨道属于杂化碳电负性大,难以容纳正电荷。
叁键比双键易于亲核加成的原因1. 碳原子杂化状态不同。
叁键碳sp杂化,双键碳sp2杂化。
叁键碳s轨道成分多,电子云更靠近原子核,不易给出电子,易接受电子。
2. 亲核加成活性中间体稳定性不同。
决定性作用。
12三、羰基亲核加成反应15(一)羰基的亲核加成反应历程酸除了使羰基质子化外,还能与羰基形成氢键:2注意:不论是酸还是碱催化的反应,控制反应速度的一步都是亲核试剂进攻碳原子这一步,故它们都是亲核加成。
19(二)影响羰基亲核加成反应的因素当(2)2.(3)(三)羰基加成反应中立体化学(四)羰基化合物的亲核加成反应实例1、杂原子亲核试剂的加成除NaHSO外,一般K<1。
3许多羰基化合物与含杂原子亲核试剂发生不同程度的加成。
半缩醛(酮)天然产物中有重要作用。
链状K<1,环状K>1(葡萄糖,开链式占0.003%,主要以α和β-吡喃环式存在。
)31(2)①39醛:第一步负碳离子的生成为速控步骤,第二步为快反应,第一步不可逆。
酮:速控步骤为第二步。
C -进攻酮比进攻醛羰基碳难得多。
碱催化利于有醛的缩合,而不利于酮的缩合。
②四、羧酸衍生物与亲核试剂的反应(二)结构与活性的关系作为酰基化试剂,其活性为:RCOCl>RCOSR'>(RCO)2O>RCOOR>RCONH2 X: 具有-I效应,C-Cl键的极性大。
酯中烷氧基具有+C效应,增大了酰基与烷氧基间的电子云密度,使酰氧键难于断裂。