分子生物学实验基础知识
- 格式:pdf
- 大小:246.60 KB
- 文档页数:11

生物化学与基础分子生物学实验本实验旨在增进学生对于生物化学与基础分子生物学知识的理解,同时也希望借此机会增强学生的实验动手能力和实验数据分析能力。
本实验主要分为两部分,第一部分是生物化学实验,主要包括蛋白质的提取、纯化和酶促反应的研究。
第二部分是基础分子生物学实验,主要涉及DNA的提取、PCR扩增和凝胶电泳检测等。
一、生物化学实验1. 蛋白质的提取蛋白质的提取是研究蛋白质功能和结构的基础。
常用的蛋白质提取方法有机械破碎法、化学破碎法和生物学破碎法等。
本实验以细胞生物学破碎法为主要方法,即利用超声波或手工研磨等方法将细胞破碎。
其中,手工研磨可以选择石英砂或三氧化二铬等研磨介质。
破碎过程中需加入适量浓度等渗液和抑制剂,以防止蛋白质的降解和氧化。
2. 蛋白质的纯化蛋白质的纯化是进一步研究蛋白质结构和功能的关键。
常用的蛋白质纯化方法包括离子交换、凝胶过滤、透析、亲和层析和电泳等方法。
本实验以离子交换和凝胶过滤为主要方法。
其中,离子交换可利用正离子交换和负离子交换两种模式进行,考虑到蛋白质电荷状态的不同以及离子交换树脂的不同选择,从而使得目标蛋白质与其它蛋白质的区分度大大增加。
凝胶过滤则利用凝胶的孔径大小进行分离纯化。
3. 酶促反应的研究酶促反应是生物化学研究的重要组成部分,可以研究酶的特性、动力学以及酶对于特定底物和抑制剂的亲和性等。
本实验选择酶促细胞色素C氧化为模型反应。
反应中需要考虑诸多因素,如温度、pH、反应时间等,同时还需考虑反应体系中酶、底物和抑制剂的摩尔比例关系。
二、基础分子生物学实验1. DNA的提取DNA的提取是基础分子生物学实验的关键步骤,其目的是提高纯度和量。
常用的DNA提取方法有化学法、机械法、热平衡法和离心法等。
本实验以盐酸摇法为主要方法进行DNA的提取。
其中将细胞经过适当处理后加入盐酸和β-己糖苷酯,在恒温和摇动条件下分离得到DNA。
2. PCR扩增PCR是分子生物学中的核心技术之一,是一种复合酶链反应。
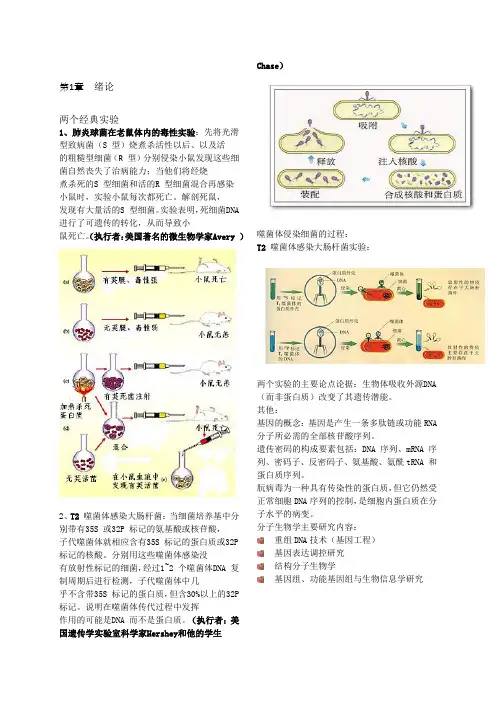
第1章绪论两个经典实验1、肺炎球菌在老鼠体内的毒性实验:先将光滑型致病菌(S 型)烧煮杀活性以后、以及活的粗糙型细菌(R 型)分别侵染小鼠发现这些细菌自然丧失了治病能力;当他们将经烧煮杀死的S 型细菌和活的R 型细菌混合再感染小鼠时,实验小鼠每次都死亡。
解剖死鼠,发现有大量活的S 型细菌。
实验表明,死细菌DNA 进行了可遗传的转化,从而导致小鼠死亡。
(执行者:美国著名的微生物学家Avery )2、T2 噬菌体感染大肠杆菌:当细菌培养基中分别带有35S 或32P 标记的氨基酸或核苷酸,子代噬菌体就相应含有35S 标记的蛋白质或32P 标记的核酸。
分别用这些噬菌体感染没有放射性标记的细菌,经过1~2 个噬菌体DNA 复制周期后进行检测,子代噬菌体中几乎不含带35S 标记的蛋白质,但含30%以上的32P 标记。
说明在噬菌体传代过程中发挥作用的可能是DNA 而不是蛋白质。
(执行者:美国遗传学实验室科学家Hershey和他的学生Chase)噬菌体侵染细菌的过程:T2 噬菌体感染大肠杆菌实验:两个实验的主要论点论据:生物体吸收外源DNA (而非蛋白质)改变了其遗传潜能。
其他:基因的概念:基因是产生一条多肽链或功能RNA 分子所必需的全部核苷酸序列。
遗传密码的构成要素包括:DNA序列、mRNA 序列、密码子、反密码子、氨基酸、氨酰tRNA 和蛋白质序列。
朊病毒为一种具有传染性的蛋白质,但它仍然受正常细胞DNA序列的控制,是细胞内蛋白质在分子水平的病变。
分子生物学主要研究内容:重组DNA技术(基因工程)基因表达调控研究结构分子生物学基因组、功能基因组与生物信息学研究第2章染色体与DNA核苷酸通过3,5-磷酸二脂键连接形成链状的生物大分子。
每个核苷酸由磷酸、核糖(又称戊糖)和碱基构成2.1染色体2.1.1概述染色体包括DNA和蛋白质(组蛋白和非组蛋白),为遗传物质的主要载体。
性质:1、分子结构相对稳定;2、能够自我复制,使亲、子代之间保持连续性;3、能指导蛋白质的合成,从而控制生命过程;4、能产生可遗传的变异。

实验质粒DNA的碱裂解法提取与纯化一、实验原理细菌质粒是一类双链、闭环的DNA, 大小范围从1kb至200kb以上不等。
各种质粒都是存在于细胞质中、独立于细胞染色体之外的自主复制的遗传成份, 通常情况下可持续稳定地处于染色体外的游离状态, 但在一定条件下也会可逆地整合到寄主染色体上, 随着染色体的复制而复制, 并通过细胞分裂传递到后代。
质粒已成为目前最常用的基因克隆的载体分子, 重要的条件是可获得大量纯化的质粒DNA分子。
目前已有许多方法可用于质粒DNA的提取, 本实验采用碱裂解法提取质粒DNA。
碱裂解法是一种应用最为广泛的制备质粒DNA的方法, 其基本原理为: 当菌体在NaOH和SDS溶液中裂解时, 蛋白质与DNA发生变性, 当加入中和液后, 质粒DNA分子能够迅速复性, 呈溶解状态, 离心时留在上清中;蛋白质与染色体DNA不变性而呈絮状, 离心时可沉淀下来。
纯化质粒DNA的方法通常是利用了质粒DNA相对较小及共价闭环两个性质。
例如, 氯化铯-溴化乙锭梯度平衡离心、离子交换层析、凝胶过滤层析、聚乙二醇分级沉淀等方法, 但这些方法相对昂贵或费时。
对于小量制备的质粒DNA, 经过苯酚、氯仿抽提, RNA酶消化和乙醇沉淀等简单步骤去除残余蛋白质和RNA, 所得纯化的质粒DNA已可满足细菌转化、DNA片段的分离和酶切、常规亚克隆及探针标记等要求, 故在分子生物学实验室中常用。
二、实验试剂1.溶液Ⅰ: 50mM葡萄糖, 25mM Tris-HCl(pH 8.0), 10mM EDTA(pH 8.0)。
1M Tris-HCl(pH 8.0)12.5ml, 0.5M EDTA(pH 8.0)10ml, 葡萄糖4.730g, 加ddH2O至500ml。
在10 lbf/in2高压灭菌15min , 贮存于4℃。
2.溶液Ⅱ: 0.2N NaOH, 1% SDS。
2N NaOH 1ml, 10%SDS 1ml, 加ddH2O至10ml。

分子生物学实验分子生物学实验是一种研究生物体分子结构、功能和交互作用的实验方法。
本文将介绍分子生物学实验的一般步骤和常用技术,并以DNA提取和PCR扩增为例,详细描述了实验的具体步骤和操作。
分子生物学实验一般包括以下几个步骤:实验前的准备、生物样品的采集和处理、核酸提取、酶切和电泳、PCR扩增、蛋白质表达等。
实验前的准备包括实验设计、试剂的准备和设备的调试。
根据实验目的和问题,确定实验设计和具体操作步骤,选择适当的试剂和设备,并对实验条件进行优化。
生物样品的采集和处理是分子生物学实验的基础。
根据研究对象不同,可以采集细胞、组织、血液等生物样品,并进行预处理,如细胞培养、组织切片、离心等。
核酸提取是从生物样品中分离出核酸的步骤。
核酸提取可以使用化学方法或基于特定原理的商业试剂盒。
其中,常用的方法有酚/氯仿法、骨架蛋白法、磁珠法等。
酶切和电泳是分子生物学实验中常用的技术手段。
酶切是通过限制性内切酶对DNA进行特异性切割,生成特定大小的DNA片段。
电泳是利用电场对DNA片段进行分离和检测,可通过琼脂糖凝胶电泳或聚丙烯酰胺凝胶电泳进行。
PCR扩增是一种重要的分子生物学实验技术。
PCR通过不断循环的变性、退火和延伸过程,在体外扩增DNA序列。
PCR 需要DNA模板、引物、核苷酸和聚合酶等关键试剂。
PCR扩增过程包括初始变性、循环扩增和最终延伸。
扩增产物可通过琼脂糖凝胶电泳进行分析和检测。
蛋白质表达是研究蛋白质功能和结构的重要实验手段。
常用的蛋白质表达系统包括原核表达系统和真核表达系统。
表达载体经过构建和转染后,利用细胞的表达机制使蛋白质在体内合成。
总之,分子生物学实验是研究生物体分子结构和功能的重要方法。
通过实验前的准备、生物样品的采集和处理、核酸提取、酶切和电泳、PCR扩增、蛋白质表达等步骤,可以获得关于生物体分子结构和功能的有价值的信息。


分子生物学教程
分子生物学教程主要涵盖了分子生物学的基础理论和实验技术,包括DNA、RNA和蛋白质的结构和功能,基因表达的调控,以及基因工程技术等内容。
具体来说,分子生物学教程一般包括以下几个部分:
1. 分子生物学基础:介绍分子生物学的基本概念、研究领域和学科发展历程。
2. DNA结构和功能:介绍DNA的基本结构、组成和功能,包括DNA的复制、转录和修复等。
3. RNA结构和功能:介绍RNA的基本结构、组成和功能,包括mRNA、tRNA和rRNA等。
4. 蛋白质结构和功能:介绍蛋白质的基本结构、组成和功能,包括酶、受体和通道等。
5. 基因表达调控:介绍基因表达的调控机制,包括转录调控、转录后调控和表观遗传学等。
6. 基因工程技术:介绍基因工程技术的基本原理和应用,包括基因克隆、基因敲除和基因编辑等。
7. 实验技术:介绍分子生物学实验的基本技术和方法,包括PCR、Western blot、基因表达分析等。
此外,分子生物学教程还包括一些进阶内容,如基因组学、蛋白质组学和代谢组学等新兴领域,以及分子生物学在医学、农业和工业等领域的应用。
总之,分子生物学教程旨在为学生提供全面的分子生物学知识和实验技能,为学生未来的科研或职业发展奠定基础。

分子生物学基本实验操作1.DNA提取:DNA提取是分子生物学中的基础实验操作,目的是从生物组织或细胞中提取出纯净的DNA样品。
常用的DNA提取方法包括酚氯仿法、盐法和商业化提取试剂盒。
该实验操作通常包括细胞破碎、蛋白质去除、DNA沉淀和洗涤等步骤。
2.PCR:聚合酶链反应(PCR)是分子生物学中常用的方法,用于扩增特定的DNA片段。
PCR通过加入DNA模板、引物、碱基和聚合酶,利用循环反应的方式在体外合成特定序列的DNA。
PCR通常包括三个步骤:变性、退火和延伸。
3.凝胶电泳:凝胶电泳是一种分离和分析DNA、RNA和蛋白质的常用方法。
通过将待测样品加载到凝胶中,然后通过电场使DNA、RNA或蛋白质在凝胶中迁移,可以根据迁移速度和分子大小进行分离和定性。
4. Western blot:Western blot是一种用于检测特定蛋白质的方法。
该方法通过将待测样品进行电泳分离,然后将蛋白质转移到膜上,并用特异性抗体与目标蛋白质结合,最后再用染色剂或化学发光来检测目标蛋白质的存在。
5.DNA克隆:DNA克隆是将DNA片段插入到载体DNA中的过程,用于研究和重组DNA。
常用的DNA克隆方法包括限制性内切酶切割、连接酶反应和转化。
通过将DNA片段插入载体中并转化至宿主细胞,可以大量复制目标DNA并随后进行研究。
6.基因测序:基因测序是确定DNA或RNA序列的方法,用于分析基因组、转录组和序列变异。
常用的基因测序方法包括链终止法(Sanger测序)和下一代测序(NGS)。
通过测序,可以获取DNA或RNA的序列信息,并进一步研究基因功能和变异。
7.基因表达分析:基因表达分析通过检测RNA水平来研究基因的表达情况。
常用的方法包括实时定量PCR、Northern blot和转录组测序。
这些方法可以定性和定量地研究基因的表达水平,并帮助解析基因调控和信号通路。
这些是分子生物学的一些基本实验操作。
当然,随着技术和方法的不断发展,分子生物学领域中还有许多其他的实验操作,用于研究生物分子结构和功能。


1. DNA胶回收实验中Binding Buffer, Wash solution , Elution Buffer 的作用分别是什么?答:Binding Buffer是为了增加洗脱柱对核酸的结合活性;Wash solution的作用是洗掉柱子里除核酸以外的杂质;Elution Buffer就是最后把DNA从柱子上洗脱下来使用的溶液,一般是PH=8.0的TE,dd水也可以。
2. 植物学中6-BA是什么?答:6-BA是6-苄氨基嘌呤,是一种人工合成的细胞分裂素。
3. 继代培养是指愈伤组织在培养基上生长一段时间后,营养物枯竭,水分散失,并已经积累了一些代谢产物,此时需要将这些组织转移到新的培养基上,这种转移称为继代培养。
也可以称为传代培养。
而原代培养的定意是:直接从机体取下细胞、组织和器官后立即进行培养。
因此,较为严格地说是指成功传代之前的培养。
4. 琼脂糖凝胶电泳应用于核酸,SDS-PAGE应用于蛋白质。
5. 什么是OriC ?答:大肠杆菌染色体DNA复制起点为OriC。
它由422bp的DNA片段组成,其核苷酸序列已经搞清。
6. Rosseta(DE3)和Transetta(DE3)都是大肠杆菌的感受态细胞。
7. optimizing 优化;最佳化;最佳的optimum 最佳的;最适宜的8. 什么叫阳性克隆?答:含有重组DNA分子的克隆子被称为重组子。
如果重组子中含有外源目的基因则又称为阳性克隆子或期望重组子。
9. OD600是什么意思?答:OD600指的是某种溶液在600nm波长处的吸光值。
吸光值正比于溶液中的吸光物质的浓度,相应地与样品的透过率T值成反比,在数值上来说,它们之间是对数关系。
OD即是optical density 的意思10. 什么是菌液PCR?11.Ultratpure水(UP水)是超纯水,dd水是双蒸水(二次蒸馏),DI水是去离子水,D水是蒸馏水,RO水也称纯水。
12.transetta是北京Transgene(全式金)生物技术有限公司的一款感受态细胞的产品。

分子生物学基本技术一、引言分子生物学是研究生物体的分子结构、功能和相互关系的学科。
分子生物学基本技术是指在分子水平上进行研究的实验技术和方法。
本文将介绍几种常用的分子生物学基本技术。
二、聚合酶链反应(PCR)聚合酶链反应是一种用于扩增DNA片段的技术。
它可以从少量DNA样本中扩增出大量的目标DNA片段。
PCR的原理是通过不断重复DNA的变性、引物结合和DNA合成的过程,使目标DNA序列扩增到可检测的水平。
PCR广泛应用于基因克隆、基因检测、遗传学研究等领域。
三、DNA电泳DNA电泳是一种通过电场作用使DNA分子在凝胶中迁移的技术。
DNA的迁移速度与其分子大小成反比,因此可以根据DNA片段的大小进行分离和检测。
在DNA电泳中,DNA样品首先经过限制性内切酶切割,然后在凝胶电泳中进行分离。
最后,通过染色剂染色,可观察到DNA片段的分离结果。
四、基因克隆基因克隆是指将感兴趣的DNA片段插入到载体DNA中,形成重组DNA分子的过程。
常用的克隆载体包括质粒、噬菌体等。
基因克隆技术可以用于基因的定位、表达和功能研究。
克隆的基本步骤包括DNA片段的切割、载体与DNA片段的连接、转化等。
五、蛋白质表达与纯化蛋白质表达与纯化是研究蛋白质结构和功能的重要手段。
常用的表达系统包括原核表达系统(如大肠杆菌)和真核表达系统(如哺乳动物细胞)。
表达蛋白质的基本步骤包括构建表达载体、转化表达宿主细胞、诱导表达、蛋白质纯化等。
六、核酸杂交核酸杂交是一种通过DNA或RNA的互补碱基配对形成双链结构的技术。
核酸杂交可用于检测目标DNA或RNA的存在、定位和表达水平。
常用的核酸杂交技术包括Southern blotting、Northern blotting和in situ杂交等。
七、蛋白质相互作用研究蛋白质相互作用是细胞内发生的重要生物学过程。
研究蛋白质相互作用可以揭示蛋白质的功能和信号转导机制。
常用的蛋白质相互作用研究技术包括酵母双杂交、共免疫沉淀、荧光共振能量转移等。

分子生物学实验分子生物学实验I. 实验概述分子生物学是生物学的一个重要分支,主要研究生物分子的结构、功能及其在生命过程中的作用。
在现代生命科学研究中,分子生物学技术的应用越来越广泛,包括基因克隆、基因表达、蛋白质结构、信号转导等多个方面。
本实验将介绍几种基本的分子生物学实验操作,包括DNA的提取、PCR扩增、电泳检测和蛋白质的SDS-PAGE分析,旨在提高学生对分子生物学基础知识和实验技能的掌握。
II. 实验材料及设备1. 细菌培养基、磷酸盐缓冲液、EDTA、裂解液等试剂;2. 离心管、洗涤管、PCR管、电泳槽等设备;3. 离心机、PCR仪、电泳仪等设备。
III. 实验步骤1. DNA的提取(1) 收集细胞收集需要提取DNA的细胞,如细菌、白细胞等。
将细胞转移到1.5mL离心管中。
(2) 细胞裂解加入200μl裂解液,轻轻摇晃离心管,使细胞充分裂解。
离心管可置于65°C水浴中处理10分钟,使DNA完全裂解。
(3) DNA提取加入500μl磷酸盐缓冲液和10μl EDTA,混匀后离心5分钟。
取上清液转移至新的离心管中,加入等体积的异丙醇,并轻轻倒置,使DNA在异丙醇界面上结团。
放置室温下10分钟,使用洗涤管将DNA结团转移到另一离心管中。
加入70%乙醇溶液洗涤2-3次,最后去除乙醇,用无菌水溶解DNA。
2. PCR扩增(1) 设计引物、制备PCR反应液按照所需扩增的DNA序列设计引物,制备PCR反应液,包括所需模板DNA、引物、Taq聚合酶、MgCl2等。
(2) PCR条件将PCR反应管放置PCR仪中,经过若干个循环,达到最终PCR产物的扩增。
PCR条件通常应选择对应引物特异性、Tm温度适中,并根据Taq聚合酶的活性和反应体系的最适条件优化所得。
常用的PCR条件为95℃预变性5min,94℃变性30s,Tm温度退火30s,72℃延伸1min,循环30-35次,最后72℃加延伸10min。
分子生物学实验引言分子生物学实验是研究生物体分子层面的结构和功能的实验方法。
通过在分子水平上研究细胞中的基因表达、蛋白质合成和代谢等过程,可以全面了解生物体的生理机制和疾病发生的分子基础。
本文将介绍常见的分子生物学实验方法和技术。
1. DNA提取实验DNA提取是分子生物学实验中的基础步骤,它的目的是从细胞中分离出DNA。
常用的DNA提取方法有酚/氯仿法、CTAB法和商业试剂盒法等。
以下是酚/氯仿法的步骤:1.收集样本组织或细胞:可以使用动植物组织、细菌、真菌等样本。
2.细胞破碎:使用细胞破碎缓冲液将样本破碎,释放出内部的细胞和胞浆。
3.蛋白质沉淀:加入酚/氯仿缓冲液,使蛋白质从细胞裂解物中沉淀。
4.DNA沉淀:将上一步的上清液加入异丙醇中沉淀DNA。
5.洗涤和溶解:用乙醇洗涤并净化DNA沉淀,最后用缓冲液溶解DNA。
2. PCR实验PCR(聚合酶链反应)是分子生物学中的一种重要技术,用于扩增特定的DNA片段。
PCR实验一般包括以下步骤:1.DNA模板准备:提取好的DNA作为PCR反应的模板。
2.反应组分配置:配置PCR反应体系,包括引物、脱氧核苷酸(dNTPs)、聚合酶和缓冲液等。
3.反应条件设定:设置PCR反应的温度和时间参数,包括变性、退火和延伸步骤。
4.PCR扩增反应:将PCR反应体系放入热循环仪中进行循环扩增。
5.PCR产物分析:使用凝胶电泳等方法对PCR产物进行分析和检测。
3. 克隆实验克隆实验是将DNA片段插入到载体DNA中,并通过细胞转化和筛选得到含有目标DNA的克隆。
以下是常见的克隆实验步骤:1.DNA片段选择:根据需要选择目标DNA片段,并通过酶切或PCR方法制备。
2.载体准备:选择适当的载体,如质粒或噬菌体,并进行酶切或PCR扩增。
3.构建重组体:将目标DNA片段和载体DNA连接,形成重组DNA。
4.细胞转化:将重组DNA引入宿主细胞中。
5.筛选克隆:通过筛选方法(如抗生素筛选)获得含有目标DNA的克隆。
《分子生物学》实验讲义实验一分子生物学实验基础知识及常用仪器介绍实验二质粒DNA分离纯化实验三琼脂糖凝胶电泳实验四聚合酶链反应(PCR)检测质粒DNA实验五限制酶切鉴定质粒DNA实验一分子生物学实验基础知识及常用仪器介绍一、实验目的了解分子生物学实验特点,了解分子生物学实验室常用设备及基本实验操作。
二、实验内容1.分子生物学实验知识⑴严格操作规程分子生物学实验一般比较复杂,如所用试剂多、操作步骤多、实验时间长等,因此为保证实验效果,在实验室中一定要有整体观念,严格按照操作规程进行。
⑵耐心细致操作实验中不能急于求成,特别是对于初入门者,应反复操作,积累经验。
⑶习惯微量操作在分子生物学实验中,试剂的用量往往很少,常常细到1ul液体、ug或ng固体,这是平常肉眼很难看到的,所以刚刚接触实验的人往往感到不习惯,总是担心要取的东西能否看到、准不准确,操作的样品会不会丢失,总是想加大反应体积,以为越多越好。
这些观念都是错误的。
只有定时定量加入液体,才能保证实验成功,所以平时应加以练习,逐渐建立微量操作的观念才能解决好问题。
⑷防止实验污染分子生物学实验的对象主要是核酸,不同生物材料的DNA和DNA之间,不同的样品之间,核酸酶等蛋白酶与核酸之间,产物与反应物之间都有可能造成污染,最终导致实验的失败。
故要从所用试剂、仪器设备、耗材及操作人员等方面进行防止污染的操作。
⑸正确处理试剂分子生物学实验中对试剂的要求十分严格,包括试剂的等级、配制、除菌储备等各方面均有严格要求。
⑹注意实验安全分子生物学实验中,操作者常会接触一些对人体有害的试剂,必须实验安全要求进行实验操作,否则会给实验室甚至整个人类带来巨大的危害。
2.分子生物学实验常用仪器介绍⑴微量取液器⑵水纯化装置(离子交换器、超纯水装置)⑶离心机(低速、高速、超速)⑷电泳装置(电泳仪、电泳槽)⑸灭菌设备(高压蒸汽灭菌锅、过滤除菌器)⑹超净工作台⑺PCR仪⑻凝胶成像系统(紫外分析仪、核酸凝胶电泳图谱的记录)⑼温度控制设备(冷冻设备、培养箱、水浴箱、烤箱)⑽其它设备(紫外可见分光光度计、微波炉、凝胶干燥器、真空干燥仪)3.分子生物学基本实验操作⑴基因组DNA的分离与纯化(核酸浓度和纯度测定)⑵真核细胞mRNA的分离与纯化⑶质粒DNA的提取⑷PCR基因扩增实验⑸限制性内切酶酶切实验⑹DNA重组技术⑺DNA转移技术⑻DNA测序:化学法、双脱氧链终止法⑼核酸探针的制备技术:末端标记、PCR法制探针、非放射性探针⑽分子杂交技术:Southern印迹、Northern印迹和Western印迹4.微量移液器的使用可调节微量移液器标准操作程序(适用的液体:水、缓冲液、稀释的盐溶液和酸碱溶液):⑴调节数字至所需体积;⑵装上吸嘴(不同规格的移液器用不同的吸头),注意气密性);⑶按到第一档,垂直进入液面几毫米;⑷缓慢松开控制按钮(否则液体进入吸头过速会导致液体倒吸入移液器内部吸入体积减少);⑸停顿1s后将吸嘴提离开液面;⑹平稳按压打出液体。
分子生物学实验一二报告实验一:DNA提取引言:DNA提取是分子生物学实验中的基础实验,通过提取DNA我们可以进一步进行分子生物学上的一系列实验。
DNA提取的目的是从细胞中分离出DNA,常用于构建基因库、PCR扩增等实验。
材料与方法:1.取一定数量的细胞样本,如细菌、植物、动物组织等。
2.加入细胞裂解缓冲液,将细胞破裂释放DNA。
3.加入蛋白酶K以降解蛋白质。
4.加入酒精使DNA沉淀,并用无菌纯水洗涤DNA沉淀。
5. 用Tris-EDTA缓冲液溶解DNA。
6.用紫外可见光谱仪检测DNA浓度和纯度。
结果与讨论:通过以上步骤,我们成功地从细胞中提取出了DNA。
观察到DNA溶液呈现典型的黄绿色,说明DNA浓度较高。
利用紫外可见光谱仪检测DNA的浓度和纯度,结果显示DNA浓度为2μg/μL,纯度(A260/A280)为1.8,表明提取的DNA质量良好。
实验二:PCR扩增引言:PCR全称聚合酶链式反应,是一种快速、特异性并且高灵敏度的DNA扩增技术。
PCR可以扩增出目标DNA的大量复制品,常用于基因克隆、基因突变分析等实验。
材料与方法:1.准备PCR反应体系,包括目标DNA,引物,聚合酶、缓冲液及dNTPs。
2.将反应体系加入PCR仪中,设置好反应条件(温度、时间)。
3.进行PCR扩增反应。
4.用琼脂糖凝胶电泳检测PCR产物。
结果与讨论:通过PCR扩增反应,我们成功得到了目标DNA的扩增产物。
在琼脂糖凝胶电泳中观察到明显的目标DNA条带,且相对应的分子量与预期一致。
这表明PCR扩增反应成功地复制出了目标DNA,并得到纯净的PCR产物。
结论:通过DNA提取实验,我们成功地从细胞中提取出了DNA,并通过PCR扩增技术得到了目标DNA的扩增产物。
这些结果验证了我们实验的有效性,并为后续的分子生物学研究奠定了基础。
附注:以上报告仅为示例,实际报告应根据具体实验结果和实验目的进行撰写。
分子生物学一、名词解释1.ORF 答:ORF是open reading frame的缩写,即开放阅读框架。
在DNA链上,由蛋白质合成的起始密码开始,到终止密码为止的一个连续编码列,叫做一个开放阅读框架。
2.结构基因答:结构基因(structural genes)可被转录形成mRNA,并翻译成多肽链,构成各种结构蛋白质或催化各种生化反应的酶和激素等。
3.断裂基因答:基因是核酸分子中贮存遗传信息的遗传单位,一个基因不仅仅包括编码蛋白质或RNA 的核酸序列,还包括保证转录所必需的调控序列、位于编码区 5' 端与 3' 端的非编码序列和内含子。
真核生物的结构基因,由若干个编码区和非编码区互相间隔开但又连续镶嵌而成,去除非编码区再连接后,可翻译出由连续氨基酸组成的完整蛋白质,这些基因称为断裂基因(split gene)。
4.选择性剪接答:选择性剪接(也叫可变剪接)是指从一个mRNA前体中通过不同的剪接方式(选择不同的剪接位点组合)产生不同的mRNA剪接异构体的过程,而最终的蛋白产物会表现出不同或者是相互拮抗的功能和结构特性,或者,在相同的细胞中由于表达水平的不同而导致不同的表型。
5.C值答:基因组的大小通常以其DNA的含量来表示,我们把一种生物体单倍体基因组DNA的总量成为C值(C value)。
6.生物大分子答:生物大分子指的是作为生物体内主要活性成分的各种分子量达到上万或更多的有机分子。
常见的生物大分子包括蛋白质、核酸、脂类、糖类。
7.酚抽提法答:酚抽提法最初于1976年由Stafford及其同事提出,通过改良,以含EDTA、SDS及无DNA酶的RNA酶裂解缓冲液破碎细胞,经蛋白酶K处理后,用pH8.0的Tris饱和酚抽提DNA,重复抽提至一定纯度后,根据不同需要进行透析或沉淀处理获得所需的DNA样品。
8.凝胶过滤层析答:凝胶过滤层析也称分子排阻层析或分子筛层析,利用凝胶分子筛对大小、形状不同的分子进行层析分离,是根据分子大小分离蛋白质混合物最有效的方法之一。
分子生物学实验技术分子生物学是现代生物学的重要分支之一,其在疾病预防、治疗和生物科技等方面有广泛应用。
本文将介绍分子生物学实验中常用的技术,并讨论其原理和应用。
一、基本实验技术1. DNA/RNA提取技术DNA/RNA提取是分子生物学实验中的基础技术之一。
DNA/RNA提取的目的是从细胞或组织中提取高质量的DNA或RNA,为其后续检测和研究做好准备。
现在市场上有多种DNA/RNA提取试剂盒,供实验室使用。
通常,提取DNA首先将组织/细胞裂解,然后进行蛋白质沉淀、DNA沉淀、洗涤和重溶等步骤。
而提取RNA则需要防止RNA酶的污染并保护RNA的完整性。
RNA提取常见的方法是直接裂解和三步酚-氯仿法等。
2. PCR技术PCR(聚合酶链式反应)技术是一种常用的分子生物学技术,用于扩增DNA片段。
PCR反应是在一个热循环下进行的,包括退火、结合和扩增阶段。
其中,退火温度用于将引物与靶DNA结合,获得高特异性;扩增阶段用于扩增目标DNA片段,通常在72℃左右进行。
PCR技术广泛应用于疾病的诊断、基因多态性分析、DNA指纹鉴定和基因工程等方面。
对于基因工程,PCR技术在基因克隆、定量PCR、mutagenesis、突变扫描和芯片检测等方面也有重要应用。
3. 转染技术转染技术是指将外源基因或其他化合物转入目标细胞中的技术。
常用的转染方法包括:病毒介导的转染、电穿孔、化学转染及基于脂质体的转染等。
转染技术在基因治疗、模型建立、基因表达分析、药物筛选和基因敲除等方面都有广泛应用。
二、高级实验技术1. 基因测序技术基因测序是分子生物学中应用最广泛的技术之一,用于确定DNA序列。
常用的基因测序技术包括Sanger测序和新一代测序(NGS)技术。
Sanger测序是一种传统的测序技术,通过DNA聚合酶、DNA模板、引物和ddNTPs(二脱氧核苷三磷酸)来扩增和定序DNA。
此外,NGS技术的基本原理是平行测序,利用高通量测序技术对DNA样本进行重复测序,得到高质量的DNA序列。
分子生物学实验引言分子生物学是研究生物分子结构与功能的一门学科,通过实验手段来研究分子水平上的生物现象。
分子生物学实验是该学科的基础,通过实验可以得到有关分子生物学的重要数据和结论。
本文将介绍分子生物学实验的基本原理、实验方法和常用技术。
实验目的分子生物学实验的目的是为了研究和探究生物分子结构、功能和相互作用,揭示生物体内基因表达和调控的机制。
具体实验目的可以根据研究方向和课题的需求来确定。
实验材料和仪器•DNA/RNA样品:可通过提取方法从细胞或组织中获得。
•酶:常见的酶有限制性核酸内切酶、DNA/RNA聚合酶等。
•缓冲液和试剂:用于调节反应条件和提供必要的物质。
•电泳仪:用于分离和检测DNA/RNA片段。
•PCR仪:用于DNA扩增反应。
•逆转录仪:用于合成cDNA。
•光镜和荧光显微镜:用于观察和记录实验结果。
基本原理DNA/RNA提取DNA/RNA提取是分子生物学实验的基础步骤,通过此步骤可以从细胞或组织中提取出DNA或RNA,并用于后续反应。
提取方法主要包括细胞破碎、蛋白酶处理、有机溶剂抽提和纯化等。
聚合酶链式反应(PCR)PCR是一种在体外合成DNA的方法,能快速扩增DNA序列。
PCR反应需要DNA模板、引物、聚合酶和核苷酸等组分,通过多个循环的温度变化,重复进行DNA的核酸链分离、引物结合和DNA合成等步骤,达到扩增目标序列的目的。
凝胶电泳凝胶电泳是一种常用的分离DNA/RNA片段的方法。
将DNA/RNA样品加入琼脂糖凝胶孔隙中,加电使其迁移,根据片段大小不同,进行分离和检测。
凝胶电泳主要分为琼脂糖凝胶电泳和聚丙烯酰胺凝胶电泳等。
聚合酶链反应-限制性片段长度多态性(PCR-RFLP)PCR-RFLP是一种通过PCR扩增后的DNA样品再经由限制性核酸内切酶的切割,根据不同的酶切位点产生不同的DNA片段组合,从而区分不同基因型的方法。
PCR-RFLP常用于基因型鉴定和基因突变检测等。
基因克隆基因克隆是研究分子生物学的重要方法之一,通过将DNA片段插入到载体DNA中,形成重组DNA,再将其转化到宿主细胞中,实现大量复制和表达目的基因。