第三章 氨基酸分解代谢 (30章).
- 格式:doc
- 大小:46.50 KB
- 文档页数:4




第30、31章、氨基酸代谢(下册P299和p340)本章的重点:1、掌握脱氨基的多种方式。
2、掌握转氨基作用的概念。
掌握体内最重要的转氨酶(GPT、GOT)的名称、催化的反应并了解它们在临床诊断上的主要应用。
掌握转氨酶的辅酶的名称、与VitB6的关系并了解其作用机制。
3、熟悉L-谷氨酸脱氢酶(GLDH)催化的反应。
4、掌握“一般联合脱氨基作用”的概念、进行部位及反应过程。
熟悉“嘌呤核苷酸循环”的进行部位并了解其大致反应过程。
本章的主要内容:细胞总是不断地从氨基酸合成蛋白质,又把蛋白质降解为氨基酸,由此可排除不正常蛋白质,排除积累过多的酶和“调节蛋白”,使细胞代谢得以正常进行。
对正常蛋白质细胞也要进行有选择的降解。
蛋白质降解为氨基酸后氨基酸会继续进行分解代谢。
§3.1 氨基酸分解代谢(P303):氨基酸的分解代谢总是先脱去氨基。
脱氨基的方式,不同生物不完全相同。
氧化脱氨基作用普遍存在于动植物中,非氧化脱氨基作用主要见于微生物。
陆生脊椎动物将脱下的氨基合成尿素,脱氨后的氨基酸碳骨架进行氧化分解,形成能进入柠檬酸循环的化合物,最后氧化成CO2和H2 O。
(一)氨基酸的脱氨基作用:绝大多数氨基酸脱氨基出自转氨基作用,氨基酸与α-酮戊二酸在氨基转移酶作用下发生氨基酸脱氨同时生成Glu(也有的转到草酰乙酸上生成Asp)。
(1)氨基转移反应分两步进行:1.氨基酸先将氨基转移到酶分子的辅酶磷酸吡哆醛(PLP)上,自身形成α-酮酸,PLP 则形成磷酸吡哆胺(PMP)。
2.PMP的氨基转移到α-酮戊二酸(或草酰乙酸)上,生成Glu(或Asp),PLP恢复。
详细机制可见P305 图30-3。
(2)转氨酶:已发现有50种以上的转氨酶,大多数需要α-酮戊二酸为氨基受体。
1.丙氨酸转氨酶(ALT),又称谷丙转氨酶(G..P.T),主要存在于肝细胞浆中,用于诊断肝病。
2.天冬氨酸转氨酶(AST),又称谷草转氨酶(G..O.T),在心、肝中含量丰富,可用于测定心肌梗死,肝病。



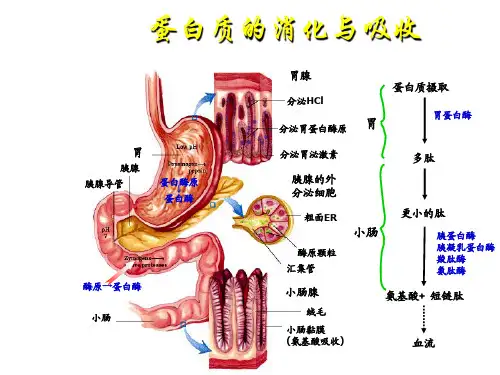

第三章氨基酸分解代谢下册P299 30章细胞总是不断地从氨基酸合成蛋白质,又把蛋白质降解为氨基酸,由此可排除不正常蛋白质,排除积累过多的酶和“调节蛋白”,使细胞代谢得以正常进行。
对正常蛋白质细胞也要进行有选择的降解。
蛋白质降解为氨基酸后氨基酸会继续进行分解代谢。
§3.1 氨基酸分解代谢(P303):氨基酸的分解代谢总是先脱去氨基。
脱氨基的方式,不同生物不完全相同。
氧化脱氨基作用普遍存在于动植物中,非氧化脱氨基作用主要见于微生物。
陆生脊椎动物将脱下的氨基合成尿素,脱氨后的氨基酸碳骨架进行氧化分解,形成能进入柠檬酸循环的化合物,最后氧化成CO2和H2 O。
(一)氨基酸的脱氨基作用:绝大多数氨基酸脱氨基出自转氨基作用,氨基酸与α-酮戊二酸在氨基转移酶作用下发生氨基酸脱氨同时生成Glu(也有的转到草酰乙酸上生成Asp)。
(1)氨基转移反应分两步进行:1.氨基酸先将氨基转移到酶分子的辅酶磷酸吡哆醛(PLP)上,自身形成α-酮酸,PLP则形成磷酸吡哆胺(PMP)。
2.PMP的氨基转移到α-酮戊二酸(或草酰乙酸)上,生成Glu(或Asp),PLP恢复。
详细机制可见P305 图30-3。
(2)转氨酶:已发现有50种以上的转氨酶,大多数需要α-酮戊二酸为氨基受体。
1.丙氨酸转氨酶(ALT),又称谷丙转氨酶(G..P.T),主要存在于肝细胞浆中,用于诊断肝病。
2.天冬氨酸转氨酶(AST),又称谷草转氨酶(G..O.T),在心、肝中含量丰富,可用于测定心肌梗死,肝病。
人体转氨酶以ALT和AST活力最高。
(二)氧化脱氨基作用在氧化脱氨基作用中以谷氨酸脱氢酶活性最高,该酶以NAD(P)+为辅酶,使Glu 经氧化作用,脱2H,再水解脱去氨基,生成α-酮戊二酸,如P306 图30-4所示。
谷氨酸脱氢酶由6个相同的亚基构成,分子量为33万,是变构调节酶,被GTP和ATP抑制,被ADP激活。
活性受底物及产物浓度左右。
(三)联合脱氨基作用氨基酸脱氨基重要方式是联合脱氨基作用。
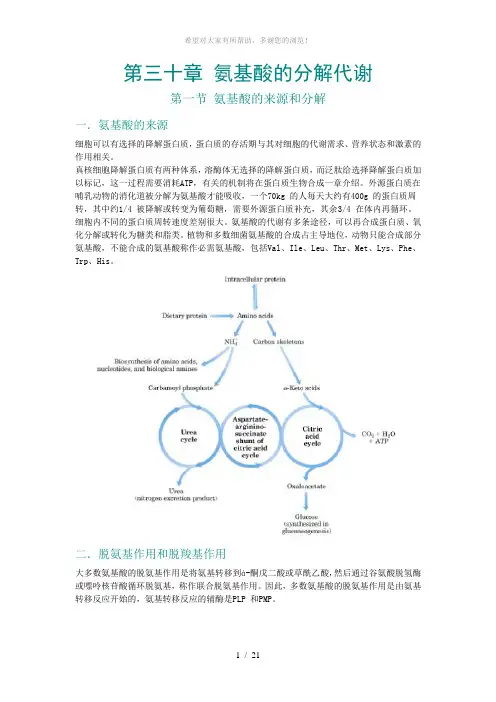
第三十章氨基酸的分解代谢第一节氨基酸的来源和分解一.氨基酸的来源细胞可以有选择的降解蛋白质,蛋白质的存活期与其对细胞的代谢需求、营养状态和激素的作用相关。
真核细胞降解蛋白质有两种体系,溶酶体无选择的降解蛋白质,而泛肽给选择降解蛋白质加以标记,这一过程需要消耗ATP,有关的机制将在蛋白质生物合成一章介绍。
外源蛋白质在哺乳动物的消化道被分解为氨基酸才能吸收,一个70kg 的人每天大约有400g 的蛋白质周转,其中约1/4 被降解或转变为葡萄糖,需要外源蛋白质补充,其余3/4 在体内再循环。
细胞内不同的蛋白质周转速度差别很大。
氨基酸的代谢有多条途径,可以再合成蛋白质、氧化分解或转化为糖类和脂类。
植物和多数细菌氨基酸的合成占主导地位,动物只能合成部分氨基酸,不能合成的氨基酸称作必需氨基酸,包括Val、Ile、Leu、Thr、Met、Lys、Phe、Trp、His。
二.脱氨基作用和脱羧基作用大多数氨基酸的脱氨基作用是将氨基转移到á-酮戊二酸或草酰乙酸,然后通过谷氨酸脱氢酶或嘌呤核苷酸循环脱氨基,称作联合脱氨基作用。
因此,多数氨基酸的脱氨基作用是由氨基转移反应开始的,氨基转移反应的辅酶是PLP 和PMP。
氨基转移反应:氨基酸1+á-酮酸2≒á-酮酸1+氨基酸2。
丙氨酸氨基移换酶催化的反应:氨基移换酶的作用机制:谷氨酸脱氢酶的氧化脱氨基作用:体内过多的氨会使身神经系统中毒,可能的原因是氨会与á-酮戊二酸反应生成谷氨酸,同时消耗NADPH,使柠檬酸循环不能正常进行。
水生生物可以将氨直接排出体外;鸟类和爬行类将氨转化为尿酸排出体外;多数陆生生物将氨转化为尿素排出体外。
氨通常要与谷氨酸反应生成谷氨酰胺(中性,易通过细胞膜),经血液运输到肝脏。
在肝脏再生成谷氨酸和氨,氨用于合成尿素。
在肌肉中,谷氨酸和丙酮酸生成丙氨酸和á-酮戊二酸,丙氨酸经血液运输到肝脏。
在肝脏中,丙氨酸和á-酮戊二酸又生成谷氨酸和丙酮酸,丙酮酸转化为葡萄糖,谷氨酸氧化脱氨基,氨用于合成尿素。

第三章氨基酸分解代谢下册P299 30章细胞总是不断地从氨基酸合成蛋白质,又把蛋白质降解为氨基酸,由此可排除不正常蛋白质,排除积累过多的酶和“调节蛋白”,使细胞代谢得以正常进行。
对正常蛋白质细胞也要进行有选择的降解。
蛋白质降解为氨基酸后氨基酸会继续进行分解代谢。
§3.1 氨基酸分解代谢(P303):氨基酸的分解代谢总是先脱去氨基。
脱氨基的方式,不同生物不完全相同。
氧化脱氨基作用普遍存在于动植物中,非氧化脱氨基作用主要见于微生物。
陆生脊椎动物将脱下的氨基合成尿素,脱氨后的氨基酸碳骨架进行氧化分解,形成能进入柠檬酸循环的化合物,最后氧化成CO2和H2 O。
(一)氨基酸的脱氨基作用:绝大多数氨基酸脱氨基出自转氨基作用,氨基酸与α-酮戊二酸在氨基转移酶作用下发生氨基酸脱氨同时生成Glu(也有的转到草酰乙酸上生成Asp)。
(1)氨基转移反应分两步进行:1.氨基酸先将氨基转移到酶分子的辅酶磷酸吡哆醛(PLP)上,自身形成α-酮酸,PLP则形成磷酸吡哆胺(PMP)。
2.PMP的氨基转移到α-酮戊二酸(或草酰乙酸)上,生成Glu(或Asp),PLP 恢复。
详细机制可见P305 图30-3。
(2)转氨酶:已发现有50种以上的转氨酶,大多数需要α-酮戊二酸为氨基受体。
1.丙氨酸转氨酶(ALT),又称谷丙转氨酶(G..P.T),主要存在于肝细胞浆中,用于诊断肝病。
2.天冬氨酸转氨酶(AST),又称谷草转氨酶(G..O.T),在心、肝中含量丰富,可用于测定心肌梗死,肝病。
人体转氨酶以ALT和AST活力最高。
(二)氧化脱氨基作用在氧化脱氨基作用中以谷氨酸脱氢酶活性最高,该酶以NAD(P)+为辅酶,使Glu经氧化作用,脱2H,再水解脱去氨基,生成α-酮戊二酸,如P306 图30-4所示。
谷氨酸脱氢酶由6个相同的亚基构成,分子量为33万,是变构调节酶,被GTP和ATP抑制,被ADP激活。
活性受底物及产物浓度左右。
(三)联合脱氨基作用氨基酸脱氨基重要方式是联合脱氨基作用。
(1)氨基酸的α-氨基借助转氨作用转移到α-酮戊二酸的分子上,生成相应的α-酮酸和Glu,然后Glu在谷氨酸脱氢酶催化下,脱氨基生成α-酮戊二酸,同时释放出氨(P307图30-5)。
此过程在肌体中广泛存在。
(2)嘌呤核苷酸的联合脱氨基作用:次黄嘌呤核苷酸与Asp作用形成中间产物腺苷酸琥珀酸,后者在裂合酶作用下分解成腺嘌呤核苷酸和延胡索酸,腺嘌呤核苷酸水解生成游离氨基酸和次黄嘌呤核苷酸(P307图30-6)。
此过程在骨骼肌、心肌、肝脏及脑中存在。
(四)氨基酸的脱羧基作用在脱羧酶催化下生成相应的一级胺,产物常有重要生理作用。
Glu →r-氨基丁酸,神经递质,抑制神经。
His →组氨,降血压,刺激胃液分泌。
Tyr →酪氨,升高血压。
(五)氨的命运氨对生物机体有毒,脑对氨极为敏感,血液中含1%的氨就可引起中枢神经系统中毒。
因此生物体必须排泄氨。
水生动物直接排氨,大多数陆生动物排尿素,鸟类和陆生爬行动物排尿酸(结构式见P309)。
[氨的转运]:(1)主要通过Glu,反应如下:谷氨酸合成酶Glu + NH4+ + ATP Glu + ADP + P i + H+Glu为中性物质,易透过细胞膜,由血液到肝脏,在肝细胞中在谷氨酰胺酶作用下分解成Glu和NH3。
Glu是体内氨的一种运输、储存形式,也是氨的暂时解毒方式。
(2)在肌肉中可通过葡萄糖—丙氨酸循环,通过Ala则更经济。
肌肉在活动时消耗糖产生能量时会产生大量丙酮酸,同时产生氨。
两者都需要运送到肝脏中进一步转化,而先将两者转化成Ala再转运到肝脏十分经济。
在肝脏中Ala与α-酮戊二酸反应生成丙酮酸和Glu,丙酮酸经葡糖异生生成葡萄糖,经血液到肌肉中,再供产生能量使用,由此形成循环。
§3.2 尿素的形成尿素中的两个NH2,一个由Glu联合脱氨产生,另一个NH2来自Asp。
羰基来自CO2,由柠檬酸循环产生。
尿素在形成过程中是以鸟氨酸为载体形成尿素循环。
在尿素循环中,一分子鸟氨酸和一分子氨及CO2结合形成瓜氨酸,瓜氨酸与另一分子氨形成精氨酸,Arg水解形成尿素和鸟氨酸,完成一次循环。
尿素循环包括有5步酶反应,2步发生线粒体内,3步发生在细胞溶胶中,如P311 图30-9所示。
(1)氨甲酰磷酸合成(第一个氮原子获取):氨甲酰磷酸合成酶2ATP + HCO3-+ NH+4 + H2O H2NCOOPO32--酮戊二酸(氨甲酰磷酸)Glu+ 2ADP + P i反应中消耗2分子ATP(2)瓜氨酸生成:鸟氨酸转氨甲酰基酶H2NCOOPO32- + 鸟氨酸瓜氨酸+ Pi(3)瓜氨酸离开线粒体中,进入细胞溶胶,反应生成精氨琥珀酸(尿素中第二氮原子获取)。
COO- NH2+NH3+精氨琥珀酸合成酶∣‖∣瓜氨酸+ Asp + ATP -OOCCH2CHNH-C-NH-(CH2)3CHCOO-(精氨琥珀酸) + AMP + PP i(4)精氨酸形成:CHCOOH精氨琥珀酸裂解酶‖精氨琥珀酸Arg + HOOCCH(延胡索酸)生成的延胡索酸为柠檬酸循环中间产物,将尿素循环和柠檬酸循环联系起来。
(5)尿素形成:精氨酸酶Arg + H2O 鸟氨酸+ 尿素鸟氨酸进入下一循环。
总反应耗能,使用3个ADP,生成2个ADP,1个AMP。
总的消耗4个高能键,但在Glu脱氢生成NH3时,产生一分子NADH,可放能。
尿素循环若出现问题,会发生“高血氨症”,使人智力迟钝,神经发育停滞,以至死亡。
§3.3 氨基酸碳骨架的代谢P31420种氨基酸碳骨架,由20种不同的多酶体系进行氧化分解,最后集中形成5种产物进入柠檬酸循环。
这5种产物均为TCA的中间体。
柠檬酸循环(又称三羧酸循环,TCA)是糖、脂肪、蛋白三大物质代谢的共同通路,自乙酰辅酶A起,经柠檬酸等几个三羧酸,最终氧化成CO2和水,20种氨基酸碳骨架氧化分解形成的5种产物:①乙酰辅酶A(包括丙酮酸,乙酰乙酰辅酶A),涉及的氨基酸为Ala、Thr、Gly、Ser、Cys、Phe、Tyr、Leu、Lys 和Trp等十种,简称C3族。
②α-酮戊二酸,涉及的氨基酸为Arg、His、Gln、Pro和Glu等五种,简称C5族。
③琥珀酰辅酶A,涉及的氨基酸为Ile、Met 和Val等三种。
④延胡索酸,涉及的氨基酸为Phe和Tyr,它们除可生成乙酰辅酶A外还可代谢成延胡索酸。
⑤草酰乙酸,涉及氨基酸为Asp和Asn,可简称C4族。
祥见P315 图30-13,氨基酸碳骨架进入TCA途径。
从图中可看出:(1)C3族:A、T、G、S、C五种氨基酸经丙酮酸而形成乙酰辅酶A;F、Y、L、K、W五种氨基酸经乙酰乙酰辅酶A再形成乙酰辅酶A。
(2)C5族:R、H、Q、P四种氨基酸通过E转变成α-酮戊二酸。
(3)I、M、V三种氨基酸经琥珀酰辅酶A进入TCA。
(4)F、Y还可以被氧化酶降解为延胡索酸进入TCA。
(5)C4族:D、N经草酰乙酸进入TCA。
§3.4 生糖氨基酸和生酮氨基酸:生糖氨基酸:能增加尿中葡萄糖排出量,包括能生成丙酮酸,α-酮戊二酸、琥珀酸和草酰乙酸的氨基酸。
生酮氨基酸:能增加尿中酮体排出量的氨基酸,包括在分解过程中转变成乙酰乙酰辅酶A的氨基酸(可进一步生成乙酰乙酸和β-羟丁酸)。
生酮生糖氨基酸:既可生成酮体又可生成糖,如Phe和Tyr。
生酮、生糖氨基酸界限并不十分严格,只Leu为纯粹生酮氨基酸。
糖尿病人尿中酮体除来源于脂肪酸外,还来源于生酮氨基酸。
§3.5 由氨基酸衍生的重要物质:(一)氨基酸与一碳单位:许多氨基酸都可作为一碳单位来源,如Gly、Thr、Ser和His等。
一碳单位与氨基酸代谢、嘌呤和嘧啶生物合成以及S-腺苷甲硫氨酸(甲基提供者)生物合成有关。
一碳单位转移靠四氢叶酸。
(二)氨基酸与生物活性物质:由氨基酸来源的生物活性物质如P332 表30-2所示。
(1)氨基酸代谢:1.黑色素生成:Tyr在酪氨酸羟化酶作用下氧化生成二羟苯丙氨酸(多巴),再在酪氨酸催化下氧化成苯丙氨酸-3,4-醌(多巴醌),然后聚合成黑色素。
反应见333 图30-34。
黑色素过多产生雀斑、老年斑,过少则为白癜风等白化病,用酪氨酸酶抑制剂可治疗黑色素过多,用激活剂可治疗白化病。
2.酪氨酸产生儿茶酚胺类物质:Tyr在酪氨酸羟化酶作用下氧化成多巴,在芳香族氨基酸脱羧酶作用下失羧生成二羟苯乙胺(多巴胺),然后在多巴胺-β-羟化酶作用下氧化生成1-(3,4-二羟苯基)-2-氨基乙醇(去甲肾上腺素或称正肾上腺素),最后在苯乙醇胺-N-转甲基酶作用下甲基化生成肾上腺素,化学名称1-(3,4-二羟苯基)-2-甲胺基乙醇。
祥见P333 图30-35。
肾上腺素和去甲肾上腺素均为交感神经末梢的化学介质,使交感神经兴奋,对心脏、血管有生理作用,使血管收缩、血压急剧上升,为含氮激素。
肾上腺素使血糖升高,促进蛋白、氨基酸和脂肪分解,使肌体应付意外情况。
3.拟肾上腺素:可代替肾上腺素的药。
麻黄碱(N-甲胺基-1-苯基丙醇),为苯丙胺(PPA)类化合物,还原失水为“冰毒”。
麻黄碱生理功能与肾上腺素相似,但有副作用。
4. 抗肾上腺素:肾上腺素受体分为α-受体和β-受体。
β-受体阻断剂:心得宁、心得安可抗心率失常,使心率减慢。
(2)色氨酸代谢产物:1.色氨酸失羧得5-羟色胺。
见P334 图30-36。
5-羟色胺(5-HT)是脊椎动物的一种神经递质,含量与神经兴奋和抑制状态有关,也是血管收缩素,可使心率增加,肠道、支气管收缩。
5-HT拮抗药,可医治肠道运动亢进。
2.吲哚乙酸:为Trp脱氨、失羧氧化后产物。
见P334,为植物生长激素。
3.松果体素:由5-HT乙酰化、甲基化而得。
可促进老年人睡眠和调时差。
(3)组氨酸代谢产物组胺:由His脱羧而得,见P334,可使血管强烈舒张,作用血管平滑肌,抗组氨药(阻断组胺与受体结合),有镇静催眠作用。
(4)牛黄酸:氨基乙磺酸,为Cys氧化脱羧产物,是一种抑制性神经递质。
§3.6 氨基酸代谢缺陷症氨基酸代谢中缺乏某一种酶,都可引起症患,为代谢缺陷症,是分子疾病。
病因和DNA分子突变有关。
已发现氨基酸代谢病30多种,如P336 表30-3所示。
如苯丙酮尿症,缺少苯丙氧酸单加氧酶;尿黑酸症,缺乏尿黑酸氧化酶。